双功能化无机介孔材料对猪胰蛋白酶催化性能的影响
邹 彬,邓 甜,韦诗宇,夏姣姣,霍书豪
(江苏大学食品与生物工程学院,江苏镇江 212013)
双功能化无机介孔材料对猪胰蛋白酶催化性能的影响
邹彬,邓甜,韦诗宇,夏姣姣,霍书豪
(江苏大学食品与生物工程学院,江苏镇江 212013)
通过在SBA-15介孔材料表面引入带有不同官能团及不同亲疏水性质的修饰剂(-SH,-Cl,-NH2,-C1,-C3,-C8及-C16),改善介孔材料与猪胰蛋白酶的结合力及蛋白酶所处微环境,从而提高酶固定化效率,活性及其稳定性。结果表明,官能团修饰后载体固定化酶PT-NH2/C8-SBA活性达到255 U/mg胰蛋白,较之未修饰载体固定化酶PT-SBA活性(195 U/mg胰蛋白)有大幅度的提高;并且重复使用五次及在室温下保持5 d后,PT-NH2/C8-SBA活力仍然能保持初始活力的85%及81%。而PT-SBA仅仅保留了初始活性的51%及67%。固定化酶的酶学性质和催化反应动力学研究表明,底物与固定化酶PT-NH2/C8-SBA具有更好的亲和力,固定化酶PT-NH2/C8-SBA有较高的活力和稳定性。
介孔材料,双官能团,猪胰蛋白酶,表面修饰,固定化
蛋白酶在食品工业中应用广泛,其中作为食品添加剂是蛋白酶重要应用之一。为减少啤酒混浊现象,通常添加蛋白酶以除去啤酒中的蛋白质。蛋白酶还可用于牛肉汁、鸡汁生产来提高产品收率[1-2]。而游离蛋白酶通常稳定性差,自身易团聚而失活,易受到温度、pH影响而活力降低,难从反应系统中分离以至于不能重复使用,使得游离蛋白酶在食品行业中大规模化的应用难以实现[3-4]。因此对游离蛋白酶进行改性,为工业生产提供稳定性更好、活性更高、选择性更专一、极端环境耐受性更强的新酶品种,对整个行业的发展至关重要。
当前主要的改造技术包括固定化技术[5-6]、化学修饰以及定位突变技术[7]。相比定位突变的长周期性,化学修饰后酶仍然无法回收利用,酶的固定化技术是最快速及有效的改造手段。但是蛋白酶直接固定到天然载体材料上,酶分子与载体相互作用力不强,导致酶的负载量低及酶在反应时容易从固定化载体中脱落[8]。此外,酶进入载体孔道后,由于载体材料孔道不能提供给酶天然的催化微环境,相反固定化材料表面带来的空间位阻对底物扩散、酶的空间构象有很大影响,导致酶的活性在固定到材料表面后大幅度降低[9]。
通过引入功能化有机基团对固定化材料的硅羟基表面进行化学修饰,提高酶与固定化载体之间的结合力,改进固定化酶的酶学性质是当前酶固定化研究的重要内容[10-11]。然而目前报道的修饰方法仅仅针对解决酶固定化效率及固定化酶稳定性,或者单一针对解决反应过程中扩散限制效应及活性问题[12-14]。同时提高酶的活性及稳定性仍然是酶固定化过程中面临的难题,Lee等人将猪胰脂肪酶固定化在十二烷基硫酸钠修饰纳米磁性颗粒中,酶催化活性为游离酶的134%,重复使用五次后降低到初始酶活的50%[15]。
然而活性和稳定性同时提高才是推进固定化酶工业化应用的关键。因此该工作中,我们通过引入双功能有机基团对介孔材料的硅羟基表面进行化学修饰,调节载体表面与酶分子之间的电负性及亲疏水作用力,目的在于提高酶在载体表面的负载量,从而增强固定化酶的稳定性。同时通过功能化基团的引进,改进介孔材料表面带来的底物扩散限制及改变酶空间构象,提高酶的活性表达。
1 材料与方法
1.1材料与仪器
猪胰蛋白酶(Porcine trypsin,简称PT)Sigma并在0~4℃下保存,酶蛋白质含量为3.8%,最佳活性为300 U/mg酶蛋白(40℃,pH7.0);固定化酶载体SBA-15(8 nm,SBET633 m2/g)上海卓悦化工有限公司;三甲氧基硅烷(3-氨基丙基),三甲氧基硅烷(3-巯基丙基),三甲氧基硅烷(3-氯丙基)阿拉丁试剂公司,为分析纯试剂;甲苯,钨酸钠,钼酸钠,磷酸,浓盐酸,硫酸锂,液体溴,无水碳酸钠,三氯乙酸,干酪素,酪氨酸,牛血清蛋白国药集团试剂,未做进一步处理。
R1850型离心机湘仪离心机有限公司;DSHZ-300A水浴振荡器杭州艾普仪器设备有限公司。
1.2功能化介孔材料的合成
在装有60 mL甲苯的三颈瓶中倒入称量好的2 g SBA-15载体,然后逐滴加入三甲氧基硅烷(20 mmol),在氮气保护下,于110℃反应26 h后过滤,用乙醚洗涤,经过24 h二氯甲烷索氏提取后,烘干,得到功能化的固定化载体,记为NH2-SBA,SH-SBA,Cl-SBA。在装有30 mL甲苯的三颈瓶中倒入称量好的1 g SBA-15载体,逐滴加入(3-丙基)三甲氧基硅烷,(3-甲基)三甲氧基硅烷,(3-辛基)三甲氧基硅烷或者十六烷基甲氧基硅烷(10 mmol),经过反应得到双功能化的固定化载体,记为NH2/C1-SBA,NH2/C3-SBA,NH2/C8-SBA,NH2/C16-SBA[16]。

图1 载体表面修饰反应过程Fig.1 The process of carrier surface modification注:R1为-Cl,-NH2,-SH;R2为-H,-CH2CH3,-(CH2)6CH3,-(CH2)14CH3。
1.3猪胰蛋白酶的固定化过程
将0.05 g猪胰蛋白酶完全溶解于5 mL磷酸缓冲液(pH7.0)中,再加入0.2 g载体,密封并放置于水浴摇床中,在30℃及150 r/min下振荡0.5,1,1.5,2,2.5,3,3.5,4 h之后,将混合物于8000 r/min离心5 min,用缓冲液洗涤并再次离心,上清液用于测定酶蛋白负载量,沉淀通过4 h冷冻干燥后得到固定化酶。
1.4固定化猪胰蛋白酶活性测试
在10 mL试管中加入固定化酶0.03 g,然后置于40℃水浴中,加入同样温度预热的水溶液1 mL及1 mL 2%酪蛋白溶液,经过10 min反应后加入0.4 mol/L三氯乙酸2 mL以停止反应,8000 r/min离心。然后另取10 mL试管,加入1 mL滤液,1 mL福林试剂及5 mL的0.4 mol/L碳酸钠溶液,水浴40℃保温20 min后用紫外分光计测定光密度(波长660 nm)[17-18]。
1.5固定化酶稳定性测试
1.5.1重复使用稳定性将上述1.4过程中,酶活测定后离心所得固定化蛋白酶进行冷冻干燥后,再次进行活性测定(方法见1.4),重复使用固定化酶活测定5次。
1.5.2重复使用过程中蛋白溢出量在10 mL试管内加入1.4过程中离心后的上清液1 mL(见1.4),再加4 mL考马斯亮蓝工作液,在595 nm测定上清溶液中蛋白质含量。对1.5.1过程中,固定化酶五次重复使用后离心所得上清液进行测定,得到五次重复使用过程中酶的总溢出量。
1.5.3储存稳定性将冰箱0~4℃储存天数为1,2,3,4,5 d的固定化酶进行酶活力测定。活力测定过程参考1.4酶活测试方法。
1.6固定化酶的动力学研究
在10 mL试管中加入0.03 g固定化酶,然后置于40℃水浴中,加入预热的水溶液1 mL及1 mL 2%(3%,4%,5%,6%,0.5%,1%)酪蛋白溶液,经过3 min反应后加入0.4 mol/L三氯乙酸2 mL以停止反应,8000 r/min离心。在10 mL试管加入1 mL上清液,1 mL福林试剂及5 mL的0.4 mol/L碳酸钠溶液,水浴40℃保温20 min后进行光密度测定(波长660 nm)。
2 结果与讨论
通过分析图2中不同时间猪胰蛋白酶的固定化效率,可以发现经过2 h物理吸附后,各种不同类型载体对酶的吸附达到平衡,其中卤素官能化的载体Cl-SBA固定化效率最高,氨基官能化的载体固定化酶效率次之,但都明显高于未经修饰原粉对酶的固定化。固定化酶PT-SBA,PT-NH2-SBA,PT-SH-SBA,PT-Cl-SBA在吸附4 h后的固定化效率分别为82%,88%,83%,92%。经过分析认为表面引进基团使得载体对酶的电负性,氢键等相互作用力加大,从而提高了酶的固定化效率[19]。

表1 酶活和胰酶蛋白负载量测试结果
注:a固定化条件:时间,4 h;温度,30℃;pH7.0磷酸缓冲液。b反应条件:温度40℃和pH7.0。游离酶活性:300 U/mg胰蛋白,游离酶相对活性定义为100%,表2同。

表2 酶活和酶蛋白负载量测试结果
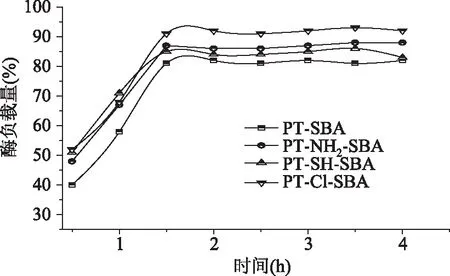
图2 不同官能团修饰介孔材料固定化酶效率测试Fig.2 Enzyme loading of various carriers after modification
从表1固定化酶活结果显示,氨基官能化载体固定化酶以及卤素官能化载体固定化酶表现出了比原粉固定化酶高的蛋白水解活力。而巯基官能化载体固定化酶则表现出较低的活力。经过与固定化效率联合计算,可以得出单位猪胰蛋白酶在载体表面的催化活力。结果表明单位猪胰蛋白酶在氨基官能化的表面催化活力最大,尽管卤素官能化载体表现出了很优秀的固定化效率,但是单位猪胰蛋白酶在载体表面催化活力较在氨基官能化载体表面要低。因此,氨基官能化载体表面为猪胰蛋白酶提供了更好的催化微环境。通过元素分析仪,可以得到修饰基团的具体数量分别为1.8,2.3,1.9 mmol/g载体。
进一步通过改变载体表面亲疏水性质,来调控氨基官能化载体与猪胰蛋白酶之间的相互作用力,最终提高固定化酶的稳定性。通过引入甲基,丙基,辛基以及十六烷基到载体表面(结果见图3),发现随着载体表面疏水性的增高,猪胰蛋白酶固定化效率逐渐上升,经过固定化4 h后,PT-NH2/C1-SBA,PT-NH2/C3-SBA,PT-NH2/C8-SBA,PT-NH2/C16-SBA固定化效率分别为83%,89%,93%,94%。结果表明,十六烷基官能化的载体很难均匀分散在固定化介质中,表现出了较强的疏水性能。
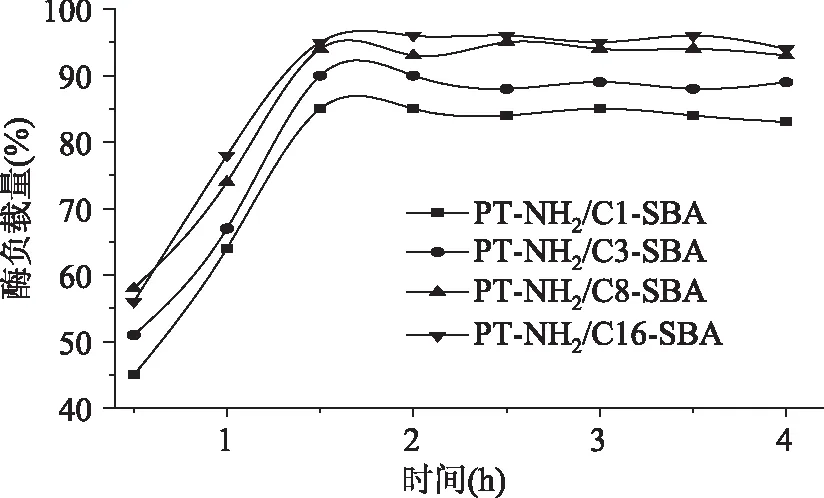
图3 不同亲疏水基团修饰介孔材料固定化酶效率测试Fig.3 Enzyme loading assay after further surface modification
通过在表2中显示的酶活测试及酶蛋白负载量结果表明,烷基在载体表面的进一步修饰有助于表观酶活的进一步提高。随着疏水性的增加,尽管酶蛋白负载量有所提升,但是猪胰蛋白酶的活力逐渐降低。从实验结果可以推断材料表面疏水性的适度增加有助于酶蛋白吸附在载体材料表面,但十六烷基修饰载体固定化酶疏水性能太强,虽然提高了酶蛋白的固定化效率,但是降低了酶活性。而辛基修饰载体固定化酶则最大限度的提高了固定化效率,同时保留了较强的催化性能。通过烷烃的进一步修饰,在保持酶活力不变的情况下,提高了猪胰蛋白酶与载体之间的作用了,有助于猪胰蛋白酶的稳定性。
对不同疏水性能的载体固定化酶以及原粉固定化酶进行了重复稳定性测试。图4显示,原粉固定化酶重复稳定性最差,初次使用后活性降低为最初活性的51%。而随着疏水性的增加,固定化酶稳定性明显增加,初次使用后酶活降为67%,77%,85%,88%。实验结果表明疏水性适度增加能大幅度提高固定化酶的重复使用稳定性。

图4 固定化酶的重复使用稳定性测试Fig.4 Reuse stability assay of immobilized enzyme
从蛋白溢出曲线(图5),发现固定化猪胰蛋白酶重复使用后,猪胰蛋白酶酶活降低主要归因于酶在载体材料表面的溢出,经过五次重复使用后,固定化酶PT-SBA,PT-NH2/C1-SBA,PT-NH2/C3-SBA,PT-NH2/C8-SBA和PT-NH2/C16-SBA酶蛋白溢出量为42%,27%,23%,13%和12%,因此可以确定酶蛋白溢出对固定化酶重复使用性有较大的影响。
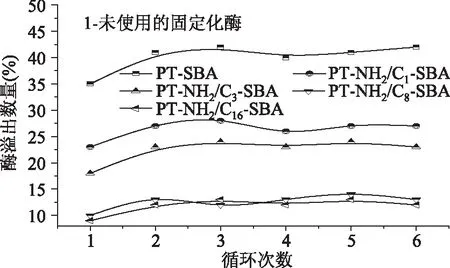
图5 固定化酶在重复使用过程中酶蛋白溢出量测试Fig.5 Enzyme protein leaching assay in immobilized process
固定化酶的储存稳定性能在工业应用中是比较重要的因素,我们对常温下储存的固定化酶的稳定性进行了测试,如图6所示,测试结果表明经过双功能化的固定化酶储存稳定性有所提高。在室温条件下,储存5d后,固定化酶PT-SBA,PT-NH2/C1-SBA,PT-NH2/C3-SBA,PT-NH2/C8-SBA和PT-NH2/C16-SBA酶活降低为初始酶活的67%,72%,77%,81%和83%,因此PT-NH2/C8-SBA具有更好的活性和稳定性。
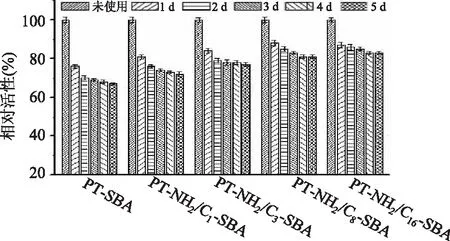
图6 固定化酶的储存稳定性测试Fig.6 Store stability assay of immobilized enzyme
选取不同底物浓度在最优化条件下测定游离酶和固定化酶的催化活力。根据米氏方程双倒数法讨论固定化酶在载体修饰前后的动力学参数Km及Vmax的变化,结果见图7。

图7 固定化酶的动力学测试Fig.7 Kinetic studies results of immobilized enzyme

样品Km(mg/mL)Vamax(umol/min·mg)胰蛋白Vmax/KbmPT-SBA24.041216.3PT-NH2/C8-SBA17.963735.2
注:aKm、Vmax从[S]-V拟合曲线计算得到;b催化效率定义为Vmax/Km比值。
结果如表3及图7所示,发现固定化酶PT-NH2/C8-SBA展现出了较低的米氏常数值17.9 mg/mL,米氏常数值的大小反映了底物分子与酶分子之间的亲和力大小,低的米氏常数表明底物与酶具有很好的亲和力,反应可以快速进行。PT-SBA和PT-NH2/C8-SBA的Vmax分别为412、637 μmol/mg·min,通过比较Vmax可以得出,当引入双官能团修饰介孔材料SBA-15,固定化酶的催化活性得到提高,表明有机官能团物质的引入有助于酶活中心的打开,促使酶活提升。
3 结论
本文通过不同官能团(-SH,-Cl,-NH2)以及不同碳链长度的烷基链(-C1,-C3,-C8及-C16)对载体SBA-15进行双功能化修饰,研究了不同基团修饰载体固定化酶的效率,对固定化酶的比活力、重复使用稳定性以及储存稳定性等酶学性质进行了考察。同时结合上述结果对修饰前后载体固定化酶进行了动力学测试,发现合适的官能团修饰介孔材料能为猪胰蛋白酶提供良好的微环境,促进了酶活的高效表达。随着材料表面疏水性的增加,酶的固定化效率以及稳定性增加,但酶活相应有所降低,可能是亲水性表面有助于打开酶的活性中心,而疏水性的表面则有助于增强猪胰蛋白酶与载体之间的作用力。
[1]Tavano O.Protein hydrolysis using proteases:An important tool for food biotechnology[J].J Mol Catal B-Enzym,2013,90:1-11.
[2]de Souza P,Bittencourt M,Caprara C,et al.A biotechnology perspective of fungal proteases[J].Braz J Microbiol,2015,46(2):337-346.
[3]李晓静,侯俊财,江连洲,等.海藻酸钠-壳聚糖固定化胃蛋白酶的研究[J].食品工业科技,2014,35:168-173.
[4]韩志萍,黄茂芳,张文华,等.介孔二氧化硅制备固定化菠萝蛋白酶的研究[J].食品工业科技,2013,34(13):166-169.
[5]Guerrero C,Vera C,Araya E,et al.Repeated-batch operation for the synthesis of lactulose withβ-galactosidase immobilized by aggregation and crosslinking[J].Bioresource Technol,2015,190:122-131.
[6]Lim C,Goh S,Kariapper L,et al.Inclusion bodies of recombinant Epstein-Barr virus capsid antigen p18 as potential immobilized antigens in enzyme immunoassays for detection of nasopharyngeal carcinoma[J].Clin Chim Acta,2015,448:206-210.
[7]Jia R,Hu Y,Huang H.Improving the catalytic performance of porcine pancreatic lipase in the presence of[MMIm][MeSO4]with the modification of functional ionic liquids[J].Process Biochem,2014,49(4):668-672.
[8]Zou B,Hu Y,Cui F,et al.Enhancing stabilities of lipase by enzyme aggregate coating immobilized onto ionic liquid modified mesoporous materials[J].Appl Surf Sci,2014,311:62-67.
[9]Eslamipour F,Hejazi P.Effects of surface modification and activation of magnetic nanoparticles on the formation of amylase immobilization bonds under different ionic strength conditions[J].J Mol Catal B-Enzym,2015,119:1-11.
[10]Lopez R,Babanova S,Artyushkova K,et al.Surface modifications for enhanced enzyme immobilization and improved electron transfer of PQQ-dependent glucose dehydrogenase anodes[J].Bioelectrochemistry,2015.105:p.78-87.
[11]Raita M,Arnthong J,Champreda V,et al.Modification of magnetic nanoparticle lipase designs for biodiesel production from palm oil[J].Fuel Process Technol,2015,134:189-197.
[12]Singh P,Morris H,Tivanski A,et al.Determination of concentration and activity of immobilized enzymes[J].Anal Biochem,2015,484:169-172.
[13]Todea A,Hiseni A,Otten L,et al.Increase of stability of oleate hydratase by appropriate immobilization technique and conditions[J].J Mol Catal B-Enzym,2015,119:40-47.
[14]Tavares A,Silva C,Drazic G,et al.Laccase immobilization over multi-walled carbon nanotubes:Kinetic,thermodynamic and stability studies[J].J Colloid Interf Sci,2015,454:52-60.
[15]Lee D,Ponvel K,Kim M,et al.Immobilization of lipase on hydrophobic nano-sized magnetite particles[J].J Mol Catal B-Enzym,2009,57(1-4):62-66.
[16]Zou B,Song C,Xu X,et al.Effect of surface modification of low cost mesoporous SiO2carriers on the properties of immobilized lipase[J].J Colloid Interf Sci,2014,417:210-216.
[17]Benkhelifa H,Bengoa C,Larre C,et al.Casein hydrolysis by immobilized enzymes in a torus reactor[J].Process Biochem,2005.40(1):461-467.
[18]Toldrá F,Molina L,Vinuesa S,et al.Peptide generation from casein hydrolysis by immobilised porcine cathepsins[J].Food Chem,2005,92(2):227-233.
[19]Tao Y,Cui C,Shen H,et al.Enhancing trimethylolpropane esters synthesis through lipase immobilized on surface hydrophobic modified support and appropriate substrate feeding methods[J].Enzyme Microb Tech,2014,58:60-67.
Effect of bifunctional mesoporous material on Porcine trypsin catalytic properties
ZOU Bin,DENG Tian,WEI Shi-yu,XIA Jiao-jiao,HUO Shu-hao
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China)
In this paper,binding force between mesoporous materials and trypsin was improved by introducing different modifiers functional groups on the surface of SBA-15(-SH,-Cl,-NH2,-C1,-C3,-C8and-C16)in order to increase the efficiency of enzyme loading,activity and stability.Activity of PT-NH2/C8-SBA could be found up to 255 U/mg trypsin,the activity of PT-SBA was just 195 U/mg trypsin.After the fifth recycle and storage at room temprature of 5 d,PT-NH2/C8-SBA was still able to maintain 85% and 81% of initial activity,while the PT-SBA retained only 51% and 67% of the initial activity.Kinetic studies showed that immobilized enzyme PT-NH2/C8-SBA has better affinity with substrate.
mesoporous;bifunctional;protease;surface modification;immobilization
2015-09-02
邹彬(1986-),男,博士,讲师,研究方向:食品生物技术,E-mail:binzou2009@ujs.edu.cn。
国家自然科学基金青年项目(21406093);江苏省自然科学基金青年项目(BK20140529);国家博士后一等资助(2014M550271);江苏省高校自然科学研究面上项目(14KJB530001);南京工业大学国家重点实验室开放课题(KL13-10)。
TS201.3
A
1002-0306(2016)07-0116-05
10.13386/j.issn1002-0306.2016.07.015

