鲜切苹果腐败霉菌的分离鉴定及致腐力的研究
刘程惠,马 涛,胡文忠,宋金宇,白露露
(1.沈阳农业大学食品学院,辽宁沈阳 110161;2.大连民族大学生命科学学院,辽宁大连 116600;3.渤海大学食品科学与工程学院,辽宁锦州 121013)
鲜切苹果腐败霉菌的分离鉴定及致腐力的研究
刘程惠1,2,马涛1,3,*,胡文忠1,2,宋金宇1,2,白露露1,2
(1.沈阳农业大学食品学院,辽宁沈阳 110161;2.大连民族大学生命科学学院,辽宁大连 116600;3.渤海大学食品科学与工程学院,辽宁锦州 121013)
对引起鲜切苹果腐败的霉菌进行分离鉴定并通过活体实验比较致腐能力。从鲜切苹果中分离13株霉菌,通过形态学鉴定方法分为5个属,其中青霉菌属(Penicillium)7株,曲霉属(Aspergillus)1株,枝孢属(Cladosporium)3株,枝顶孢属(Acremonium)1株,链格孢属(Alternaria)1株。根据青霉菌在CA、CYA、G25N培养基上的特征及镜检观察,将所分离的青霉菌鉴定为5种:皮落青霉(P.crustosum),扩展青霉(P.expansum),米舒青霉(P.miczynskii),橘灰青霉(P.aurantiogriseum),鲜绿青霉(P.viridicatum)。活体实验进行腐败与非腐败霉菌的分类,得到腐败霉菌有5种,分别为鲜绿青霉、扩展青霉、皮落青霉、互隔交链格孢霉(A.alternata)、黑曲霉(A.niger);非腐败霉菌有5种,分别为橘灰青霉、地生枝顶孢(A.terricola)、球孢枝孢(C.sphaerospermum)、枝状枝孢(C.cladosporioides)和米舒青霉。5种腐败霉菌的致腐能力从大到小依次为:皮落青霉、扩展青霉、鲜绿青霉、互隔交链格孢霉、黑曲霉。
鲜切苹果,霉菌,青霉,鉴定,腐败能力
鲜切苹果是一种方便快捷的即食果蔬制品,它既要保持完整苹果的新鲜质地和营养价值,又要保证产品卫生和安全。鲜切苹果的原料在采收、运输、贮藏过程中,受到机械损伤后,腐败霉菌很容易通过伤口侵蚀果实,另外,水果的果蒂及果梗附着的腐败霉菌很难在清洗过程中完全除去,原料切割后这些没有除去的腐败霉菌大量繁殖,最终导致产品腐烂变质。苹果的常见微生物侵染型病害有霉心病、轮纹病、青霉病等[1-3]。引起这些病害的主要微生物为青霉(Penicillium sp.)、链格孢菌(Alternaria sp.)、曲霉(Aspergillus sp.)等,它们都是从碰、压、磕、刺伤或病虫害的部位侵入果实,引起苹果发病[4-5]。鲜切苹果在加工过程中不可避免地造成原有组织与细胞结构破坏,容易招致微生物入侵,同时营养物质随着细胞液外流,又为微生物的繁殖提供营养。霉菌侵入鲜切苹果组织后,组织壁的纤维素先被破坏,进而果胶、蛋白质、有机酸、糖类被分解,继而酵母菌和细菌开始繁殖。由于微生物繁殖,产品外观出现深色斑点,组织变软,逐渐变成浆液状甚至水液状,并产生腐败的味道和气味,导致产品质量下降和货架期缩短。现在已有一些关于鲜切苹果的研究,主要是关于生理生化变化[6-7]、抑制酶促褐变[8-9]和防腐保鲜[10-11],但对导致鲜切苹果腐败的霉菌的研究较少。韩巍巍等人建立了鲜切苹果的霉菌在不同贮藏温度的生长模型[12]。吴晓彬等[13]人从鲜切苹果中初步分离鉴定出4种青霉。目前还缺少关于何种腐败霉菌会引起鲜切苹果腐烂变质,以及它们致腐能力的研究。一般情况下致病菌在鲜切果蔬上很少存在,存在的大都是腐败菌,腐败菌引起的产品腐败变质会造成巨大的经济损失,也是严重制约鲜切产业发展的主要因素。本研究对鲜切苹果中的腐败霉菌进行分离鉴定,并研究了它们的致腐能力,为进一步加强和完善鲜切水果致腐微生物学理论,提高鲜切产品的品质,为广大的消费者提供营养、安全的鲜切水果产品提供参考。
1 材料与方法
1.1材料与仪器
鲜切富士苹果大连当地超市,苹果为大连当地果园采摘。马铃薯葡萄糖琼脂培养基(PDA)、CA培养基、CYA培养基和G25N培养基的配方及配制方法参照《中国真菌志》[14]。
DNP-9082型电热恒温培养箱上海精宏实验设备有限公司;VS-1300超净工作台苏州市苏信净化设备厂;OLYMPUS BX51偏光显微镜日本Olympus公司。
1.2实验方法
1.2.1鲜切苹果中霉菌的分离纯化倒混菌平板法:制备鲜切苹果菌悬液,进行10倍梯度稀释,倍数为10-1、10-2、10-3、10-4、10-5,分别取稀释液1 mL,与已融化并冷却至50℃左右的无菌PDA(含抗生素)混合,摇匀后,倒入培养皿中,待琼脂凝固后,制成实验所需的平板。每个稀释倍数做三个平行样,在28℃下培养3~5 d。平板划线法:倒混菌平板法培养3~5 d后,用接种环挑取外观为丝状的单菌落,在无菌PDA平板上进行交叉划线分离得到纯菌种。用接种环挑取外观是丝状的单菌落,三点法接种到CA上进行纯化培养,重复接种三代。将纯化菌种于4℃保存。
1.2.2霉菌的鉴定水浸片的制作:纯化好的霉菌接种于PDA培养基中间一点,28℃培养3~5 d,挑取单菌落边缘部分于载玻片上的无菌水中,盖盖玻片后显微镜下观察,结合菌落形态特征,依据文献[14-20]进行鉴定。将分离到的青霉菌三点接种到CA、CYA、G25N培养基上,25~28℃培养,CA培养基上培养观察12 d,CYA、G25N培养基上培养观察7 d。分别记录不同菌株在不同培养基上的菌落大小、颜色、质地及生长速度等特征,在显微镜(40倍)中观察它的产孢结构、主要形态、分生孢子的位置、形状等特征。依据文献[14,19-20]进行鉴定。
1.2.3腐败霉菌苹果刺伤接种实验(In vivo)霉菌孢子悬浮液制备:将纯化后的霉菌接种到PDA培养基上,28℃培养5~7 d,挑取菌落孢子于含0.05%吐温80和0.2%琼脂的无菌水中,血球计数板计数,孢子悬浮液的浓度配制为1×105CFU/mL。
苹果→清洗→消毒(200 ppm次氯酸钠浸泡10 min)→70%酒精喷涂苹果表皮→晾干→苹果腰部刺3 mm(直径)×4 mm(深)的伤口→注入霉菌孢子悬浮液20 μL→保鲜盒包装→28℃培养5 d→每天测量病斑直径
每个苹果腰部对称刺4个伤口,3个伤口均被注入20 μL同种霉菌孢子悬浮液,另1个为空白(注入无菌水20 μL),每种霉菌平行3次实验。测定病斑直径,使苹果的病斑直径变化大于2 mm的霉菌为腐败霉菌,反之为非腐败霉菌,根据病斑直径大小比较腐败霉菌的致腐能力的大小[21]。
1.2.4数据处理所有数据用Excel(2013)软件处理,表示为平均值(n=3)±标准偏差。
2 结果与分析
2.1鲜切苹果霉菌的分离及属的鉴定结果
从苹果中分离纯化出13株霉菌,并编号为M1~M13。对13株霉菌在PDA培养基上的菌落形态和水浸片进行镜检观察,并结合中国真菌志[14-17]与相关鉴定手册[18-20],分为5个属:其中青霉菌属7株,分别为M2、M3、M4、M6、M7、M8、M10;曲霉属1株,为M13;枝孢属3株,分别是M1、M5、M9;枝顶孢属1株,为M11,链格孢属1株,为M12。具体描述见表1。
2.2鲜切苹果霉菌种的鉴定结果
通过观察霉菌在PDA培养基和CA、CYA、G25N三种培养基上的菌落形态,并结合中国真菌志[14-17]与相关鉴定手册[18-20],分别将霉菌鉴定到种。
2.2.1鲜切苹果青霉种的鉴定结果
2.2.1.1M2和M3的鉴定结果M2和M3的菌落特征及分生孢子形态见图1。由图1可见:菌落在PDA培养基上28℃培养7 d,菌落表面为暗绿色,背面无色,质地绒状,中心突起;菌丝体为白色,相对直径较大;分生孢子梗粗糙,帚状枝主要三轮生,偶有四轮生;分生孢子为近球形。CA培养基上25℃培养12 d,直径40~50 mm,中心有脐状突起而其他部分有放射状皱纹或近于平坦;质地绒状,在菌落边缘或全部菌落面上兼有粉末状、颗粒状;分生孢子结构大量产生,分生孢子面蓝绿色至黄绿色,菌丝体为白色,反面为黄褐色,或中心红褐色向边缘逐渐变淡而呈现黄褐色。CYA培养基上25℃培养7 d,直径32~43 mm,有放射状皱纹或平坦;质地绒状兼粉末状或颗粒状;分生孢子结构大量产生,分生孢子面蓝绿色或带黄蓝绿色,菌丝体为白色,反面为橘褐色或带红褐色。G25N培养基上25℃培养7 d,直径16~20 mm,较厚,有放射状皱纹或近于平坦;质地绒状兼颗粒状;分生孢子结构较少或较多,呈蓝绿色或黄绿色,菌落背面呈淡黄褐色或浅黄色。综上鉴定M2和M3为皮落青霉(Psenicillium crustosum)。

表1 霉菌菌落及分生孢子结构特征
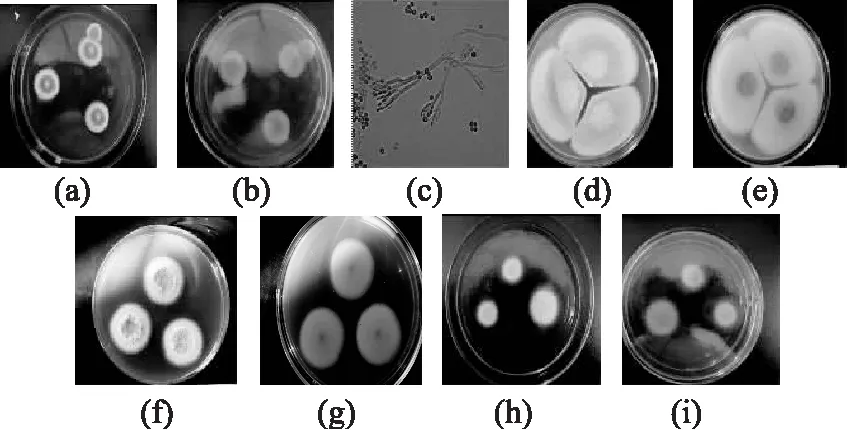
图1 M2和M3的菌落特征及分生孢子形态Fig.1 Colony characteristic and conidium morphology of M2 and M3注:(a)、(b)分别为PDA培养基上菌落正反面特征图,(c)分生孢子形态(×40),(d)、(e)、(f)、(g)、(h)、(i) 分别为CA、CYA、G25N培养基上的菌落正反面特征图,图2~图5同。
2.2.1.2M4和M7的鉴定结果M4和M7的菌落特征及分生孢子形态见图2。由图2可知:菌落在PDA培养基上28℃培养7 d,菌落颜色为暗绿色,质地丝绒状,菌丝体白色;显微镜下,帚状枝结构主要非单轮生,偶有三轮生,瓶梗为披针形。CA培养基上25℃培养12 d,直径38~52 mm,有少量的放射状皱纹,菌落近于平坦或有多道同心环纹;质地绒状,在菌落边缘或全部菌落面上兼有粉末状、颗粒状;分生孢子结构大量产生,蓝绿色或微黄蓝绿色,菌丝体为白色,渗出液少量,反面为淡黄色或紫褐色。CYA培养基上25℃培养7 d,直径30~48 mm,有放射状皱纹,中心往往有点凹凸不平或近于平坦;质地绒状或在中心面轻微的絮状,在菌落边缘面上通常呈现较明显的粉末状或颗粒状;分生孢子结构大量产生,菌丝体为白色,有渗出液。菌落反面为黄褐色。G25N培养基上25℃培养7 d,直径12~25 mm,中心较厚,凹凸不平或有放射状皱纹;质地呈绒状或兼有轻微的絮状、有颗粒状;分生孢子结构较多,呈黄绿色,菌落背面呈淡褐色或黄褐色。综上鉴定M4和M7为扩展青霉(Penicillium expansum)。
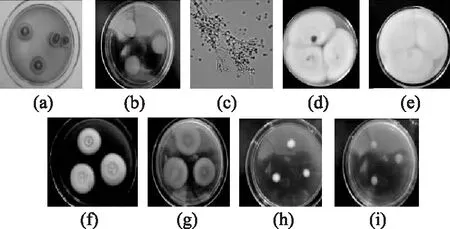
图2 M4和M7的菌落特征及分生孢子形态Fig.2 Colony characteristic and conidium morphology of M4 and M7
2.2.1.3M6的鉴定结果M6的菌落特征及分生孢子形态见图3。由图3可见:菌落在PDA培养基上28℃培养7 d,菌落颜色为暗绿色,中心有突起,质地粉末,菌丝体白色;分生孢子形状为椭圆形。CA培养基上25℃培养12 d,直径22~32 mm,有少量的放射状短纹或在中部有一些近颗粒状菌丝团;质地绒状兼絮状或中部絮状而边缘绒状;分生孢子结构较少,而中部或局部面上较多到大量,分生孢子面呈灰绿色或蓝绿色,菌丝体为黄白色至黄色,反面为黄色或橘黄色。CYA培养基上25℃培养7 d,直径20~32 mm,放射状皱纹较多或较少,有的还有几道同心环;质地绒状兼絮状;分生孢子结构较少,分生孢子面灰绿色或蓝绿色,菌丝体为黄色或灰黄色,菌落反面为淡黄色、橘黄色或微红黄色。G25N培养基上25℃培养7 d,直径6~19 mm,中心隆起而向边缘逐渐降低或有不规则的皱纹;质地绒状或兼絮状;分生孢子结构面蓝绿色,反面淡黄色或橘黄色。综上鉴定M6为米舒青霉(Penicillium miczynskii)。

图3 M6的菌落特征及分生孢子形态Fig.3 Colony characteristic and conidium morphology of M6
2.2.1.4M8的鉴定结果M8的菌落特征及分生孢子形态见图4。由图4可见:菌落在PDA培养基上28℃培养7 d,菌落颜色为暗绿色,质地绒状或粉末状,菌丝体为白色;帚状枝结构主要三轮生,偶有双轮生,瓶梗呈现瓶状;分生孢子为椭圆。CA培养基上28℃培养12 d,直径42~55 mm,有少量的放射状皱纹,同心环纹少或较多,也有近于平坦者;质地粉末状兼绒状或颗粒状;分生孢子结构大量产生,分生孢子面呈典型的蓝绿色,菌丝体为白色。反面为黄褐色。CYA培养基上28℃培养7 d,直径28~42 mm,中心有脐状突起,放射状皱纹少或较多;质地为粉末状或绒状。虽有肉眼可见的幼龄孢梗束,而在中心面上有时带轻微的絮状;分生孢子结构大量产生,灰绿色或蓝绿色,菌丝体为白色,菌落反面为黄褐色。G25N培养基上28℃培养7 d,直径13~18 mm,菌落的中心较厚或有脐状突起而其他有少量放射状短纹;质地绒状兼颗粒状;分生孢子结构较多,呈黄绿色或蓝绿色,菌落背面呈黄色。综上鉴定M8为橘灰青霉(Penicillium aurantiogriseum)。
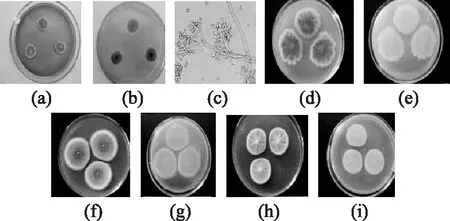
图4 M8的菌落特征及分生孢子形态Fig.4 Colony characteristic and conidium morphology of M8
2.2.1.5M10的鉴定结果M10的菌落特征及分生孢子形态见图5。由图5可见:菌落在PDA培养基上28℃培养7 d,菌落表面为墨绿色,中心脐状突起,质地粉末状兼绒状;菌丝体为白色,背面无色;分生孢子梗粗糙;帚状枝为三轮生,少有双轮生或四轮生;分生孢子呈球形。CA培养基上28℃培养12 d,直径27~35 mm,有少量放射状褶皱或有几道同心环纹;质地绒状兼颗粒状;分生孢子结构在菌落边缘或进边缘大量产生,分生孢子面黄绿色,菌丝体为白色,中部略呈微黄白色,菌落背面为黄色或黄红褐色。CYA培养基上28℃培养7 d,直径28~33 mm,菌落中间有脐状突起其他部分接近平坦;质地绒状兼颗粒状;分生孢子结构大量产生,分生孢子面带黄绿色,菌丝体接近于白色,菌落背面为黄褐色。G25N培养基上28℃培养7 d,直径17~20 mm,菌落表面较为平坦或有少量不明显皱纹;质地为绒状兼较轻的粉末状;分生孢子结构不多,呈黄绿色和蓝绿色,没有渗出液产生,菌落背面为黄色。综上鉴定M10为鲜绿青霉(Penicillium viridicatum)。
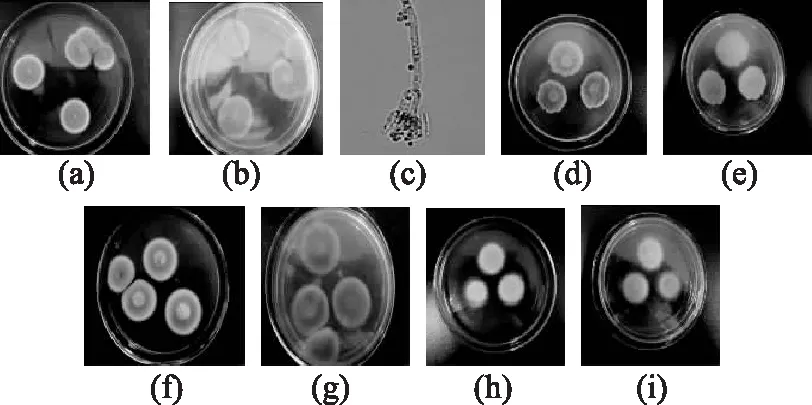
图5 M10的菌落特征及分生孢子形态Fig.5 Colony characteristic and conidium morphology of M10
2.2.2鲜切苹果其它霉菌种的鉴定结果
2.2.2.1M1的鉴定结果M1的菌落特征及分生孢子形态见图6。由图6,菌落在PDA培养基上28℃培养7 d,菌落为青褐色,有放射状褶皱;分生孢子链较短,且孢子梗有隔膜。鉴定M1为球孢枝孢(Cladosporium sphaerospermum)。

图6 M1的菌落特征及分生孢子形态Fig.6 Colony characteristic and conidium morphology of M1注:(a)、(b)分别为PDA培养基上菌落正反面特征图,(c)分生孢子形态(×40),图7~图10同。
2.2.2.2M5和M9的鉴定结果M5和M9的菌落特征及分生孢子形态见图7。由图7,枝状枝孢菌落在PDA培养基上28℃培养7 d,菌落为深绿色,呈绒状,背面为墨绿色;孢子梗较粗糙且有隔,分生孢子形状为长椭圆形。鉴定M5和M9为枝状枝孢(Cladosporium cladosporioides)。

图7 枝状枝孢的菌落特征及分生孢子形态Fig.7 Colony characteristic and conidium morphology of M5 and M9
2.2.2.3M11的鉴定结果M11的菌落特征及分生孢子形态见图8。菌落在PDA培养基上28℃培养7 d,菌落为白色,呈绒毛状,中心有脐状突起。显微镜下,菌丝具隔,分生孢子梗不分枝,且中间粗;分生孢子形状为椭圆。鉴定M11为地生枝顶孢(Acremonium terricola)。
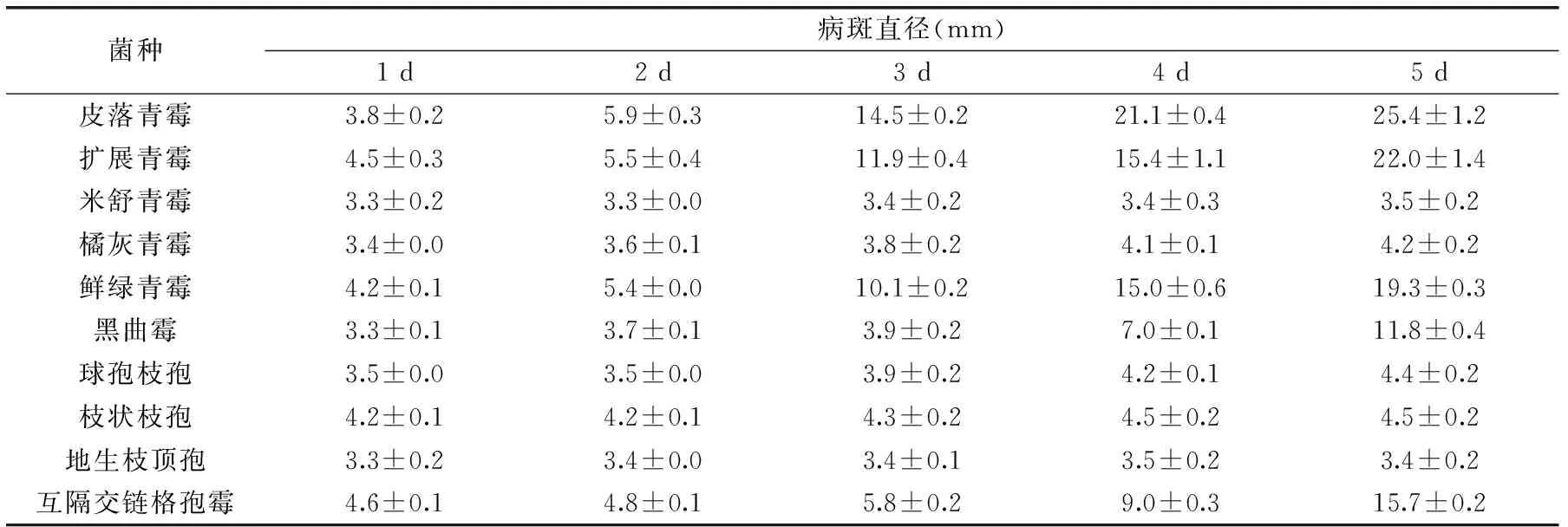
表2 10种霉菌病斑直径的变化

图8 地生枝顶孢的菌落特征及分生孢子形态Fig.8 Colony characteristic and conidium morphology of M11
2.2.2.4M12的鉴定结果M12的菌落特征及分生孢子形态见图9。菌落在PDA培养基上28℃培养7 d,菌落颜色为黑色或暗绿色,呈绒状,或有同心圆环,菌丝呈放射状;孢子梗粗糙且有隔膜;分生孢子呈保龄球状。鉴定M12为互隔交链格孢霉(Alternaria alternata)。

图9 M12的菌落特征及分生孢子形态Fig.9 Colony characteristic and conidium morphology of M12
2.2.2.5M13的鉴定结果M13的菌落特征及分生孢子形态见图10。由图10,菌落在PDA培养基上28℃培养7 d,菌落颜色初为白色,后变成黑色,背面无色,质地粉末状,生长速度较快;分生孢子头为顶囊球形,颜色褐黑色呈放射状,顶端孢子呈链形。鉴定M13为黑曲霉(Aspergillus.niger)。

图10 M13的菌落特征及分生孢子形态Fig.10 Colony characteristic and conidium morphology of M13
2.3鲜切苹果腐败霉菌与非腐败霉菌的分类及致腐能力比较结果
由表2可知,皮落青霉、扩展青霉、鲜绿青霉、黑曲霉、互隔交链格孢霉接种的苹果的病斑直径变化均大于2 mm,可认为它们是腐败霉菌;橘灰青霉、米舒青霉、球孢枝孢、枝状枝孢和地生枝顶孢接种的苹果的病斑直径变化均小于2 mm,可认为它们是非腐败霉菌;在5种腐败霉菌中,皮落青霉在5 d内病斑直径变化最大,即其致腐性最强,之后依次是扩展青霉、鲜绿青霉、互隔交链格孢霉和黑曲霉。
3 结论
从鲜切苹果中分离鉴定得到5个属:青霉菌属、曲霉属、枝孢属、枝顶孢属和链格孢属。进一步鉴定为10个种:皮落青霉、扩展青霉、米舒青霉、橘灰青霉、鲜绿青霉、黑曲霉、球孢枝孢、枝状枝孢、地生枝顶孢、互隔交链格孢霉。活体实验进行腐败与非腐败霉菌的分类,最终得到腐败霉菌有5种,分别为鲜绿青霉、扩展青霉、皮落青霉、互隔交链格孢霉、黑曲霉;非腐败霉菌有5种,橘灰青霉、地生枝顶孢、球孢枝孢、枝状枝孢和米舒青霉。在5种腐败菌中,腐败能力由大到小顺序为:皮落青霉、扩展青霉、鲜绿青霉、互隔交链格孢霉、黑曲霉。
[1]呼丽萍,马春红,杨光明,等.苹果霉心病病原研究[J].果树科学,1996,13(3):157-161.
[2]陈策.苹果果实轮纹病研究进展[J].植物病理学报,1999,29(1):193-198.
[3]李保华,王彩霞,董向丽.我国苹果主要病害研究进展与病害防治中的问题[J].植物保护,2013,5:46-54.
[4]Moshe Reuveni,Dov Prusky.Improved control of moldy-core decay(Alternaria alternata)in Red Delicious apple fruit by mixtures of DMI fungicides and captan[J].European Journal of Plant Pathology,2007,118(4):349-357.
[5]Juan Calvo,Viviana Calvente,María E Orellano,et al.Control of Penicillium Expansum and Botrytis Cinerea on Apple Fruit by Mixtures of Bacteria and Yeast[J].Food Bioprocess Technol,2010,3:644-650.
[6]庞坤,胡文忠,姜爱丽,等.鲜切苹果贮藏期间生理生化变化的影响[J].食品与机械,2008,24(1):50-54.
[7]Roberto Quevedo,Emir Valencia,Patricia López,et al.Characterizing the Variability of Enzymatic Browning in Fresh-Cut Apple Slices[J].Food and Bioprocess Technology,2014,7(5):1526-1532.
[8]M J Galindo-Pérez,D Quintanar-Guerrero,E Mercado-Silva,et al.The Effects of Tocopherol Nanocapsules/Xanthan Gum Coatings on the Preservation of Fresh-Cut Apples:Evaluation of Phenol Metabolism[J].Food and Bioprocess Technology,2015,8(8):1791-1799.
[9]Suriyan Supapvanich,Pattama Prathaan,Racha Tepsorn.Browning inhibition in fresh-cut rose apple fruit cv.Taaptimjaan using konjac glucomannan coating incorporated with pineapple fruit extract[J].Postharvest Biology and Technology,2012,73:46-49.
[10]范林林,冯叙桥.不同保鲜处理对鲜切苹果保鲜效果的影响[J].食品与发酵工业,2015,41(1):252-256.
[11]Haiping Qi,Wenzhong Hu,Aili Jiang,et al.Extending shelf-life of Fresh-cut ‘Fuji’ apples with chitosan-coatings[J].Innovative Food Science and Emerging Technologies,2011,12:62-66.
[12]韩巍巍,刘程惠,胡文忠,等.鲜切苹果微生物生长模型研究及货架期预测[J].食品工业科技,2010,31(12):104-109.
[13]吴晓彬,胡文忠,刘程惠,等.鲜切苹果致腐霉菌的分离鉴定[J].食品工业科技,2010,31(10):78-82.
[14]孔华忠.中国真菌志.第三十五卷(青霉属及其相关有性型属)[M].北京:科学出版社,2007.
[15]孔华忠.中国真菌志.第五卷(曲霉属及其相关有性型属)[M].北京:科学出版社,2007.
[16]孔华忠.中国真菌志.第十四卷(枝孢属、黑星孢属、梨孢属)[M].北京:科学出版社,2007.
[17]孔华忠.中国真菌志.第十六卷(链格孢属)[M].北京:科学出版社,2007.
[18]魏景超.真菌鉴定手册[M].上海:科学技术出版社,1986.
[19]中国科学院微生物研究室.常见与常用真菌[M].北京:科学出版社,1978.
[20]Pitt J I.A laboratory guide common penicillium species[M].North Ryde:Division of Food Processing,1988.
[21]梁泉峰,池振明.间型假丝酵母菌株对多种水果蔬菜腐败霉菌的拮抗效果和拮抗机制的研究[J].食品与发酵工业,2002,28(1):34-38.
Isolation and identification of spoilage molds from fresh-cut apple and their rot abilities
LIU Cheng-hui1,2,MA Tao1,3,*,HU Wen-zhong1,2,SONG Jin-yu1,2,BAI Lu-lu1,2
(1.College of Food Science,Shenyang Agricultural University,Shenyang 110161,China; 2.College of Life Science,Dalian Nationalities University,Dalian 116600,China; 3.College of Food Science and Engineering,Bohai University,Jinzhou 121013,China)
The spoilage molds which caused the corruption of fresh-cut apple were identified,and the rot ability of molds were compared in vivo.13 Strains of molds were isolated from fresh-cut apples,in which there were 7 Penicillium strains,1 Aspergillus strain,3 Cladosporium strains,1 Acremonium strain,and 1 Alternaria strain by morphological character methtods.The different penicillium strains were identified by the cultivation characters and microscopic examination in different medium including CA,CYA,G25N.The results showed that 5 types of Penicillium were identified,which were P.crustosum,P.expansum,P.miczynskii,P.aurantiogriseum and P.viridicatum.The in vivo experiments were used to determine type of molds spoilage or not.Five spoilage molds were identified,which were P.viridicatum,P.expansum,P.crustosum,A.alternata,and A.niger.And five kinds of molds could not rot apple were indentified as P.aurantiogriseum,A.terricola,C.sphaerospermum,C.cladosporioides,and P.miczynskii.The order of rot ability of 5 spolilage molds was P.crustosum,P.expansum,P.viridicatum,A.alternata,A.niger.
fresh-cut apple;spoilage mold;identification;rot ability
2015-10-26
刘程惠(1979-),女,博士研究生,研究方向:食品科学与工程,E-mail:liuchenghui@dlnu.edu.cn。
马涛(1962-),男,博士,教授,研究方向:食品科学,E-mail:matao-09@163.com。
“十二五”国家科技支撑计划项目(2012BAD38B05);中央高校基本科研业务费专项资助项目(DC201502020402)。
TS201.3
A
1002-0306(2016)07-0131-06
10.13386/j.issn1002-0306.2016.07.018

