桑黄菌丝体多糖的提取及其抗氧化活性研究
李月英,杨小明,刘 恋,郭丹钊
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.江苏大学医学院,江苏镇江 212013)
桑黄菌丝体多糖的提取及其抗氧化活性研究
李月英1,2,杨小明1,*,刘恋1,郭丹钊1
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.江苏大学医学院,江苏镇江 212013)
研究了桑黄(Phellinus igniarius)菌丝体多糖热水提取的最佳工艺条件及其体外抗氧化活性。通过单因素实验和正交实验对提取工艺进行优化,考察提取时间、温度和料液比及提取次数对桑黄菌丝体多糖得率的影响。最佳提取工艺条件为温度100℃,时间2 h,料液比1∶15 g/mL,提取2次。在该条件下,桑黄菌丝体多糖得率为6.64%。该粗多糖含量为69.29%,蛋白含量为3.20%。浓度为0.2 mg/mL的桑黄菌丝体多糖对超氧负离子清除率为49.4%,对羟基自由基的清除率为28.7%,还原力为0.072,低于VC相对应的抗氧化能力。
桑黄菌丝体,多糖,提取,抗氧化
桑黄是自然界中十分珍稀的药用真菌,多糖是其中主要药效成分。桑黄多糖具有良好的抗肿瘤、提高肌体免役能力等作用[1-2],动物实验证实桑黄多糖是通过增强机体免疫力而达到抗肿瘤作用[2-3]。
桑黄属于担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、非褶菌目(Polyporaceae)、锈革孔菌科(Hymenochaetaceae)、木层孔菌属(Phellinus);按种分主要有裂蹄针层孔菌Phellinm linteus,火木层孔菌Phellinus igniarius和鲍氏层孔菌Phellinus baumii Pilat[3-4]。P.linteus主要分布于韩国,而P.igniarius和P.baumii主要分布于我国国内。
对于桑黄中多糖研究的最早、最为全面的是P.linteus,从上世纪开始,韩国对其菌种、菌丝体发酵、菌丝体多糖的提取分离、结构,活性及作用机理做了详细的研究[5-7]。而国内对桑黄多糖,尤其是桑黄菌丝体多糖的研究相对起步较晚,且许多有关桑黄菌丝体多糖的文献报道中对桑黄菌菌种的种名及菌种来源交代不清,给桑黄菌丝体多糖的系统研究带来了困难。氧化损伤是许多慢性疾病,如肿瘤、心脏病的诱因,抗氧化活性成份能够避免细胞因自由基作用而被老化、损伤或产生DNA结构改变,从而达到保护机体作用。因此对人体安全的活性氧清除剂研究具有重要意义。本文选择中国微生物菌种保藏管理委员会普通微生物中心的桑黄菌菌株(Phellinus igniarius,编号5.0095)进行发酵获得菌丝体,优化了菌丝体多糖的提取条件,并对该菌丝体多糖的理化性质和抗氧化活性进行研究,为桑黄菌丝体多糖的系统研究和比较提供借鉴。
1 材料与方法
1.1材料与仪器
桑黄菌(Phellinus igniarius,菌株编号5.0095)中国微生物菌种保藏管理委员会普通微生物中心。以PDB培养基液体种子培养,发酵培养基由小麦粉51.6 g/L、麸皮13.8 g/L、桑枝粉10 g/L、KH2PO41 g/L、MgSO4·7H2O 0.5 g/L组成,自然pH。将种子液接至发酵培养液中,接种量为10%,装瓶量100 mL/250 mL;于28℃转速135 r/min摇床中培养5 d,收集菌丝体,清洗、冻干。
氯化硝基四氮唑(NBT)南京生兴生物技术公司;吩嗪甲酯硫酸盐(PMS)、还原型辅酶(NADH)Sigma公司;考马斯亮蓝G-250、牛血清白蛋白、无水乙醇、葡萄糖、浓硫酸、苯酚碘、碘化钾、α-萘酚、酒石酸钠钾均为AR级上海国药集团;水为二次蒸馏水。
H1850R高速冷冻离心机湖南湘仪实验室仪器开发有限公司;ALPHA2-4冷冻干燥机德国CHRIST;Varian Cary 100紫外分光光度计美国VARIAN;NEXUS傅立叶红外分光光度计美国热电尼高力。
1.2实验方法
1.2.1桑黄菌丝体多糖的提取工艺干燥桑黄菌丝体→粉碎→过40目筛→无水乙醇脱脂→热水提取→过滤→80%醇沉12 h→离心→沉淀复溶→透析→冷冻干燥→粗多糖。
1.2.2桑黄多糖得率计算

采用苯酚-硫酸法,以葡萄糖为标准品,测定总糖含量[8];采用考马斯亮蓝法,以牛血清白蛋白为标准品,测定蛋白质含量[8]。
1.2.3桑黄多糖提取单因素实验
1.2.3.1提取时间准确称取桑黄菌丝粉各0.5 g,按料液比1∶20(g/mL)加入蒸馏水,于100℃水浴分别提取0.5、1.0、1.5、2.0、2.5 h,过滤,滤液定容至250 mL,测定总糖含量、计算得率。
1.2.3.2提取温度的选择准确称取五份桑黄菌丝粉各0.5 g,按料液比1∶20(g/mL)加入蒸馏水,分别在60、70、80、90、100℃水浴中提取2.0 h,过滤,提取液定容至250 mL,测定总糖含量、计算得率。
1.2.3.3提取料液比的选择精密称取五份桑黄菌丝粉各0.5 g,于100℃条件下,分别按照1∶5、1∶10、1∶15、1∶20、1∶25(g/mL)的料液比提取2.0 h,过滤,滤液定容至250 mL,测定总糖含量、计算得率。
1.2.3.4提取次数的选择精密称取五份桑黄菌丝粉各0.5 g,按料液比为1∶15(g/mL)加入蒸馏水,于100℃下提取2.0 h、分别提取1、2、3、4、5次,合并滤液浓缩,定容至250 mL,测定总糖含量、计算得率。
1.2.3.5桑黄水提取液总糖得率计算
水提取物总糖得率(%)=总糖含量×稀释体积/样品干质量×100
1.2.4桑黄菌丝体多糖提取的正交实验设计在单因素实验的基础上,采用三因素三水平,按L9(34)正交设计进行桑黄菌丝体多糖热水提取正交实验,以总糖得率作为响应值,各因素水平如表1所示,每组实验均重复3次。

表1 实验因素及水平表
1.2.5桑黄菌丝体多糖基本理化性质分析
1.2.5.1桑黄多糖的化学性质验证观察桑黄菌丝体多糖的外观及在水和有机溶剂中溶解性,与碘-碘化钾反应、(-萘酚反应和斐林试剂反应,参照文献[8]进行。
1.2.5.2紫外光谱检测将浓度为1 mg/mL的桑黄菌丝体多糖溶液稀释一定倍数后,在190~400 nm扫描。
1.2.5.3红外光谱检测5 mg桑黄多糖冻干样品,KBr压片后,在400~4000 cm-1的中红外区扫描。
1.2.6桑黄菌丝体多糖体外抗氧化活性
1.2.6.1清除超氧负离子的测定将桑黄菌丝体多糖用Tris-HCl缓冲液(pH8.0,16 mmol/L)溶解,制成不同浓度的样品溶液。NBT、NADH均用Tris-HCl缓冲液(pH8.0,16 mmol/L)溶解,浓度分别为300、468 μmol/L;PMS用蒸馏水溶解,浓度为60 μmol/L。取1.50 mL不同浓度的样品溶液,0.50 mL NBT,0.5 mL NADH,混匀,然后加入0.5 mL PMS,空白对照是将样品换为1.50 mL的缓冲溶液,操作方法相同,25℃水浴5 min后,在波长560 nm下测定吸光度,每样品平行测定三次。超氧负离子清除率I的计算公式如下[9]:
式中:I为样品对超氧负离子的清除率(Scavenging effect);A1为样品测试值,A0为空白对照值。
1.2.6.2清除羟基自由基的测定将桑黄菌丝体多糖用去离子水溶解,配制成一系列不同浓度的样品溶液用。用无水乙醇溶解邻二氮菲,配制浓度为0.75 mmol/L的邻二氮菲溶液,取1.0 mL邻二氮菲溶液分别加入0.2 mol/L磷酸盐缓冲溶液(PBS,pH7.40)2.0 mL和蒸馏水1.0 mL,于漩涡混合器充分混匀后,加入浓度为0.75 mmol/L硫酸亚铁溶液1.0 mL,混匀,最后加入0.01% H2O21.0 mL,37(C水浴反应60 min后,于波长536 nm处测定吸光度,损伤管测得的吸光度值标记为A1。样品管以1.0 mL样品代替损伤管中1.0 mL蒸馏水,操作方法与上述相同,样品管测得的吸光值标记为A2。未损伤管用1.0 mL蒸馏水代替损伤管中的H2O2,操作方法与上述相同,未损伤管测得吸光值标记为A3。每样品平行测定三次。羟基自由基清除率I的计算公式如下[10-11]:
式中:I为样品对羟基自由基的清除率(Scavenging effect);A1为损伤管测试值,A2为样品管测试值,A3为未损伤管测试值。
1.2.6.3还原能力的测定将桑黄菌丝体多糖用去离子水溶解,制成一系列不同浓度的样品溶液,备用。取1.0 mL样品溶液,加入2.5 mL铁氰化钾(1%)和2.5 mL PBS(0.2 mol/L,pH6.6),混合均匀后于50℃水浴反应20 min。然后再加入2.5 mL三氯乙酸(体积分数为10%)混匀。离心(3000 r/min,10 min),吸取上清液2.5 mL,加入0.5 mL FeCl3(0.1%)混合,于波长700 nm处测定吸光度。以样品溶液的浓度为横坐标,得到的吸光度值为纵坐标绘制曲线[12-13]。
1.3数据统计分析

2 结果与讨论
2.1总糖和蛋白含量测定标准曲线的建立
采用苯酚-硫酸法,在490 nm处测定吸光度值,总糖的标准曲线:Y=0.0064X-0.0028(R2=0.9970),线性范围为10~100 μg。
采用考马斯亮蓝法,在595 nm处测定吸光度值,蛋白的标准曲线:Y=0.0135X+0.0795(R2=0.9978),线性范围为10~60 μg。
苯酚-硫酸法测定的是可溶性糖,包括单糖、低聚糖和水溶性多糖等。桑黄菌丝体中的单糖、双糖、低聚糖等易溶于水,在热水提取初始即溶于水中,而分子量较大的多糖相对难溶。因此,多糖的溶出量是决定水提取液总糖得率关键因素。为了简化测定过程,本文在优化多糖提取工艺时,采用总糖得率为指标,最后将在最优工艺条件下提取的总糖经沉淀,复溶 8000 D透析袋透析,得到多糖,冻干称重,计算多糖得率,测定其中多糖和蛋白含量。
2.2提取时间对桑黄菌丝体总糖得率的影响
提取时间对总糖得率的影响见图1。在0.5~2.0 h时,得率随着提时间的延长而增加;到2.0 h之后,随着时间的继续延长,总糖得率的增加明显平缓。综合考虑能耗和时间因素,选提取时间为2.0 h。

图1 提取时间对桑黄菌丝体水提取物总糖得率的影响Fig.1 Effects of extraction time on yield of polysaccharides from P.igniarius mycelium
2.3提取温度对桑黄菌丝体总糖得率的影响
提取温度对总糖得率的影响如图2所示,随着温度的逐渐升高,多糖的含量逐渐增加。温度升高会导致分子动能增加,从而提高溶剂的溶解能力和渗透能力,增加多糖的溶出。一般来说,温度越高提取效果越好,有相关报道认为一般中药采取沸水浴煎煮[4-5],因此提取温度选为100℃。

图2 提取温度对桑黄菌丝体水提取物总糖得率的影响Fig.2 Effects of extraction temperature on yield of polysaccharides from P.igniarius mycelium
2.4料液比对桑黄菌丝体总糖得率的影响
由图3可见,随着料液比的增加,总糖得率缓慢增加。这是由于在传质过程中,提取剂增加,溶液中糖浓度被稀释,固液两相间糖浓度差增加,从而加快传质速率。但当料液比大于1∶15(g/mL)时,总糖得率的增加已不明显,而过大的料液比会造成溶剂的浪费及能量消耗,且加大后续浓缩的难度。因此选择料液比为1∶15(g/mL)。

图3 料液比对桑黄菌丝体多糖得率的影响Fig.3 Effects of solid-liquid ratio on yield of polysaccharides from P.igniarius mycelium
2.5提取次数对桑黄菌丝体总糖得率的影响
提取次数对总糖得率的影响见图4,总糖的得率随提取次数的增加而增大。初始增加提取次数时,得率明显增加,因为每一次提取都采用新鲜溶剂,菌丝体细胞与新鲜溶剂之间的浓度差,促进多糖的溶出。提取次数增加至2次时,得率为14.4%;3次时,多糖得率达到16.37%;再继续增加提取次数,多糖得率已无明显增加,说明多糖已经基本提取彻底。考虑到每增加一次提取带来的溶剂及能量消耗以及后续浓缩步骤工作量的增加,将提取次数选定为2次。
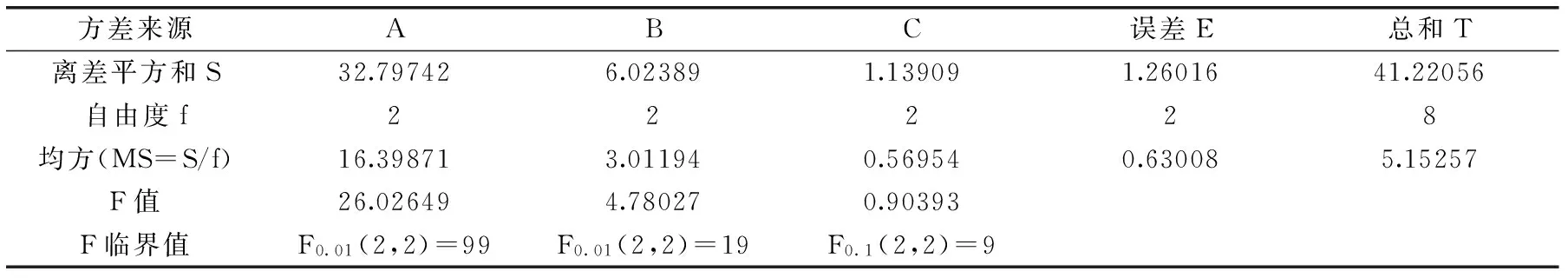
表3 实验结果方差分析表

图4 提取次数对桑黄菌丝体水提取物总糖得率的影响Fig.4 Effects of extract numbers on yield of polysaccharides from P.igniarius mycelium
2.6正交实验
在单因素实验的基础上,选取提取时间、提取温度和料液比3个因素作为考察指标,采用L9(34)正交实验设计,提取次数固定为2次,进行优化桑黄菌丝体多糖的提取工艺条件,正交实验结果见表2,方差分析见表3。
由表2中R值可见,影响总糖得率的因素主次依次是:提取时间(A)>提取温度(B)>料液比(C)。由k值大小可知,优化工艺组合是A3B3C2,由方差分析(表3)同样可以看出提取时间这一因素作用最显著,其次是提取温度,最后是料液比。
按照正交实验得出的最优方案A3B3C2,即提取时间2.5 h,提取温度100℃,料液比1∶15,3次平行实验,总糖得率分别为14.19%、14.23%和14.08%,平均含量为14.17%。
将在最优方案下提取得到的桑黄水提取液,以80%乙醇沉淀,于4℃放置12 h后,离心,沉淀复溶、透析、冷冻干燥,称重,粗多糖得率为6.64%,其中多糖含量69.29%,蛋白含量3.20%。
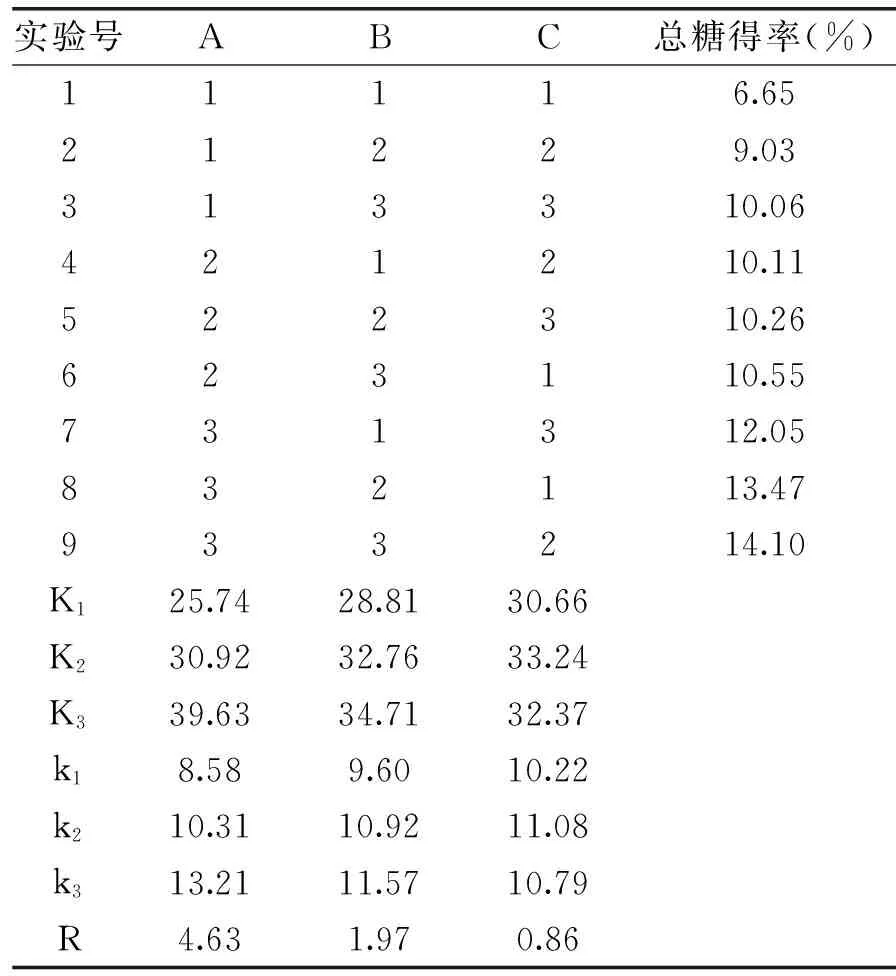
表2 正交实验结果
2.7桑黄多糖化学性质验证
提取的桑黄菌丝体多糖,经过透析、冻干后,表观呈现为白色疏松状粉末,无味,易溶于水,难溶于甲醇、乙醇、乙醚等有机溶剂。碘-碘化钾反应呈阴性,表明桑黄粗多糖中不含淀粉;α-萘酚反应呈阳性,表明所得桑黄粗多糖中含有糖类物质;斐林试剂反应呈现为阴性,表明桑黄粗多糖中不含游离单糖。苯酚-硫酸法测定该桑黄菌丝体多糖中多糖含量为67.89%,蛋白含量为3.59%。
2.7.1紫外光谱检测紫外扫描图谱如图5所示,桑黄菌丝体多糖在196 nm处有明显的吸收峰,表现为糖的特征吸收;扫描260 nm处有吸收峰,表现为核酸的特征吸收,280 nm处有少量的吸收,表明有少量的蛋白。

图5 桑黄菌丝体多糖的紫外光谱Fig.5 UV Spectrum of polysaccharides from P.igniarius mycelium
2.7.2红外光谱检测桑黄菌丝体多糖的红外光谱图如图6所示。

图6 桑黄菌丝体多糖的红外光谱图Fig.6 Infrared spectrogram of polysaccharides from P.igniarius mycelium
图6显示桑黄菌丝体多糖具有一般多糖在红外光谱中的特殊结构:在3385 cm-1左右有较强的O-H和N-H伸缩振动,2930 cm-1处有C-H伸缩振动,这两组吸收峰是糖类物质的特征吸收峰;1880~1550 cm-1之间为C=O的伸缩振动,1650~1500 cm-1之间为N-H的变角振动,1250~950 cm-1之间存在的吸收峰为吡喃环结构的吸收峰,说明该糖链构型为吡喃型。
2.8桑黄菌丝体多糖的体外抗氧化活性
2.8.1清除超氧负离子的活性测定桑黄菌丝体多糖和维生素C(VC)对超氧负离子的清除能力见图7。在0.01~0.2 mg/mL浓度范围内,随着浓度的逐渐增加,多糖清除超氧负离子的能力缓慢增强。当多糖浓度为0.2 mg/mL时,清除率达到最高,为49.49%。而VC浓度为0.1 mg/mL时清除率已经达到92%,与之相比,多糖对超氧负离子的清除率相对较低。

图7 桑黄菌丝体多糖和VC清除超氧负离子的能力Fig.7 Scavenging activity of VC and polysaccharide from of P.igniarius mycelium on superoxide anion radicals
2.8.2清除羟基自由基的活性测定在Fenton体系中H2O2与Fe2+反应产生羟基自由基·OH,·OH将邻二氮菲-Fe2+氧化成为邻二氮菲-Fe3+,致使溶液的颜色发生变化,在536 nm处的吸收消失或减弱,而具有清除·OH能力的物质可与邻二氮菲竞争·OH,使得536 nm处的吸收减弱程度减小,故由该吸光度值的变化可测定羟基自由基的清除率[14]。
桑黄菌丝体多糖和VC对羟基自由基的清除能力见图8。在0.05~0.4 mg/mL浓度范围内,该多糖对羟基自由基的清除率随着浓度的增加而逐渐增大,浓度为0.2 mg/mL时,清除率为28.7%,当浓度为0.4 mg/mL时,清除率达到50%;与VC相比,桑黄菌丝体多糖羟基自由基的清除率较低。这可能是因为VC为小分子的抗氧化剂,本身具有很强的抗氧化活性,不但能直接清除·OH,还能阻断Fenton反应,减少体系中·OH的产生。而对于大分子的多糖来说,·OH必须与多糖碳氢链上的氢原子结合成水才能被清除,因而桑黄的各组分多糖清除·OH的活性较差。

图8 桑黄多糖和VC清除羟基自由基的能力Fig.8 Scavenging hydroxyl radical activity of VC and polysaccharide from P.igniarius mycelium
2.8.3还原能力的测定还原能力是检测潜在抗氧化剂抗氧化活性的重要指标。测定原理如下,当反应体系中存在具有还原性物质时,铁氰化钾被还原成亚铁氰化钾,在酸性条件下亚铁氰化钾与三氯化铁反应,生成在波长为700 nm处有最大吸收峰的物质,测得的吸光度值越大,则表示该还原性物质的还原能力越强[15]。
桑黄菌丝体多糖的还原力测定结果见图9A,VC的还原力测定结果见图9B。由图可知,在0.1~1.0 mg/mL浓度范围内,桑黄菌丝体多糖的还原力与浓度之间具有很好的量效关系,它们都随浓度的增加而逐渐增加。当浓度为1.0 mg/mL时,多糖的还原力为0.095,桑黄菌丝体多糖的还原能力与VC相比均相对较弱,可能是由于多糖是大分子物质,其中包含的还原性末端相对较少。
3 结论
本实验通过单因素实验和正交实验,采用热水提取桑黄菌丝体多糖,实验结果表明,影响桑黄菌丝体多糖提取率的三个因素的先后顺序是:提取时间>提取温度>料液比。综合考虑各因素得到优工艺参数为:提取时间2.5 h,提取温度100℃,料液比1∶15(g/mL),提取2次,在该条件下桑黄菌丝体多糖的平均提取率为6.64%。该桑黄菌丝体多糖为白色疏松粉末,无味,易溶于水,不含淀粉和游离单糖,多糖含量为69.29%,蛋白含量为3.20%。浓度为0.2 mg/mL的桑黄菌丝体多糖对超氧负离子的清除率为49.49%,对羟基自由基的清除率为28.7%,还原
力为0.072,均低于VC相对应的抗氧化能力。

图9 桑黄菌丝体多糖(A)和VC(B)的还原力Fig.9 The reduction power of polysaccharide from P.igniarius mycelium(A)and VC(B)
[1]胡启明.桑黄菌丝体多糖的分离纯化,结构鉴定及生物活性研究[D].武汉,华中农业大学,2013.
[2]车会莲,孟繁岳,杜杰,等.桑黄提取物对肿瘤生长和细胞免疫功能的影响[J].中国公共卫生,2005,1(21):79-81.
[3]Hsieh PW,Wu JB,Wu YC.Chemistry and biology of Phellinus linteus[J].BioMedicine,2013,3(3):106-113.
[4]张林芳,邹莉.桑黄多糖的研究进展[J].中国食用菌,2012,31(4):1-4.
[5]Han S B,Lee CW,Jeon Y J,et al.The inhibitory effect of polysaccharides isolated from Phellinus linteus on tumor growth and metastasis[J].Immunopharmacology,1999,41:157-164.
[6]Kim H M,Han S B,Oh G T,et al.Stimulation of humoral and cell mediated immunity by polysaccharide from mushroom Phellinus linteus[J].International Journal of Immunopharmacology,1996,18:295-303.
[7]Hwang H J,Kim S W,Choi JW,et al.Production and characterization of exopolysaccharides from submerged culture of Phellinus linteus KCTC 6190[J].Enzyme and Microbial Technology,2003,33:309-319.
[8]张秀丽,杨小明,何娟,等.无花果多糖的部分理化性质研究[J].食品研究与开发,2012,33(11):35-38.
[9]Staub A.M.Methods in carbohydrate[J].Chemistry,1965,15(5):5-11.
[10]金鸣,蔡亚欣,李金荣.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[11]谷学新,邰超.一个新的测定Fenton反应产生的·OH及清除的荧光方法[J].分析科学学报,2002,18(6):460-463.
[12]Oyaizu M.Studies on products of browning reaction:Antioxidative of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315.
[13]Mathew S,Abraham T.E.In vitro antioxidant activity and scavenging effects of Cinnamomum verum leaf extract assayed by different methodologies[J].Food Chemistry Toxicol,2006,44(2):198-206.
[14]康如龙,刘倩,苏小建,等.冬瓜皮提取物抗氧化性活性的研究[J].食品科技,2013(3):218-222.
[15]Zhanyong Wang,Chenyu Wang,Yue Quan.Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activities in vitro[J].Carbohydrate Polymers,2014(99):110-115.
Extraction of polysaccharides from Phellinus igniarius mycelium and research of its antioxidation activity in vitro
LI Yue-ying1,2,YANG Xiao-ming1,*,LIU Lian1,GUO Dan-zhao1
(1.School of Food and Biological Engineering Jiangsu University,Zhenjiang 212013,China; 2.School of Medicine Jiangsu University,Zhenjiang 212013,China)
In order to obtain the optimal technological condition of polysaccharides extraction from Phellinus igniarius mycelium,and study its antioxidation activity in vitro.Then,the effects of the extraction time,extraction temperature,solid-liquid ratio and the extraction times of the polysaccharides by single factor experiments and orthogonal experiments in distilled water on the yield of this polysaccharide were investigated.At the same time,its scavenging abilities on superoxide and hydroxyl radicals and reducing power were observed.The orthogonal experimental results showed that the optimal conditions were extraction temperature 100℃,solid-liquid ratio 1∶15 g/mL,extraction time 2 h,2 times.Under this condition,the average rate of extraction of polysaccharides was 6.64%.The polysaccharide content was 69.29%,and the protein content was 3.20% of this crude polysaccharide.When the concentration of polysaccharides from P.igniarius mycelium was 0.2 mg/mL,the scavenging rate on superoxide anion was 49.4%,scavenging rate on hydroxyl radical was 28.7%,and reducing power was 0.072.The results were all less than that of VC.
2015-09-21
李月英(1972-),女,博士研究生,副教授,研究方向:肿瘤生物化学治疗,E-mail:xzy0511@163.com。
杨小明(1963-),女,博士,教授,主要从事天然产物分离与性质研究,E-mail:XM_Yang1963@126.com。
国家自然科学基金(31301544,81372404)。
TS201.2
B
1002-0306(2016)07-0243-06
10.13386/j.issn1002-0306.2016.07.038

