二氧化氮二聚体及异构化机理的理论研究
靳玲侠, 闵锁田, 王志银, 赵梦婷
(1.陕西理工大学 化学与环境科学学院, 陕西 汉中 723000;2.陕西省催化基础与应用重点实验室, 陕西 汉中 723000)
二氧化氮二聚体及异构化机理的理论研究
靳玲侠1,2,闵锁田1,2,王志银1,2,赵梦婷1
(1.陕西理工大学 化学与环境科学学院, 陕西 汉中 723000;2.陕西省催化基础与应用重点实验室, 陕西 汉中 723000)
采用CBS-QB3组合方法对二氧化氮二聚体结构及异构化机理进行研究,获得了3种稳定异构体及部分异构化过渡态,并计算出其互变反应过程的反应焓、活化吉布斯自由能及反应速率常数等参数。结果表明:3种二聚体的相对稳定性为M3>M2>M1。同时发现,M3和M2构型可以通过键旋转方式实现相互转化,反应主通道为M3→TSM3/M2→M2,该步骤的活化吉布斯自由能为29.50 kJ·mol-1,反应速率常数为4.2×107s-1,因此M3极易向M2转化。
二氧化氮二聚体;密度泛函理论(DFT);异构化反应
二氧化氮在室温下是红棕色、有毒、顺磁性气体。二氧化氮冷凝成棕色液体,但固体是无色的,且固体几乎全部是四氧化二氮,液体中含有1%的二氧化氮,而在100 ℃下的蒸气中含90%二氧化氮,在高于160 ℃时可分解成一氧化氮和氧气。通常二氧化氮和四氧化二氮处于平衡状态[1]。
实验光谱证实:NO2在常温下可聚合氮氮键O2N—NO2等多种聚合体。结合Pauli原理及发生反自旋硝基也可以得出相同结论[2]:NO2二聚体可以形成“八字单键”斜切互动独享的氧原子电子和氮氮反键轨道O2N—NO2。这些因素表现在实验方面即:N—N键增长;ONO键角减小。史密斯等[3]通过电子衍射实验已经证实二氧化氮在气态中存在二氧化氮二聚体结构;Broadley等[4]在X射线衍射实验中得到最稳定的二氧化氮二聚体平面O2N—NO2结构;Snyder等[5]通过红外光谱实验证实了NO2二聚体可以稳定存在于三相中;Hisatsune等[6]在实验中证实了二氧化氮二聚体在液氮温度下可形成扭曲或歪斜的非平面结构。尽管在二氧化氮二聚体的存在实验方面做了大量研究,但到目前为止,仍未见二氧化氮二聚体相互转化机理的相关研究报道。因此,从理论上深入研究二氧化氮二聚体的稳定性及动力学性质具有重要意义。本文采用CBS-QB3方法对二氧化氮二聚体可能存在的稳定异构体及部分异构体的相互转化机理分别进行了详细计算,获得了二聚体异构化反应过程中的反应焓、活化吉布斯自由能及速率常数等参数,这些计算结果可为探讨二氧化氮二聚体的相互作用本质提供一定的理论参考。
1 计算方法和模型
已有研究表明[7],密度泛函B3LYP方法研究分子聚合方面可提供合理的几何参数和较准确的结合能等信息。本文采用CBS-QB3组合方法[8-10]分别对NO2、NO2二聚体及部分二聚体的异构化反应进行详细计算研究。高精度的CBS-QB3是一个组合方法,其计算过程总共包含5步,几何构型优化和频率计算采用CBSB7基组,单点能计算采用CCSD(T)、MP4SDQ、MP2及CBS外推方法[8]。为确认驻点性质和反应路径连接的合理性,在B3LYP/CBSB7水平上对反应物、中间体、过渡态及产物的几何构型进行优化,并在相同水平上进行内禀反应坐标(IRC)[11]分析。同时获得了零点能、总能量、热焓和吉布斯自由能,并获得了部分二聚体异构化反应的势能面剖面图,采用如下公式计算反应速率常数[12]:
式中kB和h分别为Boltzmann和Planck常数,ΔG≠为活化吉布斯自由能。在进行热力学计算时,温度和压强取程序内定值,即298.15 K和101.325 kPa[12]。在相同水平上计算了单点能,由此获得相对能ER。全部计算采用Gaussian03程序包[13]在PIV微机上完成。
2 结果与讨论
2.1几何构型
图1为CBS-QB3水平上NO2单体、3种NO2二聚体及异构化过渡态的几何构型,表1列出了CBS-QB3水平上NO2单体、NO2二聚体及异构化过渡态的部分几何参数。从表1中的数据可知:在CBS-QB3水平下,构型M1中O3—O5之间的键长为2.286 Å;构型M2中N2—N3之间的键长为2.531 Å;构型M3中O3—O5之间的键长为2.703 Å,N2—N3之间的键长为1.781 Å,表明二氧化氮二聚体分子M3间存在较强的相互作用力。

图1 NO2单体、3种NO2二聚体及异构化过渡态的几何构型

表1 NO2单体及NO2二聚体及异构化过渡态的部分几何参数
由上述分析可知,3种二聚体构型的键角与单体相比,其变化在2°~17°范围内。由此可见,二聚体分子间相互作用对二氧化氮分子单体键角的扭曲及单键转动具有一定影响。
2.2异构体的相对稳定性及部分二聚体的异构化机理
表2列出了二氧化氮二聚体及过渡态电子结构能E、吉布斯自由能G、焓值H、相对能ER、相对自由能GR及异构化反应过渡态的虚频v。表3列出了M3和M2构型异构化转化过程的反应ΔH、活化能ΔE≠、活化吉布斯自由能ΔG≠及298. 15 K时的速率常数k。如表2所示,通过比较异构体能量可知,各异构体的相对稳定性为M3>M2>M1。其中构型M3相对能量最低,稳定性最高,构型M1相对能量最高,稳定性最低。
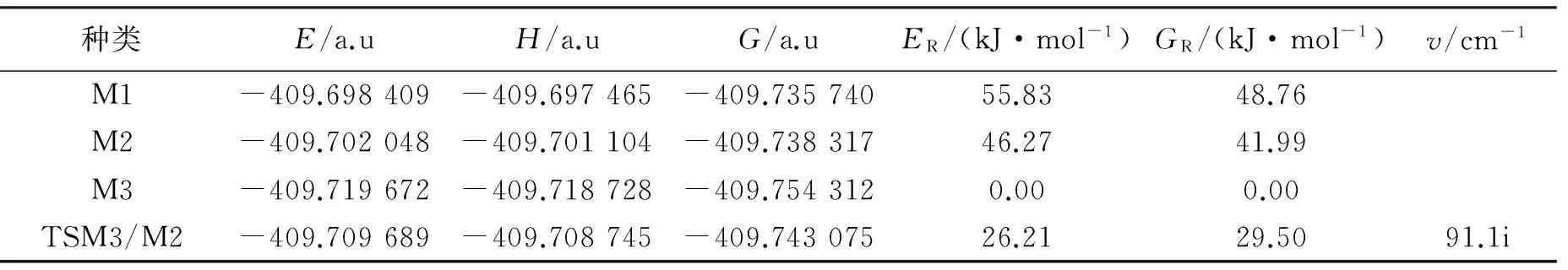
表2 各二聚体E、H、G、ER、GR及过渡态v值
NO2经无势垒过程可直接键链形成二聚体,其中部分二聚体之间可通过异构化反应实现相互转化。由于二聚体的异构化是N—N键的旋转,其过渡态TSM3/M2有且唯一的虚频值为91.1i cm-1。两个NO2中的N原子直接键链,经过无势垒过程首先形成二聚体M3,然后经过渡态TSM3/M2转化为二聚体M2。即N—N键长发生了变化,由原来1.781 Å增长至1.787 Å。O—N—O的键角也发生了变化,由原来的134.2°缩小至133.4°。分子构型也由平面型转化到十字交错的构型,如表3所示,此过程的吉布斯自由能垒为29.50 kJ·mol-1,吸收47.27 kJ·mol-1的能量,速率常数为4.2×107s-1,在常温下可自发进行转化。

表3 M3和M2构型转化过程的ΔH、ΔE≠、ΔG≠及298.15 K时的k
3 结 论
本文通过CBS-QB3组合方法对NO2二聚体相互作用及部分二聚体相互转化机理进行了详细计算研究,可得出如下结论:
(1)NO2二聚体的相对热力学稳定性为:M3>M2>M1,其中M3能量最低,最稳定,M1则相对能量较高,稳定性最低;
(2)二聚体M3与M2之间可以相互转化,其中键旋转所需活化能较低,仅需吉布斯活化自由能为29.50 kJ·mol-1,速率常数为4.2×107s-1,极易实现。
[1]ZHOU Zheng-yu,GAO Hong-wei,XING Yu-mei,et al.Theoretical study on the NO2+NO2-electron transfer reaction[J].Chinese Journal of Chemistry,2002,14(20):644-649.
[2]张远,曹爱年,孙岳明,等.NO双分子和二聚体与Cu2作用的理论计算[J].物理化学学报,2003,19(3):193-197.
[3]YONG K X A,KING J M,MCKELLAR A R W,et al.Infrared combination and difference bands of the NO dimmer[J].Journal of Molecular Spectroscopy,2006,238(12):127-134.
[4]PEEBLES S A,PEEBLES R A.Isotopic studies and refined structure for the dimethyl ether-CS2dimer[J].Journal of Molecular Structure,2007,830(1-3):176-181.
[5]董洁,朱俊,陈向荣,等.水二聚体分子间相互作用的理论研究[J].四川大学学报:自然科学版,2004,41(6):1212-1215.
[6]MØLL E R C,PLESSET M S.Note on an approximation treatment for many electron systems[J].Physical Review,1934,46(7):618-622.
[7]BOYS S F,BERNARDI F.The calculation of small molecular interactions by the differences of separate total energies.Some procedures with reduced errors[J].Molecular Physics,2006,19(4):533-566.
[8]MONTGOMERY J A,FRISCH M J,OCHTERSKI J W,et al.A complete basis set model chemistry.VI.Use of density functional geometries and frequencies[J].Journal of Chemical Physics,1999,110(6):2822-2827.
[9]MONTGOMERY J A,OCHTERSKI J W,PETERSSON G A.A complete basis set model chemistry IV An improved atomic pair natural orbital method[J].Journal of Chemical Physics,1994,101(7):5900-5909.
[10]PETERSSON G A,TENSFELDT T G,MONTGOMERY J A.A complete basis set model chemistry III The complete basis set quadratic configuration interaction family of methods[J].Journal of Chemical Physics,1991,94(9):6091-6101.
[11]GONZALEZ C,SCHLEGEL H B.An improved algorithm for reaction path following[J].Journal of Chemical Physics,1989,90(90):2154-2161.
[12]EYRING H.The activated complex and the absolute rate of chemical reactions[J].Chemical Reviews,1935,17(1):65-77.
[13]FRISCH M J,TRUCKS G W,SCHLEGEL H B,et al.Gaussian 09,Revision A.02[CP].Wallingford:Gaussian,Inc,CT,2009.
[责任编辑:李 莉]
Theoretical studies on the nitrogen dioxide dimer and isomerization mechanisms
JIN Ling-xia1,2,MIN Suo-tian1,2,WANG Zhi-yin1,2,ZHAO Meng-ting1
(1.School of Chemistry and Environment Science, Shaanxi Sci-Tech University, Hanzhong 723000, China;2.Shaanxi Key Laboratory of Catalysis, Hanzhong 723000, China)
The nitrogen dioxide dimer and isomerization mechanisms have been studied by CBS-QB3 method. Three tautomers and transition state are located. The reaction enthalpies, activation free energies and the rate constants of tautomerism are also obtained. The results indicate that the thermodynamic stability of complexes is M3>M2>M1. The pathway from M3 to M2 via transition state TSM3/M2 is found. The activation free energy associated with this step is 29.50 kJ·mol-1, and the rate constant is 4.2×107s-1, suggesting this reaction is easier to be happen.
nitrogen dioxide dimer;density functional theory (DFT);isomerization
1673-2944(2016)04-0051-03
2016-03-25
2016-05-31
陕西省教育厅专项科研基金资助项目(16JK1134);陕西理工学院科研基金资助项目(SLGQD14-10)
靳玲侠(1981—),女,陕西省大荔县人,陕西理工大学讲师,博士,主要研究方向为生物小分子反应机理。
O641.1
A

