长期施药果园中的苹果轮纹病菌对戊唑醇和甲基硫菌灵的敏感性
安久栋, 国立耘, 朱小琼, 宋月凤
(中国农业大学植物保护学院, 北京 100193)
长期施药果园中的苹果轮纹病菌对戊唑醇和甲基硫菌灵的敏感性
安久栋,国立耘*,朱小琼,宋月凤
(中国农业大学植物保护学院, 北京100193)
为了监测果园中苹果轮纹病菌对戊唑醇和甲基硫菌灵敏感水平的变化,采用菌丝生长速率法测定了采集自山东烟台地区和北京市昌平区,有较长施药史苹果园中的苹果轮纹病菌对戊唑醇和甲基硫菌灵的敏感性。结果表明:戊唑醇对连续施用戊唑醇5年、每年施药1~2次的果园中苹果轮纹病菌的EC50为0.017 4~0.114 3 μg/mL,即该类果园中苹果轮纹病菌对此药的敏感性仍然保持在较高水平,与野生菌株的敏感性非常接近,没有出现敏感性分化的抗药亚群体;甲基硫菌灵对连续施用甲基硫菌灵10年、每年施药2次的果园中苹果轮纹病菌的EC50为0.846 4~4.677 4 μg/mL,果园中苹果轮纹病菌与野生菌株相比EC50平均值约上升3.15倍,最低值和最高值分别是已报道敏感性基线的1.19倍和6.59倍,没有出现敏感性发生显著分化的抗药性亚群体。
苹果轮纹病菌;戊唑醇;甲基硫菌灵;敏感性
苹果轮纹病分布广泛,在我国各苹果产区均有发生,且有逐年加重的趋势[1]。该病是由Botryosphaeriadothidea引起的真菌病害[2],主要危害果实和枝干,在果实贮藏期仍可致病,不仅造成树势衰弱、枝干枯死,而且造成大量烂果[3],是制约苹果产量和品质的最为重要的病害之一。
目前,化学防治仍是治理苹果轮纹病的主要措施,其中戊唑醇和甲基硫菌灵是主要推广使用的药剂。戊唑醇通过抑制麦角甾醇的生物合成而干扰真菌细胞膜的形成[4],具有广谱、内吸等特点,对苹果轮纹病具有良好的防治效果[5]。该药自20世纪90年代中期开始在中国苹果树上登记使用,由于当时戊唑醇原药和制剂价格偏高,登记后的十几年中在苹果生产中没有得到广泛的推广应用。进入21世纪后,戊唑醇首先在山东东部苹果产区迅速推广应用[6],室内抗药性风险评估认为苹果轮纹病菌对戊唑醇的室内抗药性具有高度至中等风险[7],因此对田间病菌敏感性进行及时监测十分重要。
以甲基硫菌灵为代表的苯并咪唑类药剂也是防治苹果轮纹病的高效内吸性杀菌剂。该药被植物体吸收后,经过一系列生化反应最终被分解为多菌灵[8],多菌灵可以特异性地与病原真菌的β-微管蛋白结合,干扰微管装配,进而影响有丝分裂中纺锤体的形成,使病原菌孢子萌发长出的芽管发生扭曲,从而使病菌不能正常进行有丝分裂而达到杀菌的效果[9]。室内抗药性风险评估认为甲基硫菌灵具有高抗药风险性[10],国内外已有研究表明许多病原菌对甲基硫菌灵产生了抗性[9,11]。在我国各苹果产区,甲基硫菌灵的推广较早且具有较高的施用率。但是未开展苹果轮纹病菌对该药敏感性水平监测。
综上所述,戊唑醇和甲基硫菌灵是防治苹果轮纹病的主要药剂,在我国苹果产区已推广使用多年,病原菌在这两种药剂持续的选择压力下有可能产生抗药性菌株。因此,及时进行病原菌敏感性的监测,对于保证防治效果是十分重要的。本研究采用菌丝生长速率法,分别测定了果园中的苹果轮纹病病原菌对戊唑醇和甲基硫菌灵的敏感性。
1 材料与方法
1.1材料
供试菌株:69株苹果轮纹病菌菌株采集于山东烟台地区,其中烟台福山区25株,烟台蓬莱市23株,烟台海阳市21株,果园每年施用戊唑醇1~2次,连续施用5年;34株采集于北京昌平区,果园每年施用甲基硫菌灵2次,连续施用10年。所有菌株均经过组织分离、单菌丝纯化,鉴定为Botryosphaeriadothidea。
供试药剂为96.7%戊唑醇原药(江苏剑牌农药化工有限公司),98.6%甲基硫菌灵原药(陕西美邦农药有限公司)。
1.2方法
1.2.1含药培养基的制备
用电子天平称取0.1 g戊唑醇原药,溶于约9 mL异丙醇(99.7%),用10 mL容量瓶定容,配成浓度为104μg/mL的母液,于4℃冰箱中保存备用。制备含药培养基时,用异丙醇按一定比例将母液稀释到所需的质量浓度,加入培养基千分之一体积的稀释液[12],得到如下终浓度的含药PDA平板:0、0.025、0.05、0.1、0.25、0.5、1、2 μg/mL,对照培养基加入等量异丙醇。
用电子天平称取0.1 g甲基硫菌灵原药,溶于约9 mL丙酮(99.5%),用10 mL容量瓶定容,配成浓度为 104μg/mL的母液,于4℃冰箱中保存备用。制备含药培养基时,用丙酮按一定比例稀释母液到所需的质量浓度,加入培养基千分之一体积的稀释液,得到如下终浓度的含药PDA平板:0、0.1、0.25、0.5、1、2、4 μg/mL,对照培养基加入等量丙酮。
1.2.2菌丝生长速率法测定供试药剂对苹果轮纹病菌的EC50
将供试菌株转接到PDA培养基中培养4 d左右,用直径5 mm打孔器在菌落边缘打取直径为5 mm的菌饼,用接种针挑取菌饼菌丝面朝下接种于各个浓度平板的中央,26℃黑暗培养,每个处理3次重复。3 d后,用十字交叉法测量各个平板的菌落直径,计算平均菌落直径,按下列公式计算菌丝生长抑制率:
抑菌率(%)=
通过Excel软件进行药剂浓度对数值和菌丝生长抑制率几率值之间的线性回归分析,将菌丝生长抑制率转化为几率值,药剂浓度转换为对数值,以X(药剂浓度的对数值)和Y(抑制率几率值)做线性回归分析得到回归方程Y=a+bX,当Y=5 时,求出X的反对数[5]即为供试药剂对各供试苹果轮纹病菌菌株的EC50。
1.2.3不同甲基硫菌灵敏感性菌株的β-tubulin基因序列分析
采用OligoCalc(Oligonucleotide Properties Calculator, http://www.basic.northwestern.edu/biotools/oligocalc.html)设计扩增苹果轮纹病菌β-tubulin基因的特异性引物TubF:5′-GTCAGGAGTCGCAGTCAGTAATTAG-3′和TubR:5′-CTTCATTTTGTCGCATGTCTGGCTC-3′,扩增片段长度约为2.1 kb。选择5株对甲基硫菌灵敏感性不同的苹果轮纹病菌菌株,在PDA培养基上培养5~6 d,收集菌丝,用试剂盒SP Fungal DNA Kit提取DNA,用引物TubF/TubR扩增β-tubulin基因。PCR反应总体积为50 μL:10×LA PCR buffer(Mg2+Plus)5 μL,dNTPs(2.5 mmol/L)5 μL,TubF/TubR(20 μmol/L)各1 μL,LATaqDNA聚合酶(1.5 U/μL,TaKaRa)0.5 μL,模板DNA 2 μL,ddH2O补至50 μL。反应程序为:95℃预变性9 min;94℃变性1 min,61℃退火1 min,72℃延伸2 min,共35个循环;72℃延伸10 min。扩增产物在1%的琼脂糖凝胶、0.5×TBE中电泳30 min,电压为100 V,然后用溴化乙锭染色,并用凝胶成像仪观察、拍照。
电泳检测后的PCR产物交由北京三博远志生物技术有限责任公司用正反向引物进行序列测定。用ClustalW 1.82软件(http://www.ebi.ac.uk/clustalw/)对所测序列与从NCBI上下载的β-tubulin基因序列进行比对,根据NCBI上登录的β-tubulin基因相关序列的编码区,截取所测序列的编码区,用EMBOSS软件(http://www.ebi.ac.uk/emboss/transeq)将DNA序列翻译为蛋白质序列,用ClustalW 1.82软件比较不同敏感性的苹果轮纹病菌菌株β-tubulin基因对应的蛋白质序列,确定是否有氨基酸突变。
2 结果与分析
2.1苹果轮纹病菌对戊唑醇的敏感性
采用菌丝生长速率法测定了从山东烟台地区施用戊唑醇5年的果园中采集的69株苹果轮纹病菌对戊唑醇的敏感性。结果表明戊唑醇对苹果轮纹病菌菌丝生长具有明显的抑制作用,EC50为0.017 4~0.114 3 μg/mL,最高值约是最低值的6.57倍,EC50平均值为(0.057 8±0.018 3)μg/mL(表1)。根据 EC50极差R=Xmax-Xmin=0.114 3-0.017 4=0.096 9 μg/mL,将EC50数据分成6组,EC50的频数分布见图1。戊唑醇对69株苹果轮纹病菌菌株EC50的频数分布呈现单峰曲线,符合正态分布,表明苹果轮纹病菌菌株对戊唑醇的敏感性没有产生分化,未出现敏感性下降的抗药性亚群体(图1)。王英姿等[6]采集山东地区未施用过戊唑醇的野生轮纹病菌菌株建立的敏感性基线为(0.111 5±0.048 5)μg/mL,相比可知,烟台地区施用戊唑醇5年果园中的苹果轮纹病菌的EC50平均值是已报道敏感性基线的0.52倍,最低值和最高值分别是已报道敏感性基线的0.16倍和1.03倍。
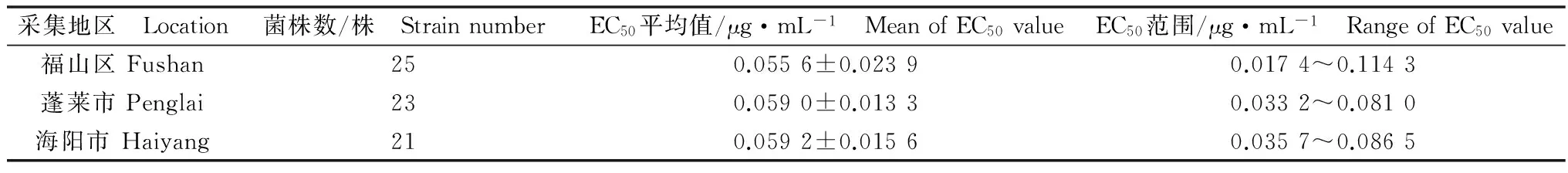
表1 山东省烟台地区苹果轮纹病菌对戊唑醇的敏感性Table 1 Susceptibility of Botryosphaeria dothidea from Yantai, Shandong Province to tebuconazole

图1 戊唑醇对山东烟台地区苹果轮纹病菌的 EC50频数分布Fig.1 Frequency distribution of EC50 values of tebuconazole against isolates of Botryosphaeria dothidea from Yantai, Shandong Province
2.2苹果轮纹病菌对甲基硫菌灵的敏感性
采用菌丝生长速率法测定了来自北京市昌平区的34株苹果轮纹病菌对甲基硫菌灵的敏感性。结果显示,随着甲基硫菌灵浓度升高,对苹果轮纹病菌菌丝生长的抑制作用逐渐增强。EC50为0.846 4~4.677 4 μg/mL,最高值约是最低值的5.53倍,EC50平均值是(2.235 6±0.857 5)μg/mL(图2,表2)。根据EC50极差R=Xmax-Xmin=4.677 4-0.846 4=3.831 μg/mL,将EC50数据分成8组,EC50的频数分布见图2。有94.12%的菌株集中于主峰范围内,58.8%的供试菌株的EC50小于平均值。杨炜华等[11]采集山东泰安的野生轮纹病菌菌株建立的敏感性基线为0.710 2 μg/mL,相比可知,采集于北京昌平区施用甲基硫菌灵10年果园中的苹果轮纹病菌的EC50平均值是已报道敏感性基线的3.15倍,最低值和最高值分别是已报道敏感性基线的1.19倍和6.59倍。

图2 甲基硫菌灵对北京市昌平区苹果轮纹病菌的 EC50频数分布Fig.2 Frequency distribution of thiophanate-methyl EC50values against isolates of Botryosphaeria dothidea from Changping District, Beijing
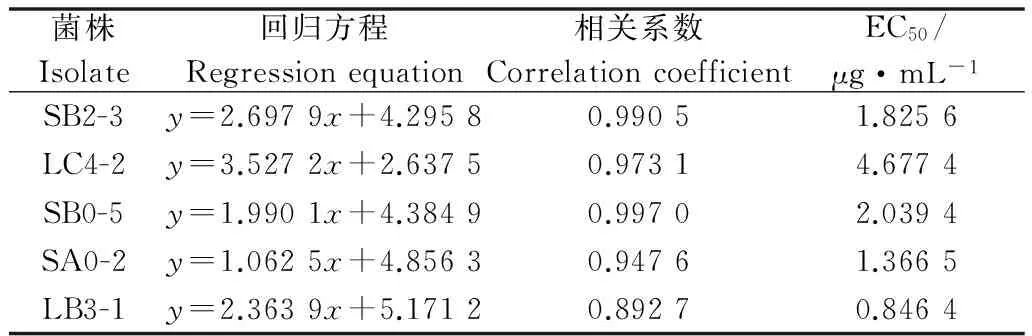
菌株Isolate回归方程Regressionequation相关系数CorrelationcoefficientEC50/μg·mL-1SB2-3y=2.6979x+4.29580.99051.8256LC4-2y=3.5272x+2.63750.97314.6774SB0-5y=1.9901x+4.38490.99702.0394SA0-2y=1.0625x+4.85630.94761.3665LB3-1y=2.3639x+5.17120.89270.8464
2.3β-tubulin基因序列分析结果
选择对甲基硫菌灵敏感性不同的5株菌SB2-3、LC4-2、SB0-5、SA0-2和LB3-1,用TubF和TubR均扩增出2.1 kb的DNA片段。测序后去掉内含子,将序列重新拼接并进行比对,发现不同敏感性菌株β-tubulin基因序列存在碱基的差异,菌株SA0-2第183位、第291位、第597位、第696位碱基对发生突变(图3);将不同敏感性菌株的β-tubulin基因序列翻译为蛋白序列,并进行比对,发现氨基酸序列完全相同,均没有发生变化(图4),说明对甲基硫菌灵敏感性不同的苹果轮纹病菌β-微管蛋白基因未出现引起β-微管蛋白氨基酸序列发生变化的突变。

图3 北京市昌平区对甲基硫菌灵不同敏感性的苹果轮纹病菌β-微管蛋白基因序列比对结果Fig.3 Alignment of β-tubulin gene of Botryosphaeria dothidea from Changping District, Beijing with different susceptibility to thiophanate-methyl

图4 北京市昌平区对甲基硫菌灵不同敏感性的苹果轮纹病菌β-微管蛋白的氨基酸序列比对结果Fig.4 Alignment of β-tubulin amino acid sequences of Botryosphaeria dothidea from Changping District, Beijing with different sensibility to thiophanate-methyl
3 讨论
戊唑醇为新一代三唑类杀菌剂,具有高效、广谱、内吸、低毒等特性,对大田作物、果树、蔬菜和重要的经济作物上由子囊菌、担子菌和半知菌引起的重要病害具有极好的治疗和铲除作用,且用量低[13]。戊唑醇结构上与其他三唑类杀菌剂相似,但在安全性、使用范围等方面有所提高[14]。21世纪后该药在山东东部苹果产区迅速推广使用,给该地区的苹果轮纹病菌造成更大的选择压力。王英姿等[6]的试验结果表明,来自山东不同区域的苹果轮纹病菌大多数仍对戊唑醇表现较高的敏感性,15.49%的菌株对戊唑醇产生了2~5倍低水平抗药性,且抗性菌株集中在山东东部地区,表明戊唑醇防治苹果轮纹病具有一定的风险性。苏平等[5]检测了山东、河南和辽宁苹果种植区的苹果轮纹病菌对戊唑醇的敏感性,结果表明苹果轮纹病菌对戊唑醇的敏感性呈单峰分布,未出现敏感性分化的亚群体,其中山东地区的苹果轮纹病菌对戊唑醇敏感性最低,辽宁地区的苹果轮纹病菌对戊唑醇敏感性最高,但不同地理来源的苹果轮纹病菌对戊唑醇的敏感性差异不显著。
目前,苹果轮纹病菌对戊唑醇的敏感性检测采用的供试菌株大多针对性不强,不能体现出戊唑醇田间施用史对苹果轮纹病菌敏感性的影响。本研究采集山东烟台地区苹果产区连续施用戊唑醇5年以上,每年施用1~2次,且未施用过其他三唑类杀菌剂的果园中的苹果轮纹病菌测定其对戊唑醇的敏感性,发现所有苹果轮纹病菌对戊唑醇均保持较高敏感性,与之前报道的敏感性基线非常接近,未出现抗药性分化的亚群体。
甲基硫菌灵在我国登记较早,目前在各大苹果产区应用普遍,是苹果轮纹病化学防治中应用最广泛、最重要的药剂之一。杨炜华等[11]对我国重要苹果产区的苹果轮纹病菌进行了抗药性检测,结果表明,我国重要苹果产区对多菌灵的抗性菌株已普遍存在,表现为中低水平抗药性;对甲基硫菌灵存在低水平抗药性菌株。李晓军等[15]测定了山东主要苹果产区苹果轮纹病菌对多菌灵的敏感性,发现多菌灵对苹果轮纹病菌菌株的EC50呈单峰频次分布,没有出现敏感性分化的亚群体。马志强等[16]通过检测河北保定地区苹果轮纹病菌对多菌灵的敏感性,发现供试菌株对多菌灵的敏感性均已产生不同程度的分化。不同地理和施药史来源的苹果轮纹病菌对多菌灵的敏感性不同。由于甲基硫菌灵主要通过转化为多菌灵对病害起到防治作用,因此两种药剂之间存在交互抗性[8]。本研究检测了北京市昌平区连续施用甲基硫菌灵10年,每年施用2次的苹果园中的苹果轮纹病菌对甲基硫菌灵的敏感性并与之前报道的敏感性基线相比[11],没有发现明显的抗性群体,对不同敏感性的苹果轮纹病菌β-微管蛋白基因序列的测定,也没有发现对应位点氨基酸序列的变化,进一步证实了病原菌在分子水平上没有发生抗药性突变。综上结果表明,按照每年施用2次的频率,这两种药剂是可以长期用于苹果轮纹病的防治。建议生产中将戊唑醇与苯并咪唑类杀菌剂交替使用,增强防治效果,延缓病原菌抗药性的产生,提高杀菌剂的使用寿命。甲基硫菌灵仍然可以用于苹果轮纹病的防治。
[1]国立耘, 李金云, 李保华, 等. 中国苹果枝干轮纹病发生和防治情况[J]. 植物保护, 2009, 35(4): 120-123.
[2]Tang W, Ding Z, Zhou Z Q, et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China isBotryosphaeriadothidea[J].Plant Disease,2011,96:486-496.
[3]袁忠林, 罗兰, 孟昭礼. 仿生农用杀菌剂银泰对苹果两种主要病害的防治效果[J]. 植物保护学报, 2006, 33(2): 223-224.
[4]Doukas E G, Markoglou A N, Vontas J G, et al. Effect of DMI-resistance mechanisms on cross-resistance patterns, fitness parameters and aflatoxin production inAspergillusparasiticusSpeare [J]. Fungal Genetics and Biology, 2012, 49(10): 792-801.
[5]苏平, 周增强, 侯珲, 等. 苹果轮纹病菌对戊唑醇的敏感性检测[J]. 果树学报, 2010, 27(1): 69-76.
[6]王英姿, 张伟, 刘保友, 等. 山东省苹果轮纹病菌对戊唑醇的抗药性及其地理分布[J]. 果树学报, 2010, 27(6): 961-964.
[7]范昆,曲健禄,李林光,等.苹果轮纹病菌对戊唑醇的敏感基线及其室内抗药突变体研究[J].果树学报,2013,30(4):650-656.
[8]廖国会,段婷婷,秦立新,等.高效液相色谱同时测定蔬菜中多菌灵,甲基托布津残留量[J].贵州农业科学,2005,33(4):75-76.
[9]Fernández-Ortuo D, Schnabel G. First report of thiophanate-methyl resistance inBotrytiscinereaon strawberry from South Carolina [J]. Plant Disease, 2012, 96(11): 1700.
[10]Ma Z H, Yoshimura M A, Holtz B A, et al. Characterization and PCR-based detection of benzimidazole-resistant isolates ofMonilinialaxain California[J]. Pest Management Science, 2005, 61(5): 449-457.
[11]杨炜华, 刘开启. 苹果轮纹病菌对多菌灵, 甲基硫菌灵的抗药性测定[J]. 植物保护学报, 2002, 29(2): 191-192.
[12]Ma Z H, Michailides T J. Advances in understanding molecular mechanisms of fungicide resistance and molecular detection of resistant genotypes in phytopathogenic fungi [J]. Crop Protection, 2005, 24(10): 853-863.
[13]孙景文, 马洪艳. 30%多菌灵·戊唑醇悬浮剂防治苹果轮纹病田间药效试验[J]. 现代农药, 2008, 7(2): 55-56.
[14]刘英华, 王开运, 姜兴印, 等. 禾谷丝核菌对戊唑醇的抗性及抗药性菌系生物学特性[J]. 植物保护学报, 2003, 30(4): 423-428.
[15]李晓军, 范昆, 曲健禄, 等. 苹果轮纹病菌对多菌灵的敏感性测定[J]. 果树学报, 2009, 26(4): 516-519.
[16]马志强, 李红霞, 袁章虎, 等. 苹果轮纹病菌对多菌灵抗药性监测初报[J]. 农药学学报, 2000, 2(3):94-96.
(责任编辑:杨明丽)
Susceptibility ofBotryosphaeriadothideato tebuconazole and thiophanate-methyl
An Jiudong,Guo Liyun,Zhu Xiaoqiong,Song Yuefeng
(College of Plant Protection, China Agricultural University, Beijing 100193, China)
In order to monitor the susceptibility ofBotryosphaeriadothideato tebuconazole and thiophanate-methyl in orchards with long history of using these two fungicides, the susceptibility ofB.dothideaisolates collected from represented orchards to these two fungicides was determined based on mycelium growth rate. The results showed that the EC50values of tebuconazole against 69 isolates collected from Yantai,Shandong Province with application of tebuconazole for 1-2 times each year for 5 years ranged from 0.017 4 to 0.114 3 μg/mL with no appeared resistant sub-populations. The EC50values of thiophanate-methyl against 34 isolates collected from Changping District, Beijing with application of thiophanate-methyl for 2 times each year for 10 years ranged from 0.846 4 to 4.677 4 μg/mL with no appeared resistant sub-populations. The maximum and minimum values were 1.19 and 6.59 times of the reported susceptible baseline, respectively.
Botryosphaeriadothidea;tebuconazole;thiophanate-methyl;susceptibility
2015-01-08
2015-06-08
国家现代农业产业技术体系(CARS-28)
E-mail: ppguo@cau.edu.cn
S 436.611
A
10.3969/j.issn.0529-1542.2016.02.034

