柑橘炭疽病菌的生物学特性及枯草芽胞杆菌对其的抑制作用
邹 娟, 姚 卓, 尚永华
(怀化学院生命科学系, 民族药用植物资源研究与利用湖南省重点实验室, 怀化 418000)
柑橘炭疽病菌的生物学特性及枯草芽胞杆菌对其的抑制作用
邹娟*,姚卓,尚永华
(怀化学院生命科学系, 民族药用植物资源研究与利用湖南省重点实验室, 怀化418000)
近5年来,湖南麻阳苗族自治县的柑橘种植园发生柑橘炭疽病。采集发病柑橘植株,分离其病原菌,从病原菌的培养性状和形态学特征、内转录区(ITS)序列分析和系统发育关系比较等方面对该病原菌进行了鉴定,并探索了枯草芽胞杆菌(Bacillussubtilis)CGMCC 1.354对其的抑制作用。结果表明:该地区柑橘炭疽病菌为盘长孢状刺盘孢(Colletotrichumgloeosporioides)。枯草芽胞杆菌CGMCC 1.354对该病原菌具有较强的抑制作用,其分泌的抑菌物质能抑制柑橘炭疽病菌菌丝生长和孢子萌发。
柑橘炭疽病;盘长孢状刺盘孢;枯草芽胞杆菌;抗菌活性
湖南省麻阳苗族自治县是该省柑橘的主产县,柑橘种植面积近1.3万hm2,年产量达30万t[1]。但是近5年来麻阳的柑橘炭疽病频繁发生并有加重的趋势。柑橘感染炭疽病后枝干、树叶和果实表面出现褐斑,易导致柑橘落叶、树干空洞和储藏期果实腐烂,直接影响果农的经济收益。据报道,广东省德庆县的名优柑橘品种和德庆贡柑大面积暴发过炭疽病,发病面积近 500 hm2,果园损失达2 000万元以上,给当地农业生产造成了很大的经济损失[2]。柑橘炭疽病又称褐斑病,病原菌为寄生真菌,该病菌在病树干或树皮上越冬,来年春季环境适宜时,尤其是阴雨潮湿时,病菌借风、雨、露水和昆虫等传播到嫩梢、新叶和幼果上。在有伤口(冻伤、灼伤、其他伤口)或树势生长衰弱时,该病菌即可萌发侵入,形成柑橘树干、树叶和果实的炭疽病,而潜伏在果实中的病原菌在贮藏期易引发柑橘褐斑腐烂。
目前柑橘炭疽病的防治以化学药剂为主[3-4],但农药在果实中的残留对人类健康存在潜在威胁,已成为全社会关注的问题。此外,杀菌剂的连续使用,可导致病原菌产生抗药性,使化学防治效果降低[5]。因此,在柑橘病害防治中,迫切需要寻找安全有效的防病新技术,以无毒高效的生物防治逐步取代化学杀菌剂。近年来,利用环境友好的生防菌防治植物真菌病害是国内外比较活跃的研究领域之一。生防枯草芽胞杆菌(Bacillussubtilis)CGMCC 1.354已广泛应用于微生物肥料和养殖水体净化[6],本研究首次发现该菌株对柑橘炭疽病菌具有良好的拮抗性能。本文探讨了柑橘炭疽病菌的生物学特性和枯草芽胞杆菌CGMCC 1.354对柑橘炭疽病菌的拮抗性能,为柑橘炭疽病菌的生物防治以及枯草芽胞杆菌CGMCC 1.354对柑橘炭疽病菌的生防价值和实际应用提供依据。
1 材料与方法
1.1材料
供试菌株为枯草芽胞杆菌(Bacillussubtilis)CGMCC1.354,购自中国普通微生物菌种保藏管理中心(北京)。
于湖南省怀化市麻阳苗族自治县的柑橘种植园中,从发病的‘冰糖橙’、‘脐橙’、‘椪柑’采集果实、枝茎、叶片。
马铃薯蔗糖琼脂培养基(PSA):取新鲜去皮马铃薯200 g置1 000 mL蒸馏水中煮沸30 min,纱布过滤。在滤液中加20 g琼脂,加热使琼脂完全溶化后用纱布过滤。滤液加20.0 g蔗糖完全溶解后,补足蒸馏水至1 000 mL。
牛肉膏蛋白胨培养基(BP):牛肉浸膏3.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,琼脂20.0 g/L,pH 7.4~7.6。
LB培养基:胰蛋白胨 10.0 g/L,酵母提取物 5.0 g/L,NaCl 10.0 g/L,琼脂20.0 g/L,pH 7.0~7.2。
1.2病原真菌的分离
1.2.1病原真菌分离与致病性鉴定
将采集到的发病柑橘植株如‘冰糖橙’、‘脐橙’、‘椪柑’的果实、枝茎、叶片用流水清洗样品表面的泥土渣渍,晾干水分。无菌条件下将试验材料放入75%乙醇中浸泡3 min,无菌水冲洗4~5次,再放入0.1%升汞溶液中浸泡1 min,无菌水冲洗4~5次,沥去多余水分。将处理过的样品病害处剪成小块,保留3 mm×3 mm的薄片,切去两端组织,接种于PSA培养基中,使部分组织嵌在培养基中,充分与培养基接触,放入28℃恒温培养箱中培养3~5 d。每日观察材料,待材料切口处长出菌丝后,及时挑取前端菌丝,转接至新鲜的PSA培养基中培养。
表面消毒效果的检查:将表面消毒的最后一遍清洗用过的无菌水按 0.1 mL/皿涂布于牛肉膏蛋白胨培养基上37℃下培养2 d后无菌落长出,表明表面消毒彻底,已消除了样品表面的附生菌。
对实验室分离得到的病原真菌的纯培养物按照柯赫氏法则进行致病性鉴定,鉴定采用针刺接种法。将蘸有各菌株菌悬液的海绵置于培养皿中,将待接种的新生嫩叶置于海绵上,用针刺使叶片产生伤口,接种后用透明塑料袋保湿4 d,观察是否产生典型的症状,并从表现症状的叶片上再分离培养病菌,以鉴定是否与原接种菌一致[7]。
1.2.2平板对峙检测
按李小俊的方法[8],在直径90 mm的LB平板中心接种已活化的直径8 mm大小的炭疽病菌菌饼,在LB固体培养基的培养皿底部用记号笔垂直对称分为4个区域,然后将供试枯草芽胞杆菌(Bacillussubtilis)菌株CGMCC 1.354接种于十字方向相同距离处,此为处理组,以仅接种炭疽病菌菌饼的LB平板为对照组,每组处理3个重复。28℃培养5 d。用十字交叉法测量炭疽病菌菌落直径大小,按下列公式计算供试枯草芽胞杆菌菌株CGMCC 1.354的抗菌活性:
抗菌活性(%)=[(对照组菌落直径-菌饼直径)-(处理组菌落直径-菌饼直径)]/(对照组菌落直径-菌饼直径)×100。
1.3病原真菌的鉴定
1.3.1病原真菌形态学鉴定
剪边长约2 cm的玻璃纸,经灭菌后贴于培养基上,在培养基中央接种病原菌,于28℃培养箱中培养4 d后取玻璃纸于显微镜下观察菌丝体及孢子形态与着生方式。
1.3.2分子生物学鉴定
病原真菌ITS区段通用引物的扩增与序列分析:采用玻璃纸PSA平板培养法收集病原真菌菌丝体,采用Ezup柱式真菌基因组DNA抽提试剂盒(生工生物工程上海有限公司),按照使用说明书提取其基因组DNA,置于-20℃冰箱保存备用。选用真菌ITS扩增的通用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC),对病原菌菌株进行ITS区段PCR扩增。 反应在 25 μL体系中进行,包括: 1 μL dNTPs (2.5 mmol/L),0.2 μLTaq酶(5 U/μL),2.5 μL 10×PCR buffer,0.5 μL primer ITS1(10 μmol/L), 0.5 μL primer ITS4 (10 μmol/L),0.5 μL(约20 ng/μL)基因组 DNA,加 ddH2O至 25 μL。扩增程序为:94℃预变性4 min;进入循环:94℃变性 45 s,55℃退火45 s,72℃延伸 1 min,30 个循环;72℃延伸 10 min,4℃保存。反应结束后,取 5 μL扩增产物,进行 1%琼脂糖凝胶电泳检测。于凝胶成像系统显影,利用SanPrep柱式DNA胶回收试剂盒回收PCR产物,测序工作由生工生物工程(上海)有限公司完成。
测序后的ITS区的扩增序列用Clustal X程序进行 rDNA 序列比对,将本研究菌株的 DNA 序列与GenBank 中刺盘孢的 ITS 序列进行同源性比较。然后用邻位加入法(neighbor-joining,NJ)构建系统发育树,系统进化树的测试方法为bootstrap method,重复次数为1 000,模型为kimura 2-parameter,其他参数为默认设置。
病原真菌ITS区段特异性引物的扩增:分别用盘长孢状刺盘孢(C.gloeosporioides)特异性引物CgInt:5′-GGCCTCCCGCCTCCGGGCGG-3′/ITS4:5′-TCCTCCGCTTATTGATATGC-3′和尖孢炭疽菌(C.acutatum)的特异性引物CaInt2:5′-GGGGAAGCCTCTCGCGG-3′/ITS4:5′-TCCTCCGCTTATTGATATGC-3′对供试菌株基因组DNA进行PCR特异性扩增。反应体系为25 μL,除引物外其余各组分与其ITS区段通用引物扩增的体系相同。扩增程序为:94℃预变性5 min;进入循环,94℃变性 45 s,55℃退火 75 s (CgInt/ITS4)或64℃退火60 s (CaInt2/ITS4),72℃延伸 1 min,30 个循环;72℃延伸 10 min,4℃保存。反应结束后,取 5 μL 扩增产物,用 1.5%琼脂糖凝胶电泳检测,并在凝胶成像系统中分析特异性产物片段的大小。
1.4枯草芽胞杆菌菌株CGMCC 1.354抑菌物质的分离与抑菌特性
1.4.1枯草芽胞杆菌菌株CGMCC 1.354抑菌物质的发酵与提取
将枯草芽胞杆菌菌株CGMCC 1.354接种到牛肉膏蛋白胨液体培养基中,30℃、120 r/min振荡培养36 h,8 000 r/min离心20 min,取上清液,重复离心2次,用0.22 μm的微孔滤膜过滤除菌获得无菌滤液。将无菌滤液涂布在LB培养平板上,检测有无活菌体。用3倍体积95%乙醇沉淀上清,4℃静止过夜。8 000 r/min离心20 min收集沉淀,用75%乙醇洗涤沉淀,并溶于1 mol/L NaCl溶液中。再用95%乙醇抽提2次后溶解于1 mol/L NaCl溶液中。采用HP20大孔树脂提取抑菌物质。将预处理好的树脂用玻璃棒引流装柱,并使柱中无气泡,用玻璃棒引流粗提液至柱中,静置吸附2 h,用蒸馏水洗去杂质后用40%乙醇洗脱,并收集洗脱液。洗脱液经旋转蒸发浓缩至1/5体积,再真空冷冻干燥获得抑菌物质,编为BAL-1,备用。
1.4.2BAL-1对炭疽病菌的抑制作用
采用菌落直径法,将冻干后的抑菌物质BAL-1配制成1.0 g/L溶液分别稀释至1、1.25、1.67和2.5倍,然后按1∶3与冷却至50℃左右的PSA培养基混合制成平板,抗菌活性物终浓度分别为0.25、0.192、0.15和0.1 g/L,冷却后取直径8 mm的炭疽病菌菌饼置入平板中央,以蒸馏水代替抑菌物质的PSA培养平板作对照,设3次重复,28℃培养5 d后,检测各处理菌落增长直径,计算抗菌活性,并在光学显微镜下观察菌丝形态。
1.4.3BAL-1的初步鉴定
脂类的鉴定采用苏丹Ⅲ染色法[9],称取苏丹Ⅲ干粉0.1 g加入10 mL 95%乙醇过滤后再加入10 mL甘油,制成苏丹Ⅲ染液。加1滴1%(W/V)的抑菌物质BAL-1在载玻片上,加入2~3滴苏丹Ⅲ染液,染色2 min后在显微镜高倍镜下观察液滴中是否有橘黄色颗粒出现,若有,则含有脂类物质。蛋白质鉴定采用双缩脲法[10],在试管中加入1.0 g/L的抑菌物质5 mL,0.1 g/mL NaOH 1 mL,振荡均匀后加入0.01 g/mL CuSO4溶液2~3滴,放置10 min后观察试管中是否有紫红色产物出现,若有则含蛋白质。糖类物质鉴定采用菲林试剂法[11],在试管中加入1.0 g/L的抑菌物质BAL-1 20 mL,加6 mol/L的HCl 10 mL,沸水浴回流水解6 h,冷却后加入菲林试剂并放入盛有50~65℃水浴2 min,观察结果,若试管中出现砖红色沉淀,则含有糖类。
1.4.4温度、pH和金属离子对BAL-1的抗菌活性的影响
温度对BAL-1抗菌活性的影响:将1.0 g/L的抑菌物质装入6个无菌50 mL三角瓶中,分别置于20、40、60、80、100、121℃下处理30 min,然后按1∶3与冷却至50℃ 左右的PSA培养基混合制成平板,冷却凝固后,接种直径8.0 mm的炭疽病菌菌饼于平板中央,以加蒸馏水代替抑菌物质的平板作对照,计算抗菌活性。
pH对BAL-1抗菌活性的影响:将1.0 g/L的抑菌物质调节pH至3.0、5.0、7.0、9.0、11.0后置4℃下静置8 h,再将其pH调回7.0,然后按1∶3与冷却至50℃左右PDA培养基混合制成平板,冷却凝固后,接种直径8.0 mm的炭疽病菌菌饼于平板中央,以加蒸馏水代替抑菌物质的平板作对照,计算抗菌活性。
金属离子对BAL-1抗菌活性的影响:将灭菌干燥后的NaCl(Na+)、MgCl2(Mg2+)、KCl (K+)、CaCl2(Ca2+)、ZnCl2(Zn2+)和FeCl3(Fe3+)分别溶解于1.0 g/L的抑菌物质溶液中,至金属离子浓度为0.05 mol/L。然后按1∶3与冷却至50℃左右 PDA培养基混合制成平板,金属离子终浓度为0.012 5 mol/L。冷却凝固后,接种直径8.0 mm的炭疽病菌菌饼于平板中央,以加蒸馏水代替抑菌物质的平板作对照,计算抗菌活性。
2 结果与分析
2.1柑橘炭疽病菌的分离鉴定
将从柑橘茎、叶、果实炭疽病病斑处分离到的供试菌株接种至健康柑橘嫩叶的带伤表皮上,室温下保湿4 d,接种后柑橘嫩叶出现了与炭疽病相似的病斑,重新分离获得了与供试菌株形态相同的菌落,因而证实了供试菌株对柑橘的致病性,并将该菌株编号为spb1。spb1菌株在PSA培养基上生长较快,7 d可长满直径90 mm的培养皿。菌落圆形,气生菌丝呈白色,绒状,茂密,后期菌丝颜色逐渐变深呈灰褐色,培养皿背面呈黑褐色(图1a);分生孢子黏孢团呈灰褐色,刚毛少,直立,分生孢子梗短小,基部淡褐色,有分枝,梗无隔膜;分生孢子无色,单胞,圆柱形,顶端钝,基部稍尖,(12~18)μm×(4~6)μm;(图1b);附着胞扁球形,褐色,大小(6~15)μm×(4~9)μm。这些形态特征与陆家云[12]和王震等[13]描述的盘长孢状刺盘孢(C.gloeosporioides)的形态特征吻合。
用引物ITS1和ITS4对病原真菌rDNA的ITS区段PCR扩增,获得长约为600 bp的DNA片段,序列经过Clustal X比较排列后,提交到GenBank 中,获得序列登录号为KP036394。登陆NCBI(http:∥www.ncbi. nlm.nih.gov/),将该序列与核酸数据库BLAST比对,显示该病原真菌与GenBank中已登录的盘长孢状刺盘孢(C.gloeosporioides) 序列的同源性均在 99%以上。利用MEGA4.1 软件的NJ(neighbor-joining)聚类分析法,构建了该病原菌株与王震等[13]报道的同源性在99%以上10个柑橘炭疽病菌(其在GenBank序列登录号分别为:GU108948、GU108949、GU108950、GU108951、GU108952、GU108953、GU108954、GU108955、GU108956 和GU108957)和3 个柑橘花后落果病菌(C.acutatum) 菌株(序列登录号:AF090853、FJ972610、GU059863)的系统发育树(图2),结果表明,spb1菌株与已报道的上述10株柑橘炭疽病菌以100%的相似度聚类在一起,而3个柑橘花后落果病菌则以较远的亲缘关系处于系统发育树的外围。ITS 区段的特异性引物检测结果表明,C.gloeosporioides的特异性引物CgInt/ITS4能从spb1菌株的基因组 DNA中扩增出约为500 bp的特异性条带, 而用尖刺盘孢(C.acutatum)特异性引物CaInt2/ITS4未能扩增出相应的 DNA 条带(图3)。综合以上证据,表明本研究的病原真菌spb1菌株属于盘长孢状刺盘孢(Colletotrichumgloeosporioides)。
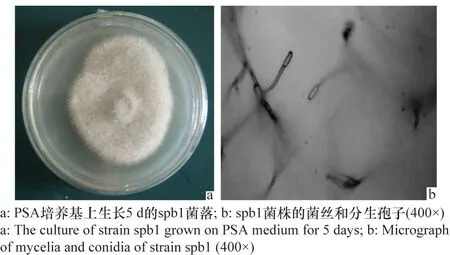
图1 柑橘炭疽病菌spb1菌株的菌落和分生孢子形态Fig.1 Colonies and conidia of strain spb1 causing citrus anthracnose
2.2平板对峙检测
平板对峙试验表明,枯草芽胞杆菌CGMCC 1.354对柑橘炭疽病菌spb1菌株具有明显的拮抗作用。该细菌除了产生明显的抑菌带外,对病菌菌落生长有明显的抑制作用,表现在菌落边缘和抑菌带接触部位的菌丝生长缓慢,而正常生长的菌落铺展平板呈圆形扩展。镜检发现受抑制的病菌菌丝顶端、中部等部位膨大呈泡状, 部分前端膨胀泡破裂、消解,内含物外溢,菌丝因枯草芽胞杆菌的致畸作用而停止生长(图4)。观察发现炭疽病菌的孢子虽能萌发,但萌发产生的芽管粗短、扭曲、畸形,不能进一步生长为菌丝体。
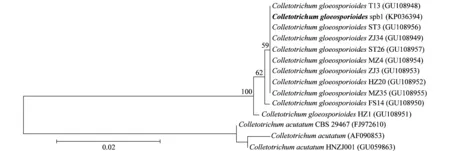
图2 NJ法构建的基于菌株spb1(KP036394)和柑橘其他刺盘孢ITS序列的系统发育树Fig.2 The phylogenetic dendrogram of the strain spb1 (KP036394) and other strains of Collectotrichum spp. constructed by using neighbor-joining (NJ) method based on the ITS sequences
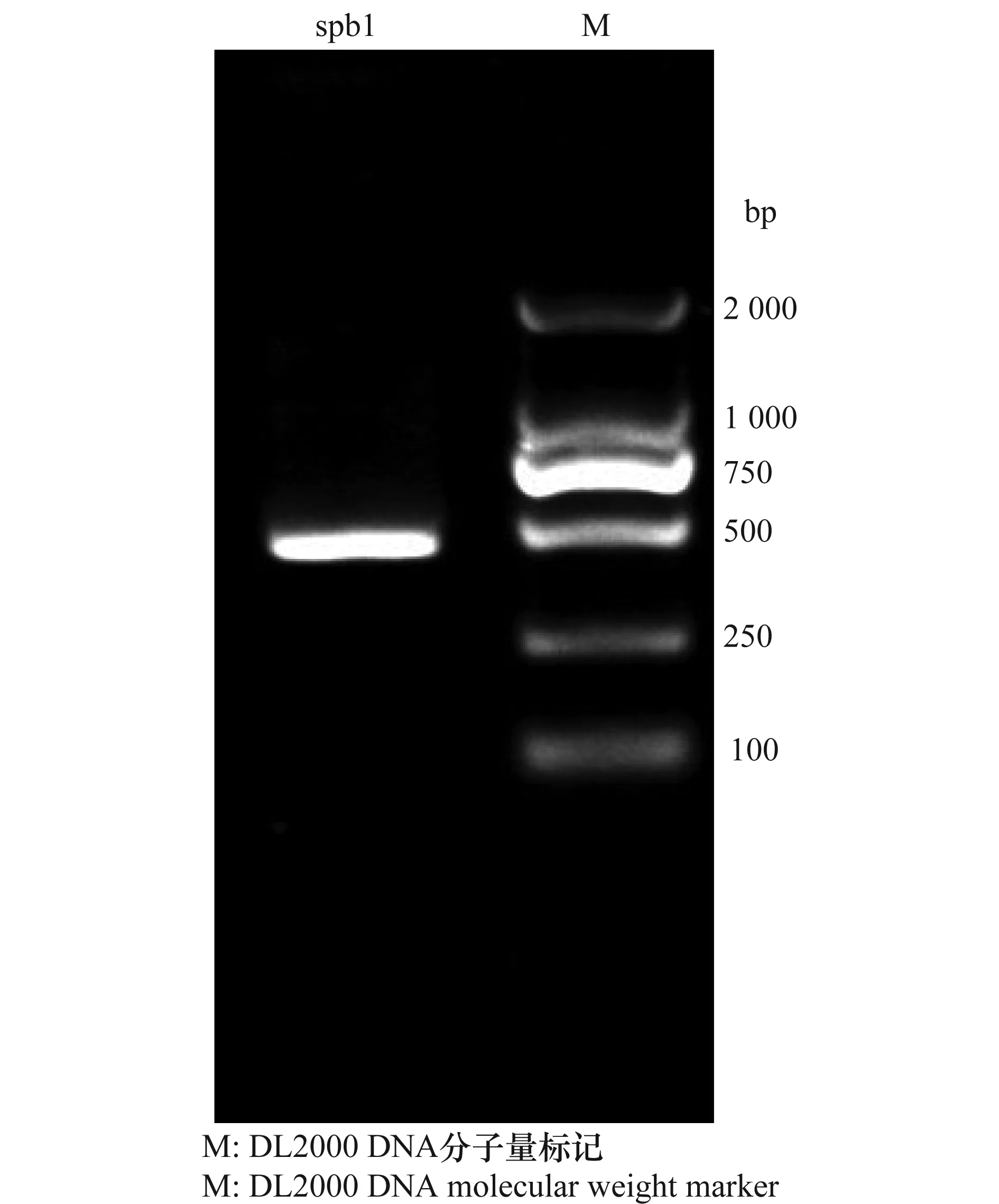
图3 特异性引物CgInt/ITS4对spb1菌株的PCR扩增Fig.3 PCR amplification results of strain spb1 using specific primer pair of CgInt/ITS4
2.3抑菌物质BAL-1的初步鉴定与抑菌性能
2.3.1抑菌物质BAL-1的鉴定
200~400 nm紫外扫描(图5)显示抑菌物质BAL-1在220 nm左右和270 nm左右有较大的吸收峰,表明BAL-1可能含蛋白类物质。双缩脲反应呈紫色,进一步证实BAL-1中含有蛋白质类物质。斐林试剂法有砖红色的沉淀生成,证明该抑菌水解物含还原糖类。苏丹Ⅲ染色未发现橘黄色颗粒出现,初步判断该BAL-1无脂类物质。
2.3.2温度、pH和金属离子对BAL-1的抗菌活性的影响
抑菌物质BAL-1浓度对柑橘炭疽病菌spb1菌丝生长的影响见表1。由表1可知,同一BAL-1浓度下,炭疽病菌菌丝的生长直径数值波动较小,数值稳定,具有统计分析意义。在5个BAL-1梯度浓度处理下,当BAL-1浓度低于0.15 g/L时,抗菌活性差异不显著,BAL-1浓度为0.192和0.25 g/L时的抗菌活性有明显差异,且当BAL-1浓度达0.25 g/L时,抗菌活性最高(71.96%)。总体看来,BAL-1对柑橘炭疽病菌spb1菌丝生长有较强的抑制作用,且随BAL-1浓度的增大抑制作用增强。
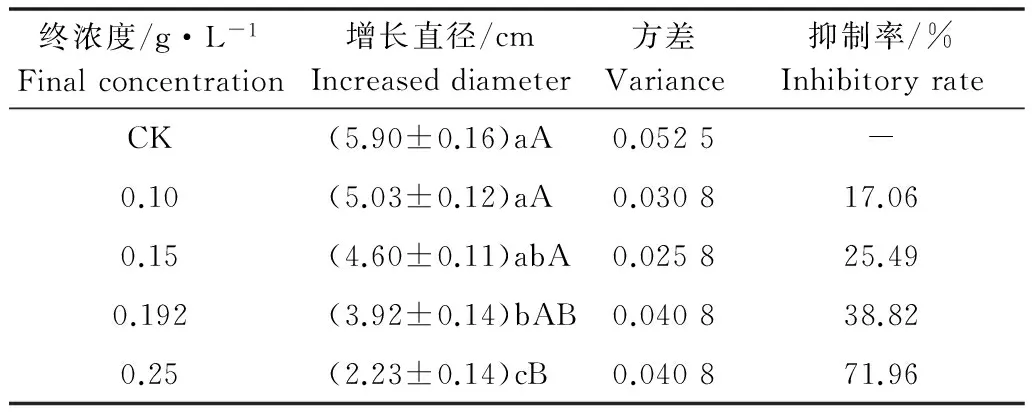
表1 BAL-1浓度对抗菌活性的影响1)Table 1 Effects of BAL-1 concentration on antagonistic activity
1) 表中“增长直径”数据为平均值±标准误,数据后标有不同小写字母表示经多重比较后差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
Data of increased diameter are mean±SE; different lowercase and uppercase letters indicate significant difference at the 0.05 level and extremely significant difference at the 0.01 level, by multiple range test.

图4 柑橘炭疽病菌的菌落、菌丝和孢子形态Fig.4 Colonies, mycelia and conidia of Collectotrichum gloeosporioides spb1
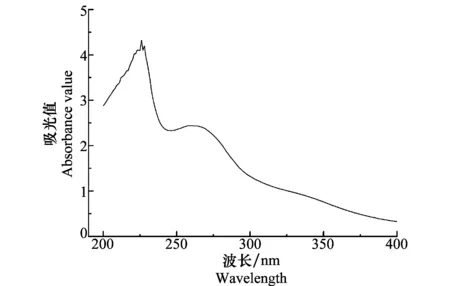
图5 BAL-1在200~400 nm下的吸光值Fig.5 200-400 nm light absorption value of BAL-1
从图6可知,在经60℃以下温度处理30 min后,BAL-1对柑橘炭疽病菌spb1菌丝生长的抑制作用随温度的升高而增强,当温度达到60℃时,抗菌活性达到峰值(86.3%),其后随温度的进一步升高抗菌活性显著下降,当温度达到121℃时,几乎丧失抗菌活性。这可能是由于BAL-1含有多糖骨架,因而具备一定高温耐受性,即在60℃以下都具有良好的抗菌活性;同时因其BAL-1中含有蛋白,过高温度使蛋白质变性而导致BAL-1活性丧失。温度对BAL-1抗菌活性的影响进一步验证了BAL-1中含有糖蛋白。类似情况常见于温度对枯草芽胞杆菌所产抗菌蛋白活性影响的研究中[14-15]。
BAL-1在pH为7.0时抗菌活性最强(89.8%),酸性或者碱性条件都不利于其对柑橘炭疽病菌(C.gloeosporioides)spb1的抑制作用,在pH低于6或者高于8时,BAL-1对柑橘炭疽病菌的抑制作用都显著下降至65%以下,当pH低于5或者高于9时几乎丧失抗菌活性。由此表明:在偏酸和偏碱条件下,BAL-1易变性失活。这可能是由于BAL-1中的蛋白在较高浓度的H+或OH-条件下空间结构发生变化而失去对柑橘炭疽病菌spb1抗菌活性。在抗菌蛋白类的研究中已有类似报道[15-17]。
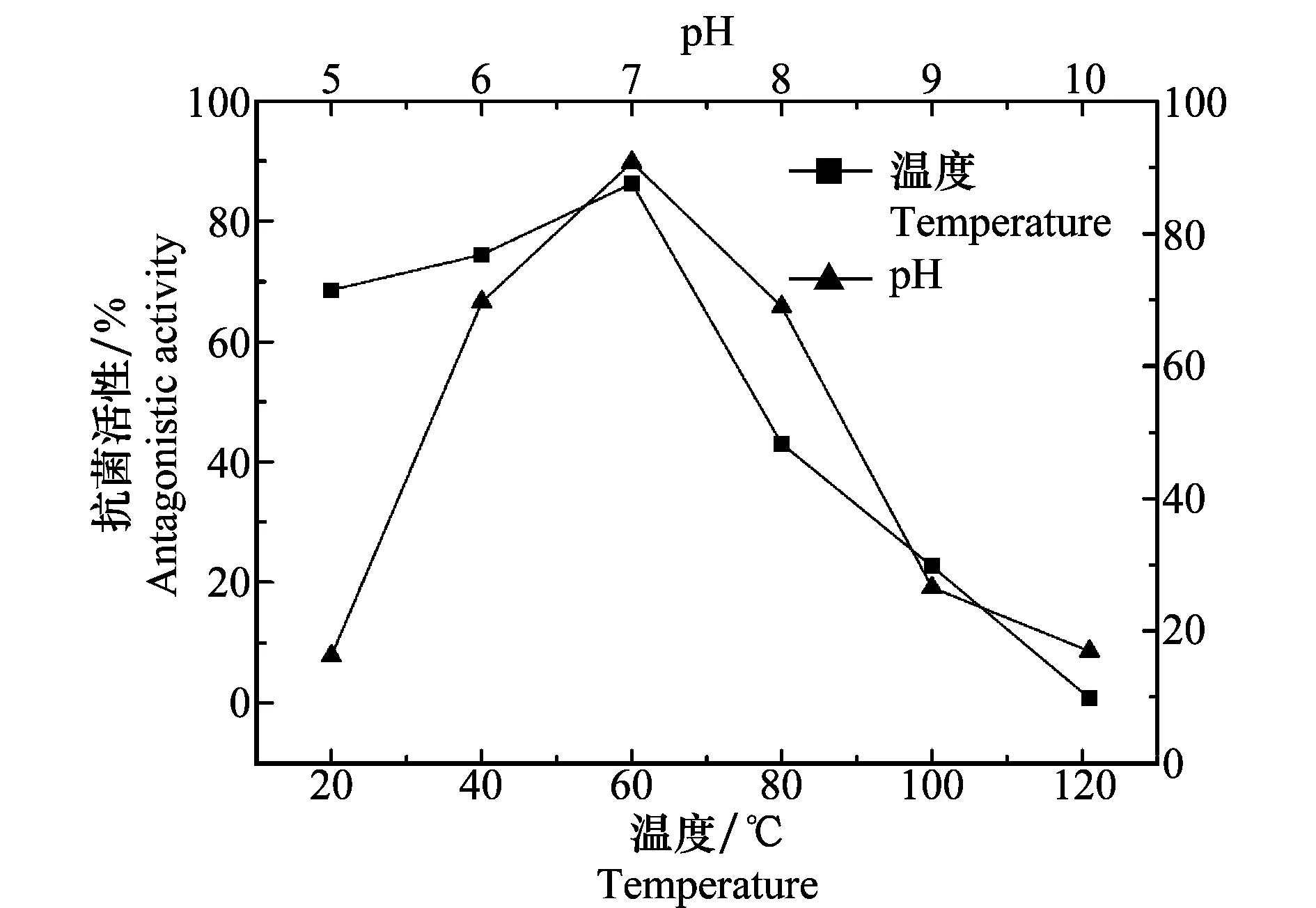
图6 温度和pH对BAL-1抗菌活性的影响Fig.6 Effects of temperature and pH on the antagonistic activity of BAL-1
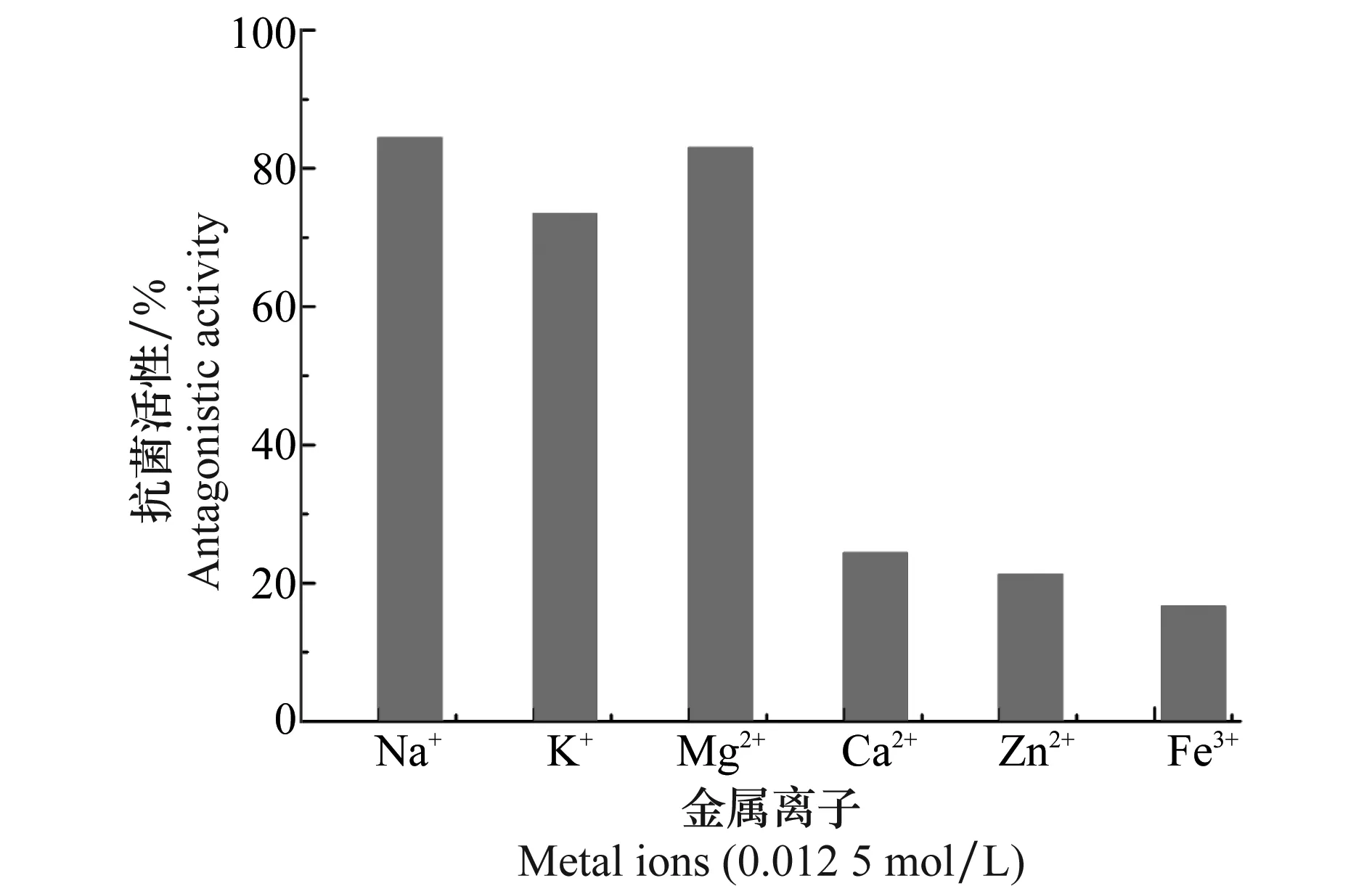
图7 金属离子对BAL-1抗菌活性的影响Fig.7 Effects of metal ions on the antagonistic activity of BAL-1
金属离子对BAL-1抗菌活性的影响如图7所示。Na+和Mg2+能提高BAL-1对柑橘炭疽病菌spb1的抑制作用,K+对该BAL-1活性影响不明显。而Ca2+、Zn2+、Fe3+的存在会降低BAL-1对柑橘炭疽病菌spb1抑制作用。因此在生防过程中可适当地增加钠盐和镁盐来提高菌剂对柑橘炭疽病菌的防控能力。
3 讨论
湖南麻阳苗族自治县的柑橘炭疽病是由病原菌盘长孢状刺盘孢(C.gloeosporioides)所引起的,病原菌通过菌丝生长和孢子萌发产生的芽管侵入寄主导致发病。枯草芽胞杆菌CGMCC 1.354已广泛应用于微生物肥料和养殖水体净化[6]。本研究首次发现该菌对柑橘炭疽病菌(C.gloeosporioides)的生长具有较强的抑制作用,其分泌的抑菌物质能抑制病原菌C.gloeosporioides菌丝生长和孢子萌发,并使部分孢子萌发畸形,可减弱C.gloeosporioides对柑橘的侵染能力, 起到较好的防控作用。枯草芽胞杆菌CGMCC 1.354的抗菌粗提物经鉴定含有糖蛋白,其抗菌活性在pH为7.0时最高;温度在60℃以下时,均具有良好的抗菌活性,但过高的温度易使其抗菌活性降低甚至失活;Na+和Mg2+可以明显增强其抗菌活性,而Ca2+、Zn2+和Fe3+会抑制抑菌物质的活性。因此枯草芽胞杆菌CGMCC 1.354不仅可应用于微生物肥料还能通过添加一定浓度的钠盐和镁盐来提高菌剂对柑橘炭疽病菌的防控能力,且抑菌物质在pH 6~8范围内均具良好的抗菌活性并对高温具较好的耐受能力,不需低温保存,便于储存和运输,具潜在的开发价值和应用前景。但如果要应用于生产实践, 还需进一步的活体试验和深入研究,分析该枯草芽胞杆菌在柑橘植株上的生存能力,观察该菌株对柑橘植株的影响和活体条件下对柑橘炭疽病菌的抗菌效果,才能保证其防效。
[1]黄黎,张蓉.全县柑橘总产量预计达30万吨[EB/OL].(2010-11-12)[2014-11-11].http:∥www.mayang.gov.cn/Item/11625.aspx.
[2]彭埃天, 陈玉托, 宋晓兵, 等. 德庆贡柑炭疽病的发生与防治初探[J]. 广东农业科学, 2008(2): 58-60.
[3]Lee S, Hong J C, Jeon W B, et al. The salicylic acid-induced protection of non-climacteric unripe pepper fruit againstColletotrichumgloeosporioidesis similar to the resistance of ripe fruit [J]. Plant Cell Reports, 2009, 28(10): 1573-1580.
[4]Saiz-Urra L, Bustillo-Perez A J, Cruz-Monteagudo M, et al. Global antifungal profile optimization of chlorophenyl derivatives againstBotrytiscinereaandColletotrichumgloeosporioides[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4838-4843.
[5]陈丽锋, 邓伯勋, 闵晓芳, 等. 柑橘黑色蒂腐病菌的分离鉴定及生物学特性[J]. 植物保护, 2007, 33(6): 48-51.
[6]曹凤明, 沈德龙, 李俊, 等. 应用多重PCR鉴定微生物肥料常用芽胞杆菌[J]. 微生物学报, 2008, 48(5): 651-656.
[7]龙珑, 宋水林, 李霖, 等. 江西峡江椪柑果梗炭疽病病原鉴定[J]. 中国果树, 2012(3): 55-57.
[8]李小俊, 成丽霞, 吴彦彬, 等. 拮抗菌抗菌谱及发酵液拮抗能力测定的新方法[J]. 生物技术, 2007, 17(1): 55-58.
[9]宋安东, 冯冲, 王风芹, 等. 生物油脂高产菌株筛选方法研究[J]. 微生物学通报, 2009, 36(3): 383-388.
[10]刘邻渭, 陶健, 毕磊. 双缩脲法测定荞麦蛋白质[J]. 食品科学, 2004, 25(10): 258-261.
[11]赵光华, 马红芳, 田山林. 费林试剂法测定香菇等食用菌中总糖含量研究[J]. 饲料博览, 2010(11): 39-41.
[12]陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2001: 454-459.
[13]王震, 杨媚, 杨迎青, 等. 广东省柑橘炭疽病病原菌的形态与分子鉴定[J]. 菌物学报,2010, 29(4): 488-493.
[14]Senol M, Nadaroglu H, Dikbas N, et al. Purification of chitinase enzymes fromBacillussubtilisbacteria TV-125, investigation of kinetic properties and antifungal activity againstFusariumculmorum[J]. Annals of Clinical Microbiology and Antimicrobials, 2014, 13: 35.
[15]刘世会, 赵德刚. 温度、pH对杜仲抗真菌蛋白抗菌活性的影响[J]. 山地农业生物学报, 2008, 27(4): 330-334.
[16]胡新文, 郭建春, 郑学勤. 抗真菌蛋白Rs-AFPs生物学特性的研究[J]. 热带作物学报, 1998, 19(2): 36-42.
[17]宋永燕, 李平, 郑爱萍, 等. 生防细菌LM-3的鉴定及其抗菌蛋白的研究[J]. 四川大学学报(自然科学版), 2006, 43(5): 1110-1115.
(责任编辑:田喆)
Biological characteristics of citrus pathogenColletotrichumgloeosporioidesand the inhibitory effect ofBacillussubtilison the fungus
Zou Juan,Yao Zhuo,Shang Yonghua
(Key Laboratory of Research and Utilization of Ethnomedicinal Plant Resources of Hunan Province,Department of Life Sciences, Huaihua University, Huaihua418000, China)
Anthracnose on citrus has occurred in Mayang Miao Autonomous County, Hunan Province in the recent five years. The pathogen causing citrus anthracnose was isolated from citrus orchards of Mayang Miao Autonomous County. Based on cultural and morphological characteristics, ribosomal DNA (rDNA) internal transcribed spacer (ITS) sequence analysis and phylogenetic relationships with other species ofColletotrichum, the pathogen was identified asColletotrichumgloeosporioides.BacillussubtilisCGMCC 1.354 showed strong antagonistic activity against the pathogen, and the antifungal substance produced byB.subtilisCGMCC 1.354 strongly inhibited the hyphal growth and spore germination ofC.gloeosporioides.
citrus anthracnose;Colletotrichumgloeosporioides;Bacillussubtilis;antagonistic activity
2014-11-25
2015-02-02
湖南省重点学科建设项目(201142);怀化学院科研项目(HHUY2014-03);湖南省教育厅科研项目(11C0988)
E-mail:zoujuantone@163.com
S 436.661.14
A
10.3969/j.issn.0529-1542.2016.01.011

