钆类造影剂的研究进展
段二月 马建功 程 鹏
(南开大学化学学院,天津300071)
·今日化学·
钆类造影剂的研究进展
段二月马建功程鹏*
(南开大学化学学院,天津300071)
从钆螯合物造影剂的原理、条件、研究进展、以及提高其弛豫效率的方法4个方面进行介绍与总结;在研究进展方面,着重介绍了荧光、生物敏感造影剂;并且从酶活性、金属离子活性、pH活性3个方面对生物敏感造影剂进行了论述。
钆造影剂;原理;弛豫效率;生物活性;荧光探针
1973年,Lauterbur[1]和Mansfield发明了磁共振成像技术(Magnetic Resonance Imaging,简称MRI),并获得了诺贝尔生物医学奖。磁共振成像技术可以对内部组织进行检测,是一种非入侵性的成像方式,由于其图像分辨率高,对人体组织尤其是软组织有很高的对比度,并且对人体不会造成损害,已经在世界各地的医院进行应用[2]。
磁共振成像技术主要原理在于利用原子核的磁共振效应。在外加磁场下,原子核会由低能级激发到高能级,然后回到初始状态,而原子核由高能级回到低能级的过程叫做弛豫,弛豫分为纵向弛豫和横向弛豫。纵向弛豫从0恢复到最大值的63%的时间为t1,称为纵向弛豫时间,纵向弛豫也叫做自旋-晶格驰豫,如图1A所示;宏观横向弛豫从最大值衰减到最大值的37%的时间为t2,如图1B所示,称为横向弛豫时间,横向弛豫也叫做自旋-自旋驰豫。而弛豫速率则是t1或者t2的倒数,单位为s-1[3]。
在人体中存在大量的水以及有机物,所以氢核的共振信号要比其他元素高,因此在进行检测时一般是测质子的磁共振现象。MRI图像的明暗程度与核磁信号强度有很大的关系,信号强度越大,图像越明亮;反之,则越暗。一般来说t1越短,共振信号越强,图像越亮;t2越短,共振信号越弱,图像越暗。MRI图像的分辨率主要与组织内水的含量有关,根据体内的水与组织中水的含量不同,不同器官组织显示不同的图像,因此可以通过磁共振技术,检查出病变组织。
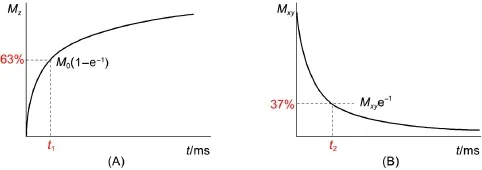
图1 t1(A)和t2(B)的示意图
但是人体内有部分组织器官与病变组织之间水分子的含量相差不多,需要较长的测试时间,但是成像效果并不好,不能有效地进行检测。经过一段时间的发展,研究者发现,加入某种顺磁物质后,不仅图像的清晰度增加,而且成像时间也明显缩短。人们把这类可以缩短成像时间、提高成像对比度的成像增强对比剂,叫做造影剂。它主要通过改变体内局部组织中水质子的弛豫速率,提高正常组织与患病部位的成像对比度,从而显示体内器官的功能状态。造影剂的研究发展极大地促进了磁共振技术的应用。
造影剂进入人体后,t1和t2都会发生改变,但是不同造影剂的作用效果不同,某些造影剂主要缩短t2,使病变部分变暗,这类称为t2造影剂,也叫做阴性造影剂,包括铁磁性和超磁性造影剂。同理,主要缩短t1,使病变部分变亮的造影剂称为t1造影剂,也叫做阳性造影剂,顺磁性物质都属于t1造影剂。t1造影剂的对比效果更明显,主要包括钆类造影剂、锰类造影剂、富勒烯类造影剂等。本文主要对Gd类造影剂进行介绍。
在磁造影方面,Gd类造影剂的研究发展最为迅速,有着重要的地位。Gd(III)最外层有7个未成对电子,与其他元素相比,孤电子数目最多,电子的诱导作用最强,因此弛豫时间较长,有较大的优势。因此钆元素是人们研究最多的元素,目前在临床应用的造影剂也大都是钆的造影剂。
1 钆螯合物造影剂的作用原理
钆螯合物作为典型的造影剂,主要是用来缩短t1值,因为在不加造影剂的情况下,某些正常组织的t1与病变组织的t1相差不大,图像分辨率不够,不能进行诊断。如胰的t1值为140-170,胰腺瘤的t1值为275-400;肾的t1值为300-340,肾癌的t1值为400-450[2]。造影剂的加入可以缩短t1值,增强正常组织与病变组织之间的差异,提高图像的分辨率。钆造影剂本身不会产生信号,通过改变周围水分子的弛豫时间来达到造影效果。
所观察到的纵向弛豫速率(1/t1,obs)由两部分组成,即抗磁磁化率(1/t1,d,是在没有顺磁性物质时的纵向弛豫速率)和顺磁磁化率(1/t1,p,是由顺磁性物质产生的磁化速率),如式(1)所示[3]。

在溶液中,以弛豫速率为纵坐标对造影剂浓度作图,其斜率即为造影剂的弛豫效率,观察到的弛豫效率与顺磁性物质的浓度成正比,如式(2)所示,弛豫效率是评价造影剂性能的主要参数之一。影响顺磁性物质弛豫效率r1的因素主要是内配层(IS)水分子(通过氧原子直接与金属配位)弛豫效率,外配层(SS)水分子(通过氢键与金属键连)弛豫效率,以及外层(OS)水分子(只有金属发生扩散作用,没有化学变化)弛豫效率,见式(3)。式(4)中q表示内配位水分子数,[CA]表示顺磁性造影剂的浓度,t1M表示与金属直接配位的水分子的纵向弛豫时间,τm是与金属相连的水分子的停留时间(滞留时间)[3,4]。

但是在多数情况下,t1M远远大于τm,所以式(4)也可以写成式(6),在场强大于0.25 T时,标量耦合的影响也会变得很小,可以忽略,则式(5)可以简写成式(7),同时在磁场强度大于1.5 T时,t1e的贡献也可以忽略,所以式(8)可以简写成式(9)。其中表示标量耦合驰豫时间,表示偶极-偶极驰豫时间,ωL表示的是质子的拉莫尔频率(42.58 MHz·T-1),τc1是核运动快慢的特征相关时间,t1e表示的是电子自旋弛豫时间,τR表示的是分子旋转相关时间[3-5]。

2 钆螯合物应具备的特征
2.1弛豫效率高
为了能更好地提高显像效果,要求所用的钆类造影剂可以提高病变部分被测核的弛豫效率。弛豫效率是钆造影剂合成并应用的一个重要指标。影响弛豫效率的因素有很多,外在因素包括温度和螯合物的浓度等,内在因素如螯合物的结构特点等都会对弛豫效率产生影响,其中水分子的交换速率、内配位水分子数和旋转相关时间是主要的影响因素。因此在保证化合物结构稳定的前提下,降低水分子的交换速率、增加内配位水分子数以及增大旋转相关时间是提高弛豫效率的重要方法,在下文中将会进行比较详细的介绍[6]。
2.2在体内稳定、低毒
造影剂需要作用于人体内,因此首要条件必须保证其安全性。Gd(III)最外层有7个未成对电子,具有较长的电子弛豫时间,但是游离的Gd(III)具有很高的毒性,可以取代生物体内很多肽链和生物酶上的Ca(II)离子,从而抑制它们的功能,因此游离的Gd(III)不能单独做造影剂。为了降低其毒性,将游离Gd(III)与螯合剂(主要是二乙基三胺五乙酸(DTPA)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)及两者的衍生物)反应形成稳定的螯合物,这些螯合物在人体内不易解离,毒性降低。Gd-DTPA与Gd-DOTA的结构分别如图2A和图2B所示。
造影剂进入人体后,人体内的金属离子尤其是锌离子,会取代少量Gd(III)与配体结合,使Gd(III)成为游离态,因此这些造影剂不仅要具有热力学稳定性,还要具有动力学稳定性,其中Gd-DOTA的动力学稳定性相对较高[7]。
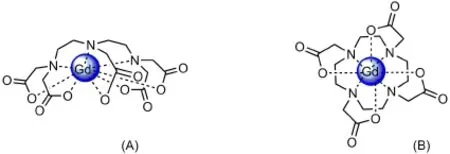
图2 Gd-DTPA(A)和Gd-DOTA(B)的结构示意图
2.3具有靶向性
造影剂进入人体后会改变周围质子的弛豫效率,使信号增强。理想的造影剂进入人体后能够选择性分布,主要集中在病变组织,使靶组织的被测核的弛豫效率显著增强,增强显像效果。
然而目前临床造影剂大都不具有专一性,造影技术主要用在脑、肾和血液的检查方面,对肝胆的选择性很低。因此可以向钆造影剂引入疏水基团,如苯基或者脂类物质,这样可以增强其亲脂性,从而提高肝脏成像效果[8]。
另外,可以使造影剂与靶向细胞表面的物质进行特异性结合。例如某些病变细胞在其表面有大量的单糖唾液酸残基,它的多少与病变组织的恶化程度有很大关系,目前对单糖唾液酸残基的检查是通过切片观察,这种方法有一定的局限性。根据硼酸与单糖唾液酸残基上的醇能够特异性结合的特点,Djanashvili等[9]设计了一种可以识别单糖唾液酸残基病变细胞的结构,该结构将Tb-DTPA-双胺与硼酸结合在一起,可以与单糖唾液酸残基的醇进行特异性结合,从而达到检查的目的。
2.4易排出体外
造影剂的毒性与其排出体外的速率有关,在人体内存在一定的时间达到检测要求后,要易于排出体外,否则在人体内累积,时间久了就会使人中毒。
而通过改变配合物的结构则可以使其通过不同的途径排出体外。例如:一些亲水性的小分子螯合物一般由肾脏排出;亲脂性高的螯合物大部分通过肝胆排出体外;既有亲水性又有亲脂性的螯合物则由肾、肝、胆选择性排出。
2.5水溶性好
造影剂以静脉注射为主要的给药方式,因此要求其有较好的水溶性。造影剂的水溶性应该在0.5 mol·L-1(人体血浆的渗透压和粘度的近似值)左右。
3 影响弛豫效率的因素及提高弛豫效率的方法
理论上,在磁场强度为0.5 T时,只含有一个内配水的Gd(III)螯合物的弛豫效率大约为100 L·mmol-1·s-1,但是目前临床应用的钆造影剂弛豫效率仅在5 L·mmol-1·s-1左右,因此有很大的可提升空间。
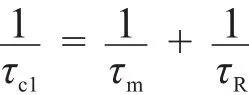
3.1旋转相关时间
影响弛豫效率的最关键因素是旋转相关时间,即τR。在溶剂中相对分子质量较大的物质的τR较长,而小分子Gd(III)螯合物的τR在100 ps左右,要远远低于理想值[10]。因此,现在的研究热点就是如何增大造影剂的相对分子质量,大多是将钆的螯合物与大分子(例如蛋白质、糖类以及脂类等)结合以增大相对分子质量。
用人体的血清蛋白(HSA)修饰Gd-DTPA的衍生物MS-325(图3A),其弛豫效率从6.84 L·mmol-1·s-1增大至15.2 L·mmol-1·s-1,弛豫效率大大增加[11]。此外,Chang等[12]设计了一种造影剂Bz-CB-TTDA(图3B),虽然此化合物对HSA的亲和性没有MS-325强,但是在20 MHz的条件下,Bz-CB-TTDA的弛豫效率为66.7 L·mmol-1·s-1,而MS-325为47 L·mmol-1·s-1,弛豫效率明显提高。

图3 MS-325(A)和Bz-CB-TTDA(B)的结构示意图
需要注意的是,在增加τR的时候,要尽可能不使水的交换速率降低,水交换速率太慢,也会影响弛豫效率,因此相对分子质量要适中。
3.2配位水的滞留时间
影响弛豫效率的第二个因素是配位水的滞留时间τm,也可以称作配位水分子的交换速率的倒数(kex)。由于在人体内,质子的交换时间是由水分子的交换时间决定的,因此水的滞留时间决定了质子的弛豫时间。
t1值的一个主要影响因素是配位水分子数,在一定程度上,如果配位水与周围游离水的交换速率越快,弛豫效率也就越高,获得图像的分辨率也会相应增强。但是如果水的交换速率过快,配位水与Gd(III)之间的反应时间不足,则难以使弛豫效果达到最好;同样,如果水的滞留时间过长,当弛豫结束后,水依然与钆(III)结合,则使弛豫效率降低。所以水的滞留时间也要适中。水的解离速度是影响水交换速率的一个关键因素,而其解离需要很高的活化势能。因此,如果可以减弱Gd(III)和水的氧原子之间的键能,则可以增加水的交换速率。同时,也要考虑τR的影响,综合以上因素,在临床磁强度(1-3 T)时,造影剂最佳的τm应该为10-20 ns[13,14]。
3.3内层配位水分子数
影响弛豫效率的第三个因素是与Gd(III)直接配位的水分子数,即q。内配位水分子数与弛豫效率之间呈线性关系,可以显著提高t1值,内配位水分子数量越多,弛豫效率就越高。目前临床应用的钆螯合物都为Gd-DTPA和Gd-DOTA及其衍生物,q值均为1[15]。如果q值越大,Gd(III)与螯合剂之间的配位数就会相对减少,这样就导致螯合物的稳定性降低,增大了其毒性。因此一定要在保证化合物稳定的前提下,增加内配位水分子数。在此基础上,Livramento等[16]和Aime等[17]设计合成了一些含有较多内配位水分子数、稳定性较高并且弛豫效率较好的配合物。
4 钆的螯合物造影剂的研究进展
MRI技术开始在医学上使用后,造影剂也开始慢慢地发展起来。最早研究的造影剂是EDTA的配合物,对Fe(III)、Mn(II)、Co(II)、Ni(II)等顺磁性金属的EDTA的配合物进行了研究。随着对影响弛豫效率因素的探索,钆(III)以其优势吸引了很多研究者,对钆螯合物的合成与研究也成为热点。
4.1小分子钆螯合物
1983年,Gd-DTPA最先应用于临床研究,随后钆的一系列螯合物也开始应用,主要是Gd-DTPA和Gd-DOTA的衍生物。研究者对Gd-DTPA进行修饰,合成了很多的Gd-DTPA的衍生物,如Omniscan、Primovist、MultiHance、OptiMARK等(表1),这些也用于临床研究。Gd-DOTA具有很高的稳定性,因此在人体内能够稳定存在,其衍生物ProHance、Gadovist氨基等也已经在临床上开始使用[18-23](表2)。
由表1和表2可知,目前用于临床的钆小分子造影剂弛豫效率在3.5-5.5 L·mmol-1·s-1之间,弛豫效率比较低,因此还有很大的改善空间。在上文中我们已经知道弛豫效率与旋转相关时间有关,而分子体积的增大可以有效地增大旋转相关时间,因此用大分子对Gd-DTPA和Gd-DOTA进行修饰以提高弛豫效率,在这方面也取得了较大的进展。

表1 临床应用的Gd-DTPA类造影剂的商用名称、配体结构、相对分子质量和弛豫效率

表2 临床应用的Gd-DOTA类造影剂的商用名称、配体结构、相对分子质量和弛豫效率
4.2大分子钆螯合物
小分子造影剂渗透压偏高,弛豫效率较低,因此人们开始用一些大的基团对小分子造影剂进行修饰。近年来对t1类造影剂的研究主要集中在对Gd-DTPA和Gd-DOTA这两种物质的修饰上。将其与单克隆抗体、血红细胞、血清白蛋白、多糖、激素和聚氨基酸等天然大分子材料及人工合成的生物可相容高分子相结合,可以有效地增大体积,降低分子的旋转速率,提高弛豫效率。同时由于大分子本身的特点,向大分子中引入对人体某一组织器官具有亲和性的基团,还能增强选择性或靶向性。
在这方面研究最早的是单克隆抗体[24],但是由于其不稳定性,并且进入人体中会引起一些免疫反应等因素限制了它的应用。此后人们开始对一些天然分子材料进行研究。Sun等[25]和Aime等[26]分别将HSA(人体血清蛋白)与Gd-DTPA和Gd-DOTA相连接,得到了高弛豫效率的造影剂。脂质体可以提高造影剂在病变部位的浓度,并且可以有效地实现药物释放,将二酞胺四乙酸单豆蔻酸乙酯、依地二酞胺四乙酸双豆蔻酸乙酯以及DTPA的衍生物与脂质体连接,可以使弛豫效率大大提高[27-29]。另外,以糖类作为载体的造影剂,其研究主要集中在葡萄糖上[30,31]。
但是大分子在人体内代谢较慢,在临床上的应用上也具有局限性,人们开始研究在人体内可降解的大分子造影剂。如将二硫键合单元、聚乳酸等可生物降解组分引入大分子钆配合物中,此类造影剂以大分子的形式进入体内,在脉管系统和肿瘤组织处形成很好的造影效果之后,在体内可较快、较容易地分解为小分子并快速排出体外[32,33]。
聚乳糖可以分解为H2O和CO2,利用这一特点,Zhang等[34]将聚乳酸引入Gd-DTPA的衍生物中,所形成的造影剂弛豫效率为7.9 L·mmol-1·s-1。由于大分子体内的生物降解过程极其复杂,此类造影剂在临床上的应用还有待深入研究。
4.3双功能造影剂
近年来,一些新型的造影剂相继被合成,双功能造影剂的合成及研究逐渐成为热点。
4.3.1荧光造影剂
荧光探针是生物学上一种微量的检测方法,可将荧光活性基团引入钆造影剂中,制备含有荧光探针的造影剂。
例如,对姜黄素修饰的Gd-DTPA进行荧光检测不仅可以选择性地识别β-淀粉样蛋白斑(阿尔茨海默氏病的标志物之一),而且在磁场强度为1.4 T、温度为37°C时,在pH为7.4的缓冲溶液中,其弛豫效率高达13.63 L·mmol-1·s-1,远远高于Gd-DTPA的弛豫效率。上述配合物在检测神经系统疾病方面具有较好的优势,但是在合适的浓度范围内,该配合物无法穿越血脑障碍,限制了其在临床上的应用。
Jang等[35]设计了一类造影剂(图4),在没有Cu(II)的存在时,在Gd(III)浓度为0.2 mmol·L-1时,弛豫效率为2.01 L·mmol-1·s-1,随着Cu(II)的加入,由于配位水分子数增多,弛豫效率逐渐增大,当Cu(II)的浓度为Gd(III)的2倍时,弛豫效率增大至4.01 L·mmol-1·s-1(这比现有的铜造影剂要大得多)。这可能是因为加入的Cu(II)与羧基氧结合,使Gd(III)可以与游离的水分子结合,增加了q,弛豫效率增大。此外,实验证明,人体内其他离子如Ca(II)、Na(I)、K(I)、Zn(II)对其弛豫效率没有影响。在荧光性能测试中,由图5可以看出Zn(II)的加入没有改变其荧光强度,而随着Cu(II)的加入荧光强度逐渐减弱,也进一步证实了Cu(II)会与羧基氧配位。

图4 Jang等[35]设计的造影剂结构示意图

图5 不同Cu(II)、Zn(II)浓度下的t1加权成像和荧光成像情况[35]
在加入一些发光基团的基础上,现在很多研究者也致力于加入一些金属离子。2010年,Song等[36]将锌卟啉化合物与Gd-DO3A结合在一起,合成了一类造影剂。由于锌卟啉的存在,在近红外区出现了激发波长,同时弛豫效率也显著增大,在A、B、C 3个化合物中每个Gd(III)的弛豫效率分别为4.2 L·mmol-1·s-1、10.5 L·mmol-1·s-1、12.8 L·mmol-1·s-1,即3个造影剂的弛豫效率分别为4.2 L·mmol-1·s-1、42 L·mmol-1·s-1、102.4 L·mmol-1·s-1。其结构如图6所示。

图6 锌卟啉结合Gd-DO3A造影剂的结构示意图[36]
在图7所示的结构中,TiGd3金属配合物在380 nm的激发波长下,在400-750 nm处有一个宽的发射光谱,并且在490 nm处发射强度最强,由于τR的增大,弛豫效率有所增加,每个Gd(III)的弛豫效率为12.3 L·mmol-1·s-1,整个化合物的弛豫效率达到了36.9 L·mmol-1·s-1[37]。EuGd3金属配合物也表现出了弛豫性能和荧光性能,在615 nm处有一个比较尖锐的峰,在磁场强度为0.47 T、温度为37°C时,弛豫效率达到了28.8 L·mmol-1·s-1[38]。RuGd3在525-850 nm处有一个宽的发射光谱,并且在610 nm处发射强度最强。在0.47 T和37°C时,其弛豫效率为36 L·mmol-1·s-1[39]。
4.3.2具有生物活性的钆造影剂
人体内的一些生化过程发生改变时,可能会引起一些疾病。基于此,很多可以对生化条件作出反应的造影剂开始被设计与合成,即存在某种刺激的时候,造影剂的弛豫效率就会显著增强。这类造影剂可以对多种刺激作出反应,例如离子浓度、酶活性、温度以及pH等,并且可以通过不同的机理进行激活。
首例该类造影剂是酶活性造影剂。Meade等[40-43]是研究这一工作的先驱,报道了第一例该类型的造影剂Egad。随后为研究结构对弛豫性能的影响,陆续合成了一系列该类造影剂(图8),在钆螯合物和葡萄糖的不同连接处多了一个甲基,但是他们的弛豫效率都比Egad增大40%-50%,并且α-Egad 和β-Egad的弛豫效率也不同,可以看出微小的结构差异对弛豫效率也有很大的影响。
Wang等[44]设计合成了Gd-DOTA-FPG,其结构如图9A所示。在β-半乳糖苷酶的条件下很容易解离,会形成易于和HSA(人体血清蛋白)结合的结构,生成相对分子质量更大的结构(图9B),有效地增加了τR,弛豫效率有很大提高,由7.6 L·mmol-1·s-1增大至15.5 L·mmol-1·s-1。
与Wang课题组类似,Hanaoka等[45]也设计合成了一例β-半乳糖苷酶活性造影剂(图10A),在β-半乳糖苷酶不存在时,其对HSA没有亲和性;反之,随着酶的加入,该配合物去掉β-半乳糖,生成的结构疏水性增强,HSA很容易与其结合(图10B),由于HSA的连入,使弛豫效率由6 L·mmol-1·s-1提高为9.5 L·mmol-1·s-1。在β-半乳糖的存在下,图10A中的化合物很容易解离,解离后的结构能与HSA很快结合,τR、弛豫效率都有所增加。
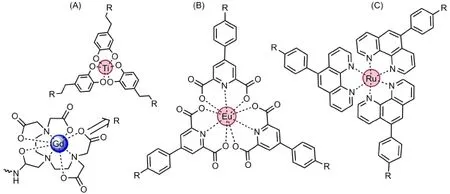
图7 TiGd3(A)、EuGd3(B)和RuGd3(C)金属配合物的结构示意图

图8 Egad(A)、α-Egad(B)和β-Egad(C)的结构示意图

图9 Gd-DOTA-FPG的结构示意图
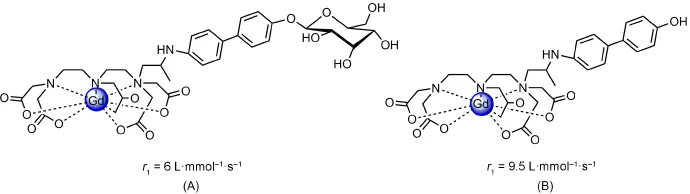
图10 β-半乳糖苷酶活性造影剂
人体内一些离子浓度的改变也能引起疾病,因此通过造影剂检测体内的离子浓度变化是十分必要的,Meade等[46,47]合成了第一例此类型的造影剂Gd-DOPTA(图11A)。该螯合剂是用钙螯合剂1,2-双(2-氨基苯氧基)-乙烷-N,N,Nʹ,Nʹ-四乙酸(BAPTA),将两个Gd-DO3A连接到一起。在没有钙离子时,BAPTA中的羧基氧与Gd(III)结合,无配位水。当Ca(II)浓度增大时,与BAPTA结合,Gd(III)则可以与水结合,如图11B所示,该过程在Ca(II)的生理浓度下就可以完成,Ca(II)的浓度为0.1-10 μmol·L-1(生理相关浓度)时,Ca(II)敏感剂DOPTA-Gd的弛豫效率增大75%。随后,很多Ca(II)活性探针也相继被合成,Peters等[48]设计合成了一种造影剂,该造影剂可以通过金属Ca(II)聚合,增大了τR,弛豫效率也有效地增大。

图11 Gd-DOPTA造影剂结构示意图
近年来,很多Zn(II)活性探针也相继被合成,Meade等[49]也设计合成了一系列Gd-daa-n配合物(图12A)。与钙敏感的Gd-DOPTA类似,在Zn(II)不存在条件下,Zn(II)亲和基团上的羧基氧与Gd(III)结合,阻止了水分子与Gd(III)的配位;而Zn(II)存在时,其弛豫效率的大小与n值有关,Gd(III)可与水分子结合,q增大,弛豫效率由2.5 L·mmol-1·s-1升至7.8 L·mmol-1·s-1。经过研究发现,当n=4或者5的时候弛豫效率较高,当n太小或太大的时候都不利于提高弛豫效率。
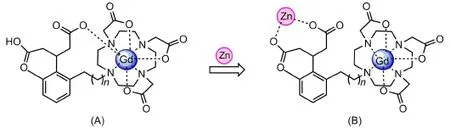
图12 Gd-daa-n配合物结构示意图
Sherry等[50]设计合成的Gd-DOTA-diBPEN(图13),其中两个吡啶甲基胺与Zn(II)有很密切的联系。在没有Zn(II)的条件下,Gd-DOTA-diBPEN不能与HAS相结合,但是在Zn(II)存在的条件下,可以很容易与HAS相结合,有效增大了τR,弛豫效率也相应地由原来的5.0 L·mmol-1·s-1增大至17.4 L·mmol-1·s-1,弛豫效率增大了150%以上。另外该螯合剂能与Zn(II)快速结合,在检测人体内锌离子的浓度变化方面有很大的潜力。
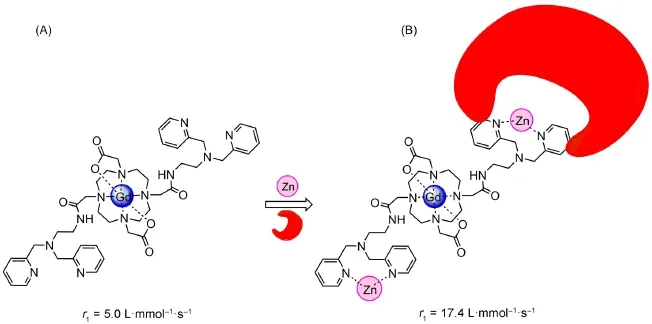
图13 Gd-DOTA-diBPEN结构示意图
此外,铜离子[51-53]和铁离子[54-56]活性造影剂也陆续被合成,其中CG2、CG3和CG7对铜离子具有很高的活性,对人体内的其他离子无影响。
pH活性造影剂最典型的是基于多聚鸟氨酸的配合物,该造影剂包含114个鸟氨酸,其中有30个与Gd(III)-DO3A相连。当pH较小时,鸟氨酸中游离的氨基质子化,整个结构中局部可以转动(图14A);当pH较大的时候,这些游离的氨基去质子化,并且形成分子内氢键,整个结构变成刚性(图14B),τR增大,所以弛豫效率相应地由23 L·mmol-1·s-1增大至32 L·mmol-1·s-1。由此可见,该造影剂的弛豫效率对pH具有依赖性[57]。

图14 基于多聚鸟氨酸的pH活性造影剂
Sherry等[58]用磷酸修饰Gd-DOTA(图15),由于磷酸的质子化会改变水交换的速率,因此当pH从9降至6时,其弛豫效率从3.8 L·mmol-1·s-1迅速增至9.9 L·mmol-1·s-1。其原因可能是磷酸质子化会形成氢键,而这些氢键有利于提高水分子的交换速率,因此弛豫效率大大提高。

图15 磷酸修饰的Gd-DOTA结构示意图
5 结语
钆螯合物的应用发展极大地促进了核磁造影技术的发展,但是目前应用于临床的造影剂弛豫效率并不高,选择性与生物兼容性也有待加强。多功能造影剂的合成为这一研究领域开辟了新的途径,但是由于种种原因还是不能用于临床,因此研制新的理想的造影剂仍是比较热门的研究课题。
[1]Lauterbur,P.C.Nature 1973,242(5394),190.
[2]Caravan,P.Chem.Soc.Rev.2006,35(6),512.
[3]刘东华,李显耀,孙朝晖.大学物理,1997,16(10),36.
[4]Bloembergen,N.;Morgan,L.O.J.Chem.Phys.1961,34(3),842.
[5]Lauffer,R.B.Chem.Rev.1987,87(5),901.
[6]Caravan,P.;Ellison,J.J.;McMurry,T.J.;Lauffe,R.B.Chem.Rev.1999,99(9),2293.
[7]Simone,H.;Klaus,R.Chem.Ber.1999,126(4),869.
[8]Karabulut,N.;Elmas,N.Interv.Radiol.2006,12(1),22.
[9]Djanashvili,K.;Hagen,T.L.M.;Blangé,R.;Schipper,D.;Peters,J.A.;Koning,G.A.Bioorg.Med.Chem.2011,19(3),1123.
[10]Caravan,P.;Farrar,C.T.;Frullano,L.;Uppal,R.Media Mol.Imaging 2009,4(2),89.
[11]Caravan,P.;Cloutier,N.J.;Greenfield,M.T.;McDermid,S.A.;Dunham,S.U.;Bulte,J.W.M.;Amedio,J.C.,Jr.;Looby,R.J.;Supkowski,R.M.;Horrocks,W.D.,Jr.;McMurry,T.J.;Lauffer,R.B.J.Am.Chem.Soc.2002,124(12),3152.
[12]Chang,Y.H.;Chen,C.Y.;Singh,G.;Chen,H.Y.;Liu,G.C.;Goan,Y.G.;Aime,S.Inorg.Chem.2011,50(4),1275.
[13]Sherry,A.D.;Wu,Y.Chem.Biol.2013,17(2),167.
[14]Aime,S.;Barge,A.;Botta,M.;de Sousa,A.S.;Parker,D.J.Am.Chem.Soc.1998,37(19),2673.
[15]Helm,L.;Merbach,A.E.Chem.Rev.2005,105(6),1923.
[16]Livramento,J.B.;Helm,L.;Sour,A.;Neil,C.O.;Merbach,A.E.;Toth,E.Dalton Trans.2008,9(9),1195.
[17]Briley-Saebo,K.C.;Geninatti-Crich,S.;Cormode,D.P.;Barazza,A.;Mulder,W.J.M.;Chen,W.;Giovenzana,G.B.;Fisher,E.A.;Aime,S.;Fayad,Z.A.J.Phys.Chem.B 2009,113(18),6283.
[18]Hernandez,G.;Tweedle,M.F.;Brynt,R.G.Inorg.Chem.1990,29(25),5109.
[19]Kabalka,G.W.;Davis,M.A.;Holmberg,E.;Maruyama,K.;Huang,A.L.Magn.Reson.Imaging 1991,9(3),373.
[20]Sherry,A.D.;Cacheris,W.P.;Kuan,K.T.Magn.Reson.Med.1988,8(2),180.
[21]Disehino,D.D.;Delaney,E.J.;Emswiler,J.E.;Gaughan,G.T.;Prasad,J.S.;Srivastava,S.K.Inorg.Chem.1991,30(6),1265.
[22]Aime,S.;Anelli,P.L.;Botta,M.;Fedeli,F.;Grandi,M.;Paoli,P.Inorg.Chem.1992,31(12),2422.
[23]Turoski,P.N.;Rodger,S.J.;Searrow,R.C.;Raymond,K.N.Inorg.Chem.1988,27(3),474.
[24]Hnatowieh,D.J.;Layne,W.W.;Childs,R.L.;Lanteigne,D.;Davis,M.;Griffin,T.;Doherty,P.Science 1983,220(4597),613.
[25]Sun,M.Y.;Wang,Z.H.;CarPenter,P.M.;Lao,X.;Muhler,A.;Nalcioglu,O.J.Magn.Reson.Imag.1999,9(2),177.
[26]Aime,S.;Botta,M.;Crieh,S.G.;Giovenzana,G.B.;Pagliarin,R.;Piccinini,M.;Sisti,M.;Terreno,E.Biol.Inorg.Chem.1997,2(4),470.
[27]徐月红,徐莲英.中国药学杂志,2002,37(8),569.
[28]Kabalka,G.W.;Davis,M.A.;Moss,T.H.;Buonocor,E.;Hubne,K.;Holmbe,E.;Maruyam,K.;Huang,A.L.Magn.Reson.Medicine 1991,19(2),406.
[29]Kim,S.K.;Pohost,G.M.;Elgavish,G.A.Magn.Reson.Medicine 1991,22(1),57.
[30]Sun,G.Y.;Feng,J.H.;Jing,F.Y.;Pei,F.K.;Liu,M.L.J.Magn.Magn.Mater.2003,265(2),123.
[31]Rongved,P.;Klaveness,J.Carbohyd.Res.1991,214(2),315.
[32]Lu,Z.R.;Wang,X.;Parker,D.L.;Goodrich,K.C.;Buswell,H.R.Bioconjugate Chem.2003,14(4),715.
[33]Lu,Z.R.;Wu,X.M.Isr.J.Chem.2010,50(2),220.
[34]Zhang,G.D.;Zhang,R.;Wen,X.X.;Li,L.;Li,C.Biomacromolecules 2008,9(1),36.
[35]Jang,J.H.;Bhuniya,S.;Kang,J.;Yeom,A.;Hong,K.S.;Kim,J.S.Org.Lett.2013,15(18),4702.
[36]Song,Y.;Zong,H.;Trivedi,E.R.;Vesper,B.J.;Waters,E.A.;Barrett,A.G.M.;Radosevich,J.A.;Hoffman,B.M.;Meade,T.G. Bioconjugate Chem.2010,21(12),2267.
[37]Dehaen,G.;Eliseeva,S.V.;Kimpe,K.;Laurent,S.;Elst,L.V.;Muller,R.N.;Dehaen,W.;Binnemans,K.;Parac-Vogt,T.N.Chem.Eur. J.2012,18(1),293.
[38]Boulay,A.;Laine,S.;Leygue,N.;Benoist,E.;Laurent,S.;Elst,L.V.;Muller,R.N.;Mestre-Voegtle B.;Picard,C.Tetrahedron Lett. 2013,54(39),5395.
[39]Dehaen,G.;Eliseeva,S.V.;Verwilst,P.;Laurent,S.;Elst,L.V.;Muller,R.N.;Muller,R.N.;Borggraeve,W.D.;Binnemans,K.;Parac-Vogt,T.N.Inorg.Chem.2012,51(16),8775.
[40]Moats,R.A.;Fraser,S.E.;Meade,T.J.Angew.Chem.Int.Edit.1997,36(7),726.
[41]Louie,A.Y.;Huber,M.M.;Ahrens,E.T.;Rothbächer,U.;Moats,R.;Jacobs,R.E.;Fraser,S.E;Meade,T.J.Nat.Biotechnol.2000,18 (3),321.
[42]Urbanczyk-Pearson,L.M.;Femia,F.J.;Smith,J.;Parigi,G.;Duimstra,J.A.;Eckermann,A.L.;Luchinat,C.;Meade,T.J.Inorg.Chem. 2008,47(1),56.
[43]Urbanczyk-Pearson,L.M.;Meade,T.J.Nat.Protoc.2008,3(3),341.
[44]Chang,Y.T.;Cheng,C.M.;Su,Y.Z.;Lee,W.T.;Hsu,J.S.;Liu,G.C.;Cheng,T.L.;Wang,Y.M.Bioconjugate Chem.2007,18(6),1716.
[45]Hanaoka,K.;Kikuchi,K.;Terai,T.;Komatsu,T.;Nagano,T.Chem.Eur.J.2008,14(3),987.
[46]Li,W.H.;Fraser,S.E.;Meade,T.J.J.Am.Chem.Soc.1999,121(6),1413.
[47]Li,W.H.;Parigi,G.;Fragai,M.;Luchinat,C.;Meade,T.J.Inorg.Chem.2002,41(15),4018.
[48]Kubícek,V.;Vitha,T.;Kotek,J.;Hermann,P.;Elst,L.V.;Muller,R.N.;Lukes,I.;Peters,J.A.Contrast Media Mol.Imaging 2010,5 (5),294.
[49]Matosziuk,L.M.;Leibowitz,J.H.;Heffern,M.C.;MacRenaris,K.W.;Ratner,M.A.;Meade,T.J.Inorg.Chem.2013,52(21),12250.
[50]Esqueda,A.C.;Lopez,J.A.;Andreu-de-Riquer,G.;Alvarado-Monzon,J.C.;Ratnakar,J.;Lubag,A.J.M.;Sherry,A.D.;Leon-Rodriguez,L.M.D.J.Am.Chem.Soc.2009,131(32),11387.
[51]Que,E.L.;Chang,C.J.Chem.Soc.Rev.2010,39(1),51.
[52]Que,E.L.;Gianolio,E.;Baker,S.L.;Wong,A.P.;Aime,A.M.;Chang,C.J.J.Am.Chem.Soc.2009,131(24),8527.
[53]Que,E.L.;Gianolio,E.;Baker,S.L.;Aime,S.;Chang,C.J.Dalton Trans.2010,39(2),469.
[54]Livramento,J.B.;Toth,E.;Sour,A.;Borel,A.;Merbach,A.E.;Ruloff,R.Angew.Chem.Int.Edit.2005,44(10),1480.
[55]Parac-Vogt,T.N.;Elst,L.V.;Kimpe,K.;Laurent,S.;Burte'a,C.;Chen,F.;Deun,P.V.;Ni,Y.;Muller,R.N.;Binnemans,K.Contrast Media Mol.Imaging 2006,1(6),267.
[56]Paris,J.;Gameiro,C.;Humblet,V.;Mohapatra,P.K.;Jacques,V.;Desreux,J.F.Inorg.Chem.2006,45(13),5092.
[57]Aime,S.;Botta,M.;Criche,S.G.;Giovenzana,G.;Palmisano,G.;Sisti,M.Chem.Commun.1999,16,1577.
[58]Zhang,S.;Wu,K.;Sherry,A.D.Angew.Chem.Int.Edit.1999,38(21),3192.
Advances in Gadolinium(lll)Chelates as MRl Contrast Agents
DUAN Er-YueMAJian-GongCHENG Peng*
(College of Chemistry,Nankai Univeisity,Tianjin 300071,P.R.China)
In this paper,the Gd(III)-based contrast agents are reviewed from four aspects as followed:principles,conditions,research progresses and approaches for improving relaxivity.The research progresses in the fields of fluorescent and biological contrast agents are deeply introduced.Moreover,the activity of enzyme,pH and metal ions of biological contrast agents are discussed.
Gd(III)-based contrast agents;Principles;Relaxivity;Biological activity;Fluorescent sensor
O614.33;G64
10.3866/PKU.DXHX201512007
,Email:pcheng@nankai.edu.cn
国家基础科学人才培养基金(J1103306)

