青海牦牛源贾第虫的鉴定及分子特征分析
王光华,李秀萍,王戈平,蔡其刚,马利青
(青海省畜牧兽医科学院,青海西宁 810016)
青海牦牛源贾第虫的鉴定及分子特征分析
王光华,李秀萍,王戈平,蔡其刚,马利青*
(青海省畜牧兽医科学院,青海西宁 810016)
从青海省祁连县采集93份牦牛粪样用于贾第虫检测。所有样品经蔗糖密度梯度离心法纯化处理后,采用卢戈氏碘液染色镜检和免疫荧光试验进行检测,将镜检阳性样品采用套式PCR方法扩增18 S rRNA,并对扩增产物进行测序分析。结果镜检和免疫荧光试验中有9份样品为贾第虫阳性,阳性率为9.7%。镜检阳性样品采用套式PCR方法扩增后有8份样品为18 S rRNA基因阳性,产物长度292 bp,测序后的序列分别命名为QHQL201501~QHQL201508。系统发育分析显示,分离的虫株属于牛源十二指肠贾第虫,基因型均为反刍动物特有的聚集体E,未发现具有人兽共患潜力的A型和B型。
牦牛;贾第鞭毛虫;18 S rRNA;套式PCR
十二指肠贾第鞭毛虫(Giardiaduodenalis)简称贾第虫,是一种呈全球性分布的寄生性肠道原虫,主要寄生在人和某些哺乳动物的小肠,引起以腹泻和消化不良为主要症状的贾第虫病(Giardiasis),当人或动物摄入被贾第虫污染的饮水和食物时就会感染该病原[1]。目前,贾第虫病已被列为全世界危害人类健康的10种主要寄生虫病之一[2]。贾第虫的基因型根据分子遗传学和表型不同可分为8个主要的聚集体(A~H),每个聚集体都有不同的宿主范围,集聚体A和B主要感染人和其他哺乳动物,即属于人畜共患型;其他集聚体是宿主专一性的,集聚体C和D主要感染犬和犬科动物;集聚体E主要感染牛、羊等偶蹄动物;集聚体F、G、H分别感染猫、鼠和海豹[3-4]。
随着分子生物学技术的发展,PCR和荧光定量PCR技术已广泛应用于贾第虫的分子流行病学调查。目前,贾第虫的检测和基因分型技术主要通过分析小亚基核糖体RNA(ssu-rRNA)、β贾第素(bg)、谷氨酸脱氢酶(gdh)、延伸因子-1α(ef-1α)、磷酸丙糖异构酶(tpi)及滋养体表面抗原基因进行分析[5]。
本研究从青海省海北藏族自治州祁连县牦牛养殖牧场随机采集了93份新鲜牦牛粪样,采用蔗糖密度梯度离心法纯化后,分别采用卢戈氏碘液染色法和免疫荧光抗体试验进行显微镜检测,镜检阳性样品用基于18 S rRNA基因的套式PCR方法扩增并测序分析,鉴定分离虫株的基因型,为今后该地区牦牛源贾第虫病的防控和研究提供参考。
1 材料与方法
1.1材料
1.1.1粪样采集2014年9月,以青海省祁连县某养殖户为调查对象,清晨采集牦牛新鲜粪样共计93份,分别编号为QHQL201401~QHQL201493,按等比例分别加入25 g/L的重铬酸钾溶液后存放于4℃冰箱。
1.1.2主要试剂与仪器粪样DNA提取试剂盒、GoTaqDNA聚合酶预混液等,自凯杰公司产品;DNA标准DL 2 000、PCR产物纯化试剂盒、胶回收试剂盒、琼脂糖等,宝生物工程(大连)有限公司产品;贾第虫荧光素标记单克隆抗体试剂盒,Cellabs公司产品;胰蛋白胨、酵母提取物,OXOID公司产品;其他化学试剂如氯化钠、氢氧化钠和碘液等均为国产分析纯。
1.2方法
1.2.1形态学鉴定将采集的牦牛粪样按照文献[6]的方法,每份粪样经蔗糖密度梯度离心法纯化后,取适量样品涂于载玻片上并用卢戈氏碘液染色法染色,盖上盖玻片之后用显微镜观察贾第虫包囊存在情况。
1.2.2免疫荧光试验(IFT)将纯化后的93份样品,每份样品取30 μL分别滴加到不同的载玻片上,干燥后滴加20 μL贾第虫单克隆荧光抗体,使其均匀的覆盖样品,将所有样品置于湿盒中,37℃孵育30 min;之后用磷酸盐缓冲液(0.01 mol/L,pH 7.4)冲洗2次,样品上滴加20 μL甘油,用盖玻片覆盖后立即用荧光显微镜观察。
1.2.3样品DNA的提取取镜检阳性样品500 μL,按照粪样DNA提取试剂盒(Qiagen Stool Mini Kit)的说明书提取贾第虫基因组DNA。将获得的DNA溶于80 μL灭菌水中,置-20℃保存备用。
1.2.418 S rRNA基因的套式PCR扩增参照文献[7]的引物和方法对卢戈氏碘液染色镜检和IFT检测均为阳性的样品进行基于18 S rRNA基因的套式PCR扩增。第1轮PCR反应体系为:12.5 μL GoTaqDNA聚合酶预混液,上、下游引物各1 μL(10 μmol/L),模板DNA 3 μL,加灭菌水至25 μL;反应条件为:95℃ 4 min;95℃ 45 s,58℃ 45 s,72℃ 1 min,共35个循环;之后72℃ 7 min。上游引物Gia2029,5′-AAGTGTGGTGCAGACGGACTC-3′,下游引物Gia2150c 5′-CTGCTGCCGT CCTTGGATGT-3′;第2轮PCR体系中模板为第1轮PCR反应产物2 μL,其余试剂与首轮体系一致。第2轮反应条件为:95℃ 4 min;95℃ 30 s,62℃ 30 s,72℃ 30 s,共35个循环;之后72℃ 7 min。第2轮反应中上游引物为RH115′-CATC CGGTCGATCCTGCC-3′,下游引物为RH4 5′-AGTCGAACCCTGATTCTCCGCCAGG-3′,扩增基因片段长度约为292 bp。PCR产物电泳后回收并纯化,送上海生工生物工程技术服务有限公司进行测序。
1.2.5系统发育分析将PCR扩增获得的产物测序后与从GenBank下载的贾第虫参考序列(表1)比对,并用DNA Star软件中的MegAlign分析序列之间的同源性。采用Mega5.2软件计算各序列间的遗传距离,构建系统发育树(邻近法)。
2 结果
2.1形态学鉴定结果
分别将93份牦牛粪样用卢戈氏碘液染色后,在400倍普通光学显微镜下观察,在9份样品中发现存在椭圆形包囊结构,大小约为7.5 μm~9 μm×10 μm~14 μm,从形态结构上可初步判定为贾第虫包囊(图1)。
2.2免疫荧光试验结果
将样品分别与贾第虫荧光抗体反应后,用荧光显微镜观察,共有9份样品中发现了具有荧光的椭圆形包囊(图2),大小约为7.5 μm~9 μm×10 μm~14 μm,判定为贾第虫阳性。该结果与卢戈氏碘液染色法镜检的结果一致。
2.3套式PCR扩增结果
将镜检阳性的9份样品采用基于贾第虫18 S rRNA的套式PCR方法进行扩增,共有8份样品扩增出了大小约为292 bp的条带,与预期结果一致(图3)。

图1 卢戈氏碘液染色的牦牛贾第虫包囊(400×)
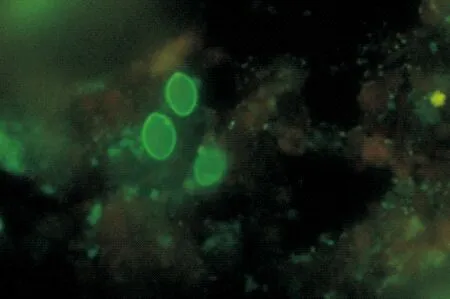
图2 免疫荧光抗体法检测牦牛贾第虫包囊(400×)
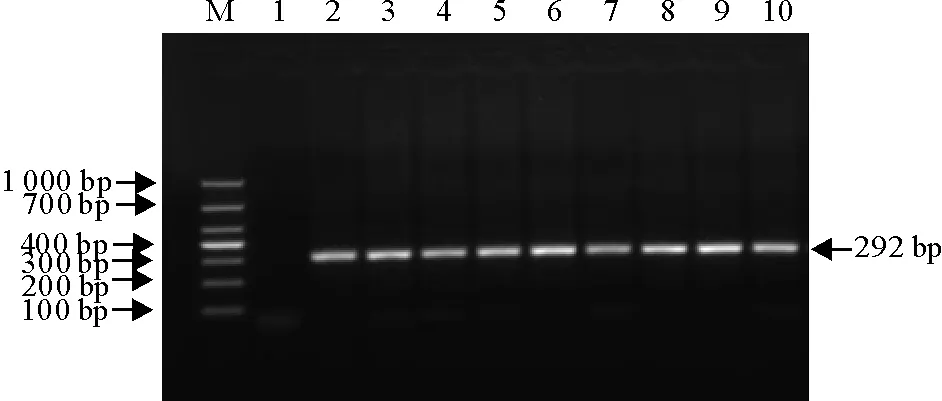
M. DNA标准DL1 000;1. 阴性对照;2. 阳性对照;3~10. 粪样PCR产物
M. DNA Marker DL1 000; 1. Negative control; 2. Positive control; 3-10. PCR products of fecal samples
图318 S rRNA基因PCR扩增结果
Fig.3PCR results of 18 S rRNA gene
2.4系统发育分析结果
将测序结果与GenBank中下载的相关序列用DNA Star7.0软件进行多序列比对,用MEGA5.2软件构建系统发育树,从系统发育树中可以看出本次检测出的牦牛源贾第虫为十二指肠贾第虫(Giardiaduodenalis),根据参考序列进一步分析表明其基因型为E型(表1、图4和图5)。
3 讨论
本试验分别采用卢戈氏碘液染色镜检、免疫荧光试验(IFT)和套式PCR方法对青海省祁连县牦牛粪样中的贾第虫进行了检测。所有样品经卢戈氏碘液染色镜检和免疫荧光试验镜检后发现9份样品中存在贾第虫包囊,本试验中2种镜检的结果一致,表明这2种方法在贾第虫镜检中都具有重要作用。之后采用套式PCR方法扩增了镜检阳性样品的18 S rRNA基因片段,有8份样品18 S rRNA基因阳性,其中1份样品出现镜检阳性而PCR方法检测阴性的现象,分析可能是由于贾第虫包囊在样品中分布不均匀或样品中存在PCR扩增酶抑制物造成的[8-9],因此,在DNA提取和PCR扩增过程中需提前考虑这些因素,从而避免对试验结果的干扰。
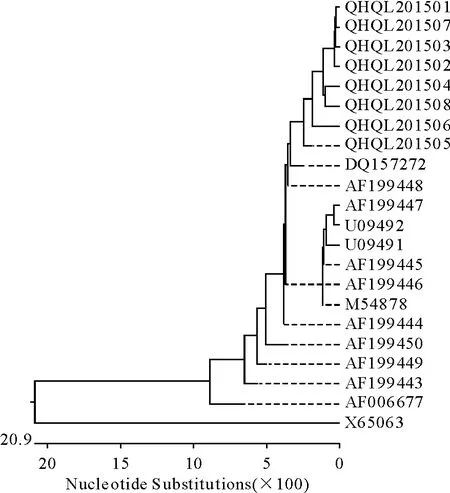
图4 基于18 S rRNA基因的牦牛源贾第虫种类鉴定
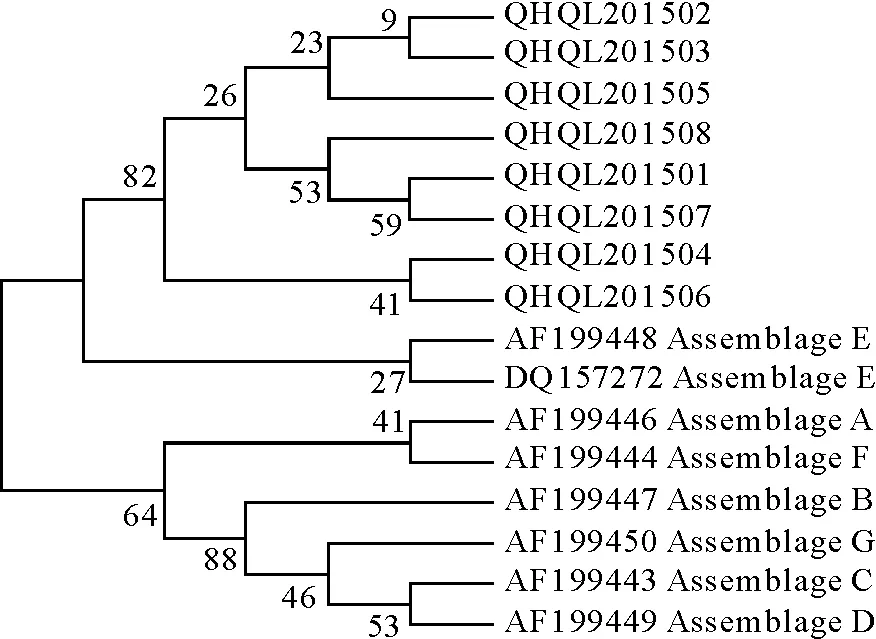
图5 以18 S rRNA基因对牦牛源贾第虫的基因型鉴定
对于贾第虫的分类,20世纪初曾多达50余种,1952年,Filice根据形态学等特征对贾第虫种类进行了评价,将多数种都划归为十二指肠贾第虫,仅保留了少数几个有效种[10]。目前多数研究学者认为贾第虫有6个有效种,其中Giardiaagilis、Giardiaardeae、Giardiamuris、Giardiamicroti和Giardiapsittaci可感染不同种类的动物,而Giardiaduodenalis主要感染人和其他哺乳动物[11]。随着分子生物学的发展,仅凭形态学和宿主种类的分类方法已经不适合贾第虫的分类。基于小亚基核糖体RNA基因、磷酸丙糖异构酶、谷氨酸脱氢酶、延伸因子1-α基因等的核苷酸序列分析,可将来自不同动物的十二指肠贾第虫划分为不同的基因型[12]。本研究通过对青海省祁连县分离的牦牛源贾第虫18 S rRNA基因进行扩增、测序和序列分析,结果表明分离的牦牛源贾第虫为集聚体E型。本结果为进一步研究青海省牛源贾第虫奠定了基础。
[1]张永轻,滕美君,王云华,等.中国人源蓝氏贾第鞭毛虫ppdk基因的克隆及其表达产物的鉴定[J].中国病原生物学杂志,2010,5(11):834-839.
[2]张会宁,于鑫,魏博,等.隐孢子虫和贾第鞭毛虫的危害及其控制技术[J].环境科学与技术,2011,34(12):135-140.
[3]邓明俊,肖西志,孙涛,等.蓝氏贾第鞭毛虫检测技术研究进展[J].动物医学进展,2012,33(12):168-173.
[4]Ye J B,Xiao L H,Wang Y F,et al.Dominance ofGiardiaduodenalisassemblage A andEnterocytozoonbieneusigenotype BEB6 in sheep in Inner Mongolia,China [J].Vet Parasitol,2015,210:235-239.
[5]梁乐,汪世龙,王惠琴.水源性蓝氏贾第鞭毛虫分子生物学检测方法研究进展[J].国际医学寄生虫病杂志,2009,36(2):114-117.
[6]Hamnes I S,Gjerde B,Robertson L,et al.Prevalence ofCryptosporidiumandGiardiain free-ranging wild cervids in Norway [J].Vet Parasitol,2006,141:30-41.
[7]Juan D R,Ruben D H,Carolina H,et al.Molecular diagnosis and genotype analysis ofGiardiaduodenalisin asymptomatic children from a rural area in central Colombia [J].Infect Genet Evol,2015,32:208-213.
[8]顾有方,王立克,李阳,等.安徽省部分地区山羊蓝氏贾第鞭毛虫流行病学调查及基因型分析[J].中国寄生虫与寄生虫病杂志,2014,32(5):401-403.
[9]Ash A,Lymbery A,Lemon J,et al.Molecular epidemiology ofGiardiaduodenalisin an endangered carnivore-The African painted dog[J].Vet Parasitol,2010,174:206-212.
[10]肖淑敏.牛源环孢子虫与贾第虫的分子特征与检测研究[D].广东广州:华南农业大学,2006.
[11]Feng Y Y,Xiao L H.Zoonotic potential and molecular epidemiology ofGiardiaspecies and giardiasis [J].Clin Microbiol Rev,2011,1:110-140.
[12]李结,王培园,张萍,等.犬源贾第虫EF1α基因的克隆及序列分析[J].动物医学进展,2012,33(1):53-56.
Identification and Molecular Characterization of Yak-derivedGiardiaSpecies in Qinghai Province
WANG Guang-hua,LI Xiu-ping,WANG Ge-ping,CAI Qi-gang,MA Li-qing
(Qinghai Academy of Animal Science and Veterinary Medicine,Xining,Qinghai,810016,China)
A total of 93 fecal samples from yak from Qilian county in Qinghai province were screened for the presence ofGiardia.All the samples were detected by microscope and immunofluorescence test (IFT).Then,the microscopy-positive samples were amplified by nested PCR targeting the18S rRNA gene.The results showed nine out of 93 fecal samples were detected asGiardiapositive by microscope and IFT with a positive rate of 9.7%.Eight out of nine microscopy-positive samples were amplified by nPCR targeting the18S rRNA gene and the PCR product is 292 bp.The sequences were named as QHQL201501-QHQL201508 after sequencing.Phylogenetic analysis indicated that these isolated species areGiardiaduodenalis,assemblage E.The zoonostic genotype was not found in the present study.
yaks;Giardia; genotype; 18 S rRNA; nested-PCR
2016-02-26
青海省自然科学基金项目(2013-Z-934Q);外专千人计划(WQ20136300172)
王光华(1978-),男,青海大通人,副研究员,博士,主要从事病原微生物学研究。*通讯作者
S852.722
A
1007-5038(2016)08-0015-04

