钙激活氯通道密度调节Anoctam in 1电流作用的研究
马可,王慧,王清华,雒舒雅,肖庆桓
(中国医科大学药学院离子通道药理研究室,沈阳 110122)
钙激活氯通道密度调节Anoctam in 1电流作用的研究
马可,王慧,王清华,雒舒雅,肖庆桓
(中国医科大学药学院离子通道药理研究室,沈阳 110122)
目的研究钙激活氯通道(CaCCs)密度对CaCCs蛋白—Anoctamin 1(Ano1)电流特性的调节作用,探讨高表达Ano1促进肿瘤发生的机制。方法瞬时转染Ano1质粒到HEK293细胞,高密度CaCCs通过表达Ano1 24 h获得,低密度CaCCs通过表达Ano1 6 h获得。膜片钳方法检测钙离子激活的Ano1的全细胞电流。激活电流曲线以指数曲线拟合。结果Ano1质粒表达6 h的电流密度显著低于表达24 h的电流密度(P<0.05)。在低CaCCs密度时,Ano1的激活电流曲线最适于用单指数拟合,τslow为(292.71±38.11)ms。在高CaCCs密度时,Ano1的激活电流曲线最适于用两指数拟合,τfast为(47.78±4.58)ms;τslow为(385.74± 71.44)ms。高CaCCs密度下的Ano1电流比低CaCCs密度下的Ano1电流多了一个快速激活成分(τfast),而高CaCCs密度与低CaCCs密度比较Ano1的τslow差异没有统计学意义(P>0.05)。结论CaCCs的密度可调节Ano1激活的动力学变化;高表达Ano1可促进CaCCs的激活。
Anoctam in 1;钙激活氯通道;通道密度;激活动力学;肿瘤
钙激活氯通道(calcium-activated chloride channels,CaCCs)Anoctamin 1(Ano1,TNEN16A)是Anoctamin家族10个成员之一,参与上皮细胞分泌、神经及心肌细胞兴奋性、平滑肌收缩、嗅觉和光感传导、疼痛等多种重要生理功能[1]。早在2008年Ano1被确定为钙激活氯离子通道蛋白之前,Ano1也被称为ORAOV2、DOG1、TAOS2和DLJ0261,在食管鳞状上皮癌、胃肠道间质瘤、头颈鳞状细胞癌等多种癌症中高表达[2]。近年来又有研究陆续发现Ano1在乳腺癌[3]、前列腺癌[4]、胰腺导管腺癌[5]、胃癌[6]等肿瘤中也高表达。11q13区段扩增被认为是肿瘤过高表达Ano1的机制[7]。另外,抑制组蛋白去乙酰化酶能降低乳腺癌细胞Ano1表达,表明组蛋白去乙酰化酶通过表观遗传调控方式促进乳腺癌中Ano1的高表达[8]。在ER阴性乳腺癌中,PR阳性的肿瘤中Ano1表达量比在PR阴性的高,表明ER和PR信号通路可能参与调控Ano1在乳腺癌中的表达[3]。
研究报道,在头颈鳞状细胞癌细胞系中,Ano1可以通过激活ERK1/2通路调节其下游clinD1表达水平升高[9];在乳腺癌细胞系中,Ano1可以通过激活表皮生长因子受体通路和钙调蛋白激酶通路促进细胞增殖[10];提示Ano1氯通道可能对促进肿瘤细胞增殖起到重要作用。但是,Ano1过表达导致的过高通道密度是否会调节Ano1电流特性目前尚不清楚。
本研究拟通过瞬时转染Ano1质粒到HEK293细胞,观察表达时间不同而获得含有不同Ano1密度的HEK293细胞,应用膜片钳方法检测Ano1密度对其电流特性的影响。探讨CaCCs密度对Ano1电流特性的调节作用及高表达Ano1促进肿瘤发生的机制。
1 材料与方法
1.1细胞培养和转染
HEK-293细胞购于美国菌种保藏中心,于37℃、5%CO2培养箱内,在含10%胎牛血清、0.5%青链霉素的DMEM高糖培养液中培养。待细胞70%~80%时弃培养液。参照Fugen-6试剂说明操作,在HEK293细胞中瞬时转染Ano1质粒(1 μg)。细胞中同时转染1 μg EGFP用于荧光检测。细胞于37℃、5%CO2培养箱内培养6 h和24 h后进行膜片钳实验。
1.2膜片钳记录钙激活氯电流
转染Ano1后的HEK293细胞在荧光显微镜下进行全细胞膜片钳实验,电极电阻为2~4 MΏ。应用Clampfit9,通过AxoPatch 200B膜片钳放大器和Digidata1322A采集数据(MD,美国)。“无钙”电极内液含146 mmol/L CsCl,2 mmol/L MgCl2,5 mmol/L EGTA,10 mmol/L蔗糖,8 mmol/L HEPES,应用NMDG调节至pH 7.3。“高钙”电极内液用5 mmol/L Ca2+-EGTA替代EGTA,其游离钙离子浓度约为25 μmol/L。1 μmol/L钙离子浓度的电极内液通过由“无钙”和“高钙”电极内液按照1∶9的比例配制而成,游离钙离子浓度用Fure-2和Fura 6F(Invitrogen)验证。细胞外液含140 mmol/L NaCl,4 mmol/L KCl,2 mmol/L CaCl2,1 mmol/L MgCl2,10 mmol/L葡萄糖和10 mmol/L HEPES(pH 7.3)。所有液体渗透压均用蔗糖调至305 mOsm。细胞电压钳制在0 mV,刺激电压为-100 mV~+100 mV,步阶电压20 mV,刺激时间为700 ms。
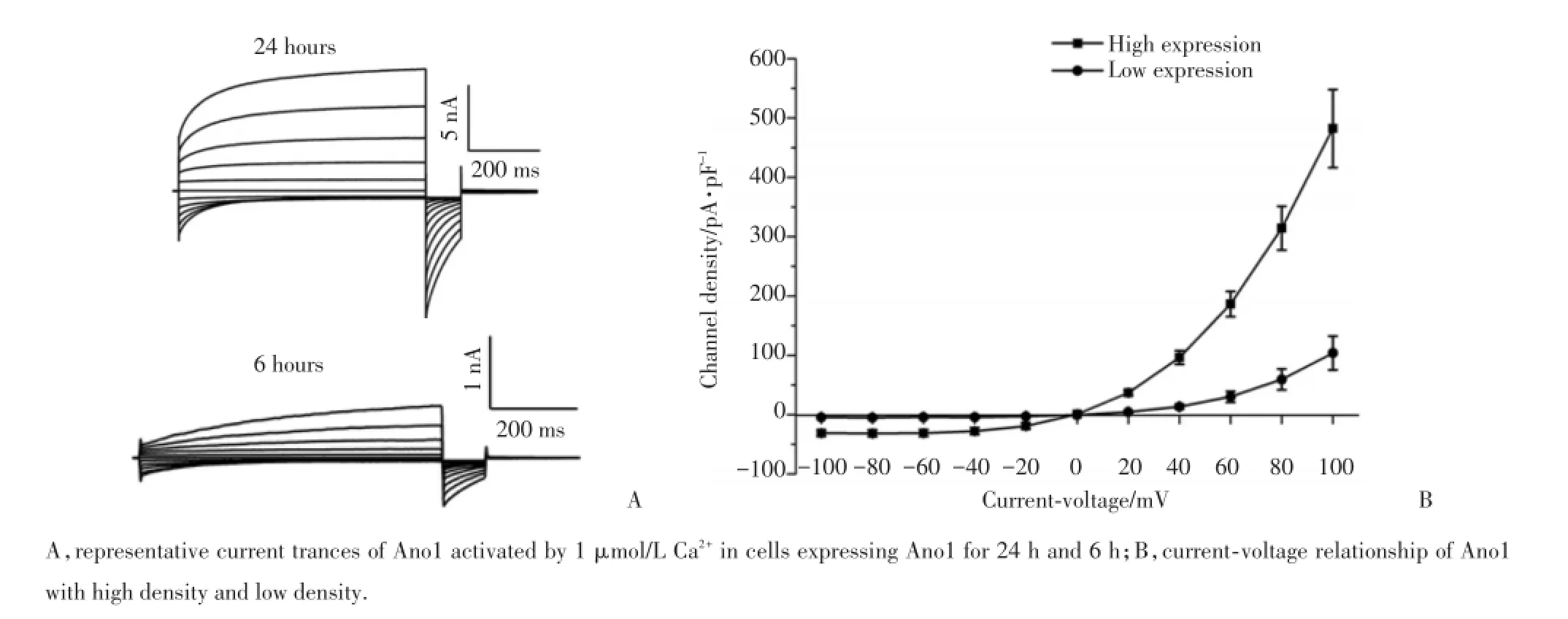
图1 转染Ano1质粒6 h及24 h后的HEK293细胞Ano1电流密度Fig.1 Channe l current density of Ano1 in HEK293 cells after transient transfection w ith Ano1 p lasm id for 6 h and 24 h
1.3数据分析
应用Origin 7软件进行分析数据和图像制作。激活电流曲线由单指数或两个指数拟合而成。应用t检验比较组间差异,检验水准α=0.05。
2 结果
2.1不同转染时间对Ano1电流密度的影响
应用膜片钳检测瞬转Ano1质粒后表达Ano1蛋白6 h和24 h的HEK293细胞的钙激活氯电流结果显示,在1 mmol/L钙离子条件下,HEK细胞记录到钙激活的氯电流,电流呈现强烈的外向整流和时间依赖性激活的特性(图1),符合钙离子激活Ano1的电流特性[11]。在+100 mV的条件下,Ano1质粒表达6 h的电流密度为(103.68±28.62)pA/pF;Ano1质粒表达24 h的电流密度为(482.12±65.70)pA/pF,2者比较差异有统计学意义(P<0.05)。
2.2通道密度对Ano1电流激活动力学的影响
结果显示,在低通道密度时,Ano1电流激活只有缓慢激活成分(τslow),Ano1的激活电流曲线最适于用单指数拟合,τslow为(292.71±38.11)ms;在高通道密度时,Ano1电流激活包括快速激活成分(τfast)和缓慢激活成分(τslow),Ano1的激活电流曲线最适于用两指数拟合,τfast为(47.78±4.58)ms;τslow为(385.74±71.44)ms。高通道密度Ano1的τslow与低通道密度比较没有统计学差异(P>0.05)。
3 讨论
尽管Ano1高表达促进肿瘤发生发展的机制还不清楚,但有研究[10]结果证明,高表达Ano1可以激活ERK1/2通路、EGFR通路及CAMK等多种信号通路。另外,Ano1的氯通道功能有促进肿瘤细胞增殖的作用[12]。高表达Ano1是否对Ano1的氯通道有调节作用还未见报道。
Mazzanti等[13]报道L型电压依赖性钙通道的电流特性受通道密度调节,本研究发现Ano1质粒表达24 h的电流密度比表达6 h的电流密度显著增加,表明Ano1质粒表达24 h导致了通道密度增高。高通道密度下的Ano1电流激活包括两个组成成分:快速激活成分(τfast)和缓慢激活成分(τslow)。低通道密度下的Ano1电流激活只有缓慢激活成分。前期研究[14]表明快速激活成分和电压依赖性激活Ano1相关,而缓慢激活成分和钙离子依赖性激活Ano1相关;通透的阴离子可以调控电压依赖性门控Ano1通道[11]。本研究发现,高密度Ano1可能通过调节电压依赖性激活Ano1,而不影响钙离子依赖性激活Ano1;高密度通道调节电压依赖性激活Ano1,即在高通道密度的条件下,通透的阴离子增加,而高通透的阴离子可能作为电压感受器,促进电压依赖性激活Ano1。
由于Ano1快速通透氯离子可以更快调控细胞的膜电位[11],进而可能参与肿瘤细胞增殖、侵袭、转移等生物学行为[10],本研究发现高表达Ano1能够加速Ano1激活,说明高表达Ano1可能促进通道处于激活状态。本研究可能为进一步阐明高表达Ano1促进肿瘤发生发展提供了一个新的思路。
[1]Criss H,Yu K,Xiao QH,et al.Anoctamin/TMEM16 family members are Ca2+-activated Cl-channels[J].J Physiol,2009,587(10):2127-2139.
[2]West RB,Corless CL,Chen X,et al.The novel marker,DOG1,is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status[J].Am J Pathol,2004,165 (1):107-113.
[3]Wu H,Guan S,Sun M,et al.Ano1/TMEM16A overexpression is associated with good prognosis in PR-positive or HER2-negative breast cancer patients following tamoxifen treatment[J].PLos One,2015,10(5):e0126128.
[4]Liu W,Lu M,Liu B,et al.Inhibition of Ca(2+)-activated Cl(-)channel ANO1/TMEM16A expression suppresses tumor growth and invasiveness in human prostate carcinoma[J].Cancer Letters,2012,326(1):41-51.
[5]Sauter DRP,Novak I,Pedersen SF,et al.ANO1(TMEM16A)in pancreatic ductal adenocarcinoma(PDAC)[J].Pflügers Arch Eur J Physiol,2014,467(7):1-14.
[6]Liu F,Cao Q H,Lu D J,et al.TMEM16A overexpression contributes to tumor invasion and poor prognosis of human gastric cancer through TGF-β signaling[J].Oncotarget,2015,6(13):11585-11599.
[7]Podchanart W,Luisa W,Koehl GE,et al.Role of anoctamins in cancer and apoptosis[J].Philos Trans R Soc Lond B Biol Sci,2014,369(1638):1524-1530.
[8]Sayo M,Satomi N,Katsuhiko M,et al.Downregulation of Ca2+-activated Cl-channel TMEM16A by the inhibition of histone deacetylase in TMEM16A-expressing cancer cells[J].J Pharmacol Exp Therapeutics,2014,351(3):510-518.
[9]Umamaheswar D,Shiwarski DJ,Dong X,et al.TMEM16A induces MAPK and contributes directly to tumorigenesis and cancer progression[J].Cancer Res,2012,72(13):3270-3281.
[10]Adrian B,Anke B,Heike B,et al.Calcium-activated chloride channel ANO1 promotes breast cancer progression by activating EGFR and CAMK signaling[J].Proceed Nat Acad Sci USA,2013,110 (11):E1026-E1034.
[11]Xiao QH,Yu K,Patricia PC,et al.Voltage-and calcium-dependent gating of TMEM16A/Ano1 chloride channels are physically coupled by the first intracellular loop[J].Proceed Nat Acad Sci USA,2011,108(21):8891-8896.
[12]Shiwarski DJ,Chunbo S,Anke B,et al.To"grow"or"go":TMEM16A expression as a switch between tumor growth and metastasis in SCCHN[J].ClinCancer Res,2014,20(17):4673-4688.
[13]Mazzanti M,Defelice LJ,Liu YM.Gating of L-type Ca2+channels in embryonic chick ventricle cells:dependence on voltage,current and channel density[J].J Physiol,1991,443(3):307-334.
[14]Xiao QH,Cui YY.Acidic amino acids in the first intracellular loop contribute to voltage-and calcium-dependent gating of anoctamin1/ TMEM16A[J].PLos One,2014,9(6):e99376-e99376.
(编辑武玉欣)
EffectofCa2+-activated ChlorideChannelDensity on Gating Propertiesof Anoctam in 1
MAKe,WANGHui,WANGQing-hua,LUOShu-ya,XIAOQing-huan
(Departmentof Ion ChannelPharmacology,SchoolofPharmacy,ChinaMedicalUniversity,Shenyang 110122,China)
ObjectiveTo investigate theeffectofchanneldensityon thegatingpropertiesofAnoctamin1(Ano1,TMEM16A)Ca2+-activated chloride channel.MethodsAno1 expression plasmids were transiently transfected into HEK293 cells.High density and low density of Ano1 was obtained after expressing the protein for 24 h and 6 h,respectively.Electrophysiological recordings were performed in the whole-cell patch clamp configuration.The activation kinetics of current traces was fitted by exponentials.Results The current density was significantly higher in cells expressing Ano1 for24 h than thoseexpressingAno1 for6 h(P<0.05).Theactivation ofAno1 currentin cellswith low densitywaswellfitbyasingleexponentialwithτslowof292.71±38.11ms.Theactivation ofAno1 currentin cellswith high densitywaswellfitby twoexponentialswithτfastof47.78±4.58 ms and τslowof 385.74±71.44 ms.ANO1 current in cells with high density has a rapid active component(τfast)more than low density.There was no significantlydifferentoftheτslowbetween cellswithhigh densityand low densityofAno1(P>0.05).ConclusionOur findingssuggested thatchanneldensity regulatesthegatingofAno1.High channeldensity promotesactivationofAno1.
Anoctamin1;Ca2+-activated chloride channel;channel density;activation kinetics;tumor
R966
A
0258-4646(2016)04-0298-03
10.12007/j.issn.0258-4646.2016.04.003
国家自然科学基金(31371145;81572613)
马可(1989-),女,助教,硕士.
肖庆桓,E-mail:qinghuanxiao12345@163.com
2015-10-16
网络出版时间:
网络出版地址

