漆酶N端融合His-tag或S-tag标签促进其在大肠杆菌中可溶性表达
岳青霞张丽洁田健伍宁丰姚冬生
(1. 暨南大学生命科学技术学院,广州 510632;2. 中国农业科学院生物技术研究所,北京 100081;3. 河北农业大学生命科学学院,保定071001)
漆酶N端融合His-tag或S-tag标签促进其在大肠杆菌中可溶性表达
岳青霞1,2张丽洁2,3田健2伍宁丰2姚冬生1
(1. 暨南大学生命科学技术学院,广州 510632;2. 中国农业科学院生物技术研究所,北京 100081;3. 河北农业大学生命科学学院,保定071001)
来源于地衣芽孢杆菌的漆酶具有催效率高,底物范围广等优点在工农业等领域具有重要的应用前景,但该酶在外源基因表达系统中的表达量低,影响了其在工农业等领域的应用。His-tag和S-tag两种标签由于具有分子量小,且一般不影响外源蛋白性质等特点,在外源蛋白的纯化和检测中具有重要的应用。本研究发现将来源于地衣芽孢杆菌的漆酶CotA的N端融合Histag或S-tag构建于pET-22b载体,并转化大肠杆菌BL21(DE3)后可以显著提高其在大肠杆菌中的可溶性表达量,其表达量较N端无融合标签的构建,His-tag可提高漆酶表达量约为37倍,S-tag约可提高20倍,His-tag与S-tag共作用约可提高28倍。
漆酶;His-tag;S-tag;高效表达
漆酶(EC 1.10.3.2)是一种含铜的多酚氧化酶,能够氧化多种芳香化合物和其他有机化合物,并使氧气还原生成水[1]。漆酶分布广泛,存在于植物[2]、昆虫[3]、真菌[4]和细菌[5]中,其中真菌漆酶的研究较为深入,而且在真菌中的表达量较高。但细菌来源的漆酶对热、卤素和碱的稳定性好,最适pH范围广泛,这些优点都是真菌漆酶所无法比拟的。来源于地衣芽孢杆菌的漆酶CotA(GenBank登录号:AGT45479.1)自2001年被首次发现后,逐渐引起人们的重视。虽然细菌来源的漆酶具有很大的潜在应用价值,但其在外源基因表达系统中的表达量仍是亟待解决的关键问题。
大肠杆菌因其具有遗传背景清楚,技术操作和培养条件简单,大规模发酵经济等优点而倍受关注,同时大肠杆菌也是目前应用最广泛的表达系统。但是该系统也存在一定的局限性,外源蛋白在表达过程中易形成包涵体,且包涵体的复性困难。因此,通过对靶蛋白的修饰,如对目的基因进行定点突变[6],控制培养基成分[7]及Cu2+浓度[8-10],添加标签等可以提高目的蛋白的可溶性表达。目前常用的融合标签包括:SUMO[11](small ubiquitinlike modifier)、S-谷胱甘肽转移酶[12](glutathione S-transferase,GST)、多聚组氨酸[13](His-tag)、Flag-tag[14]、麦芽糖结合蛋白[15](maltose binding protein,BMP)、c-myc-tag[16]、eGFP和S-tag[17]等。
His标签是一种非常普遍的用于纯化蛋白的标签,该标签分子量小,虽然带有His标签的蛋白的衍射图谱与天然蛋白稍有差异[18],但对目的蛋白的活性几乎无影响。1975年,Porath等[19]提出固定化金属亲和层析(Immoilized metal affinity chromatography,IMAC),它的基本原理是固定在基质中的过渡金属元素(Co2+、Ni2+、Cu2+和Zn2+)和特殊氨基酸侧链间的相互作用。S-tag由15个氨基酸组成,其作用原理是这15个氨基酸与103个S-蛋白发生强烈的相互作用。它包括4个带正电,3个带负电,3个极性不带电和5个非极性氨基酸组成,这些氨基酸使得S-tag具有可溶性。
本实验将系统的研究漆酶N端的His-tag或S-tag对其在肠杆菌中可溶性表达的影响,旨为其应用及工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂 大肠杆菌(Escherichia coli)BL21(DE3)感受态细胞购自天根生化科技(北京)公司,pET22b-CotA-BL为本实验室保存。ABTS(2, 2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐)购自Sigma公司,T4 DNA连接酶和限制性内切酶(Nde I、Nco I)购自New England Biolabs(NEB)公司,dNTPs、DNA聚合酶购自天根生化科技(北京)公司,DNA纯化回收试剂盒、胶回收试剂盒购自Axygen公司,其他试剂为国产分析纯,购自北京化学试剂公司。
1.1.2 培养基 LB培养基:酵母浸取物5 g/L,蛋白胨10 g/L,NaCl 10 g/L。
1.2 方法
1.2.1 His-tag、2Gly、S-tag、His-tag+S-tag序列的克隆 His-tag和S-tag为短序列,参考pET系列表达载体上的序列设计引物,His-tag引物为His-tag-F:5'-ATACATATGCATCACCACCACCATCACGGTGGCGCCATGGATA-3'和His-tag-R:5'- TATCCATGGCGCCACCGTGATGGTGGTGGTGATGCATATGTAT-3',引物两端引入Nde I和Nco I酶切位点;两个Gly序列的引物为:2Gly-F:5'-ATACATATGGGTGGCGCCATGGATA-3'和2Gly-R:5'- TATCCATGGCGCCACCCATATGTAT-3'引物两端同样引入酶切位点Nde I和Nco I。S-tag引物为S-tag-F:5'- ATACATATGAAAGAAA CCGCTGCTGCTAAATTCGAACGCCAGCACATGGAC AGCGGTGGCCCATGGATA-3'和S-tag-R:5'- TATCC ATGGGCTGTCCATGTGCTGGCGTTCGAATTTAGCAGC AGCGGTTTCTTTCGCCACCATATGTAT-3',引物两端引入Nde I和Nco I酶切位点,His-tag-F、His-tag-R以及S-tag-F、S-tag-R用NEB 3号buffer溶解后各取5 μL混匀,两条引物互为模板进行扩增。PCR条件为:94℃预变性5 min,94℃变性30 s,68℃退火30 s,每个循环退火温度降低1℃至退火温度为50℃,退火温度降为50℃后循环11次。His-tag+S-tag超过100 bp,依据pET-30a(+)设计引物进行扩增,引物为His+S-F:5'-ATACAT-ATGCACCATCATCAT-3'和His+S-R:5'-ATACCATGGCCTTGTCGTCGT-3',同样在其产物两端引入Nde I和Nco I酶切位点。以pET-30a(+)为模板进行扩增,扩增体系为:模板1 μL,dNTPs 4 μL,10 mmol/L His+S-F、His+S-R各 5 μL,Fast Pfu polymerase 1.5 μL,5×Fast Pfu polymerase buffer 10 μL,H2O 23.5 μL。扩增条件为:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共30个循环,72℃延伸10 min。
1.2.2 His-tag、2Gly、S-tag、His-tag+S-tag分别与pET22b-CotA-BL重组载体的构建 将扩增的Histag、2Gly、S-tag、His-tag+S-tag及pET22b-CotA-BL用Nde I和Nco I双酶切,其中酶切后的His-tag、2Gly、S-tag、His-tag+S-tag用乙醇沉淀加以回收,酶切后的pET22b-CotA-BL经1%的凝胶电泳,切胶回收。经过双酶切后的His-tag、2Gly、S-tag、His-tag+S-tag分别与双酶切后的pET22b-CotA-BL连接,转化BL21(DE3)感受态细胞,涂布含100 μg/mL氨苄青霉素平板。菌液PCR验证阳性克隆子后送测序,测序正确后进行诱导表达。
1.2.3 重组漆酶的表达 将含有重组质粒的菌株于平板上划线活化,挑取单克隆至含有100 μg/mL氨苄青霉素的LB培养基中,37℃,200 r/min振荡培养,将该培养液以1∶100的比例转接至50 mL含100 μg/mL氨苄青霉素的液体培养基中,30℃,120 r/min培养至OD600=0.6-0.8后,加入终浓度为0.25 mmol/L的Cu2+和终浓度为1 mmol/L的IPTG,25℃,120 r/min振荡培养4 h后静置诱导20 h[20]。
诱导后的菌液在4℃,8 000 r/min离心10 min后,弃上清收集菌体。菌体用50 mmol/L Tris-HCl(pH8.0)重悬,冰上超声破碎。破碎后的粗酶液经4℃,12 000 r/min离心后小心地取出上清,进行酶活性的测定,同时取出少量样品进行SDS-PAGE分析。
1.2.4 漆酶酶活的测定 漆酶活性的测定是以ABTS(ε420 nm=36 000 L/mol·cm)为底物,取750 μL 0.1 mol/L 磷酸氢二钠-柠檬酸缓冲液(pH4.5)和200 μL 5 mmol/L ABTS,二者于37℃预热2 min后加入50 μL重组漆酶粗酶液反应3 min后,混合液于冰水混合物中终止1 min后,在ε420 nm条件下读数。漆酶一个酶活力单位(U)定义为:最适条件下,每分钟催化1 μmol底物氧化所需要的酶量。
2 结果
2.1 标签的克隆和重组表达载体的构建
为了研究His-tag或S-tag对漆酶基因表达的影响,首先将来源于地衣芽孢杆菌的漆酶通过酶切位点(BamH I-Xho I)连入载体pET22b上。然后分别将His-tag、S-tag及His-tag+S-tag通过漆酶上游的酶切位点(Nde I和Nco I)连在表达载体上,为了使His-tag或S-tag不影响漆酶的功能,在标签的下游引入两个柔性的甘氨酸。同时也在Nde I和Nco I之间构建了一个只有两个甘氨酸的载体,该载体和仅在pET22b上连有漆酶的构建一起用来作为阴性对照。构建过程,见图1。
2.2 重组漆酶酶活的测定
以ABTS为底物,在pH4.5,37℃条件下测定重组漆酶的酶活性,结果(图2)显示,在将pET-22b载体上的信号肽替换为2个甘氨酸时,两者的酶活基本相同,但将His标签连接于pET-22b与漆酶基因共同表达时,其酶活提高至2 U/mL,约是没连标签的37倍。此外,当漆酶基因与S-tag和His-tag与S-tag共表达时其可溶性蛋白的量也分别是没连标签的20倍和28倍。
2.3 重组漆酶SDS-PAGE分析
从蛋白电泳的结果(图3)可以看出,融合蛋白的分子量约为70 kD,His-tag与S-tag大小相差不大,融合蛋白的分子量也基本相同,连接有Histag+S-tag的重组漆酶在基因序列上比连接有S-tag的重组漆酶多出一个His-tag序列外还增加了多个限制性酶切位点以及凝血酶和肠激酶等额外序列,因此其蛋白的分子量要大于连接有S-tag的重组漆酶。相比于野生型,His-tag、S-tag、His-tag+S-tag对与漆酶的可溶性表达均有所提高。
3 讨论
漆酶在大肠杆菌中表达时常因铜离子的耗损导致其表达量或者酶活降低,Koschorreck等[21]通过向培养基中添加铜离子可以部分提高漆酶的酶活,但是铜离子浓度大于2 mmol/L时对菌体的生长产生抑制作用。细胞内的铜离子的积累不一定能使得漆酶的铜离子含量增加,进而影响漆酶的表达,因为细胞内的铜离子并不是以自由离子的形式存在,而是结合于金属蛋白或者是铜离子伴侣进而将铜离子传递给目标蛋白[22]。Gunne等[23]将来源于地衣芽孢杆菌的漆酶CotA与铜离子伴侣CopZ在大肠杆菌BL(DE3)中共表达后,铜离子含量增加了20%,酶活相较于野生型提高了26%。
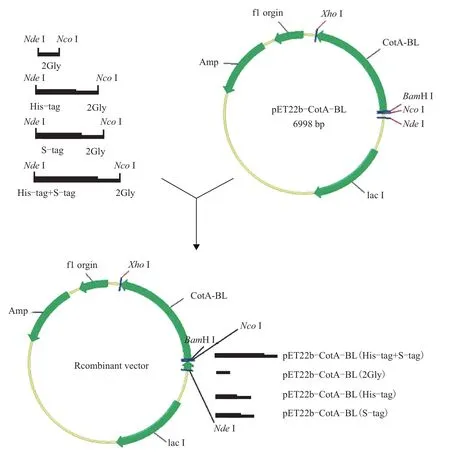
图1 重组载体的构建
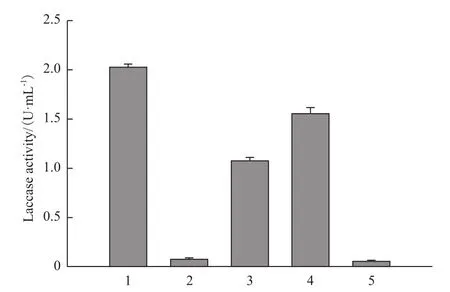
图2 重组漆酶的酶活
由于His-tag和S-tag的序列中包含有大量的带电荷的氨基酸,可以非特异的螯合铜离子。而在漆酶的结构中至少需要4个铜离子,因此,在漆酶的N端融合表达His-tag或S-tag可以帮助漆酶在结构形成之前募集更多的铜离子,而His-tag和S-tag与铜离子的结合并不紧密,这些铜离子整合进漆酶的结构中,并形成正确的结构。因此,在漆酶的N端融合表达His-tag或S-tag有可能会提高漆酶的可溶性表达量。
His-tag作为蛋白融合标签,在蛋白的纯化中最为常见,且其分子量小,对于蛋白的活性一般无影响,有研究称多聚组氨酸的数目及融合部位对融合蛋白的表达水平及其溶解性有显著影响,当标签长度由6个增加到10个时反而降低了目的蛋白的表达量[24]。本研究中多聚组氨酸提高了漆酶的表达量,其可能的原因是:(1)组氨酸作为过渡元素,能够螯合环境中的铜离子,铜离子作为漆酶的反应中心,在传递电子和氧化还原作用中发挥重要作用,此外,铜离子对于漆酶的形成也有影响。组氨酸标签在与漆酶共表达的过程中可充当铜离子库,为漆酶提供铜离子,无论是在参与氧化还原反应还是在漆酶的形成过程中都有重要作用。(2)有研究表明,新生肽链的聚集速率超过蛋白正确折叠的速率就容易形成包涵体,连续的6个组氨酸降低了新生肽链合成的速率,使得蛋白能够正确的折叠,减少了肽链的聚集,从而使可溶性蛋白的量提高。(3)组氨酸自身带正电荷,使得重组蛋白所带的电荷有所改变,蛋白多带电荷与所处的溶剂环境相互作用,使重组蛋白可以稳定存在,防止蛋白的聚集。(4)多聚组氨酸标签改变了起始部分mRNA的二级结构,使核糖体能够高效结合,从而提高了重组蛋白的表达量。
同样S-tag常用于蛋白的检测及纯化,其氨基酸组成使得自身高度可溶。S-tag对漆酶可溶性有所帮助,可能的原因是可溶性标签使得与之融合的可溶性蛋白的量增加。本研究中,将两者标签联合使用对漆酶的表达量的提高没有单独使用His-tag时效果好,可能是因为两个标签之间相互作用,影响了可溶性蛋白的表达。
本研究为金属依赖性酶的可溶性表达提供了新思路,通过增加能够螯合金属离子的标签的螯合作用,为蛋白的正确折叠提供金属离子库,同时N端的标签也可以使得重组蛋白的mRNA的结构有所改变,降低折叠速率,降低重组蛋白的降解率等,进而提高了可溶性蛋白的表达量。但是并不是所有的蛋白都适合此规律,我们应根据重组蛋白的性质慎重选择标签,以期达到提高蛋白表达量的目的。
4 结论
通过在地衣芽孢杆菌来源的漆酶 N端添加Histag、S-tag以及His-tag+S-tag,将可溶性漆酶的酶活分别提高至未融合标签蛋白的37倍,20倍和28倍。
[1]Hoshida H, Nakao M, Kanazawa H. Isolation of five laccase gene sequences from the white-rot fungus Trametes sanguinea by PCR,and cloning, characterization and expression of the laccase cDNA in yeasts[J]. Journal of Bioscience and Bioengineering, 2001, 92(4):372-380.
[2]Bao W, Omalley DM, Whetten R, et al. A laccase associated with lignification in loblolly pine xylem[J]. Science, 1993, 260(5108):672-674.
[3]Dittmer NT, Suderman RJ, Jiang H, et al. Characterization of cDNAs encoding putative laccase-like multicopper oxidases and developmental expression in the tobacco hornworm, Manduca sexta,and the malaria mosquito, Anopheles gambiae[J]. Insect Biochem Mol Biol, 2004, 34(1):29-41.
[4] Heinzkill M, Messner K. The ligninolytic system of fungi AnkeT(ed). Fungal Biotechnology, 1997:213-226.
[5]Zeng J, Lin X, Zhang J, et al. Oxidation of polycyclic aromatic hydrocarbons by the bacterial laccase CueO from E. coli[J]. Applied Microbiology and Biotechnology, 2011, 89(6):1841-1849.
[6]Koschorreck K, Schmid RD, Urlacher VB. Improving the functional expression of a Bacillus licheniformis laccase by random and sitedirected mutagenesis[J]. BMC Biotechnol, 2009, 9:12.
[7]Tinoco R, Acevedo A, Galindo E, et al. Increasing Pleurotus ostreatus laccase production by culture medium optimization and copper/lignin synergistic induction[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(4):531-540.
[8]Galhaup C, Haltrich D. Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J]. Applied Microbiology and Biotechnology, 2001, 56(1/2):225-232.
[9]Palmieri G, Giardina P, Bianco C, et al. Copper induction of laccase isoenzymes in the ligninolytic fungus Pleurotus ostreatus[J]. Applied and Environment Microbiology, 2000, 66(3):920-924.
[10]Lorenzo M, Moldes D, Sanromán MA. Effect of heavy metals on the production of several laccase isoenzymes by Trametes versicolor and on their ability to decolourise dyes[J]. Chemosphere, 2006, 63(6):912-917.
[11]Malakhov MP. SUMO fusion and SUMO-specific proteases for efficient expression and purification of proteins[J]. Genome,2004, 5:75-86.
[12]Smith DB. Single-step purification of polypeptides espressed in Escherichia coli as fusions with glutathione S-transferase[J]. Gene, 1988, 67:31-40.
[13]Hochuli E. New metal chelate adsorbent selective for proteins and peptides containing neighbouring histidine residues[J]. J Chormatogr, 1987, 411:177-184.
[14]Hopp TP. A short ploypeptide marker sequence useful for recombinant protein identification and purification[J]. Bio Technology, 1988, 6:1204-1210.
[15]di Guan C, Li P, Riggs PD, Inouye H. Vectors that facilitate the expression and purification of foreign peptides in Escherichia coli by fusion to maltose-binding protein[J]. Gene, 1988, 67:21-30.
[16] Evan GI. Isolation of monoclonal antibodies specific for human cmyc proto-oncogene product[J]. Mol Cell Biol, 1985, 5:3610-3616.
[17]Karpeisky MY. Formation and properties of S-protein complex with S-peptide containing fusion protein[J]. FEBS Lett, 1994, 339:209-212.
[18]Hakansson K. Crystallization of peptidase T from Salmonella typhimurium[J]. Acta Crystallographica Section D-Biological Crystallography, 2000, 56:924-926.
[19] Porath J, Carlsson J, Olsson I. Metal chelate affinity chromatography,a new approach to protein fractionation[J]. Nature, 1975, 258(5536):598-599.
[20]Durao P, Chen Z, Fernandes AT, et al. Copper incorporation into recombinant CotA laccase from Bacillus subtilis:characterization of fully copper loaded enzymes[J]. J Biol Inorg Chem, 2008, 13(2):183-193.
[21] Koschorreck K, Richter SM, Ene AB, et al. Cloning and characterization of a new laccase from Bacillus licheniformis catalyzing dimerization of phenolic acids[J]. Applied Microbiology and Biotechnology, 2008, 79:217-224.
[22] Rae TD, Schmidt PJ, Pufahl RA, et al. Undetectable intracellular free copper:the requirement of a copper chaperone for superoxidedismutase[J]. Science, 1999, 284:805-808.
[23] Gunne M, Al-Sultani D, Urlacher VB. Enhancement of copper content and specific activity of CotA laccase from Bacillus licheniformis by coexpression with CopZ copper chaperone in E. coli[J]. Journal of Biotechnology, 2013, 168(3):252-255.
[24] Mohanty AK, Wiener MC. Membrane protein expression and production:effects of polyhistidine tag length and position[J]. Protein Expression and Purification, 2004, 33(2):311-325.
(责任编辑 李楠)
Promotion of Soluble Expression of Laccase in Escherichia coli by Fusion of His-tag or S-tag on the N-terminal of It
YUE Qing-xia1,2ZHANG Li-jie2,3TIAN Jian2WU Ning-feng2YAO Dong-sheng1
(1. College of Life Science and Technology,Jinan University,Guangzhou 510632;2. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081. 3. College of Life Sciences,Agricultural University of Hebei,Baoding 071001)
Laccase from Bacillus licheniformis has the advantages of high catalytic efficiency,wide range of substrates,etc.,thus it owns the broad application prospect in industrial and agricultural fields. However,the expression level of the enzyme in the foreign gene expression system is low,which greatly limits its application in the agricultural and industrial fields. His-tag or S-tag is the small peptide with low molecular weight and usually can not affect the characteristics of heterologous fusion protein,and they are beneficial to be applied in the purification and detection of heterologous proteins. In this study,fusion of His-tag and/or S-tag on the N-terminal of the laccase CotA from B. licheniformis was constructed into pET-22b vector,and the vector was transferred into Escherichia coli BL(DE3),then we found that the soluble expression level of laccase significantly increased in E. coli BL(DE3). Compared with the construction without no fusion of any tags on N-terminal,the expression level with His-tag was about 37 folds,20 folds with S-tag,and 28 folds with both His-tag and S-tag,respectively.
laccase;His-tag;S-tag;high expression
10.13560/j.cnki.biotech.bull.1985.2016.03.028
2015-09-02
国家“863”计划项目(2013AA102804)
岳青霞,女,硕士,研究方向:应用微生物与微生物工程;E-mail:hpuyqx@163.com
田健,男,博士,研究方向:蛋白质结构模拟、蛋白质分子设计与改良及微生物重要基因或元件资源挖掘;E-mail:tianjian@caas.cn

