木犀草素对人牙周膜细胞增殖及成骨分化能力的影响
张淼,刘绣华,赵红宇
(1.新疆维吾尔自治区人民医院口腔科,新疆乌鲁木齐830000;2.河南大学河南省天然药物与免疫工程重点实验室;3.广东省口腔医院南方医科大学附属口腔医院)
木犀草素对人牙周膜细胞增殖及成骨分化能力的影响
张淼1,刘绣华2,赵红宇3*
(1.新疆维吾尔自治区人民医院口腔科,新疆乌鲁木齐830000;2.河南大学河南省天然药物与免疫工程重点实验室;3.广东省口腔医院南方医科大学附属口腔医院)
目的:探讨不同浓度木犀草素对人牙周膜细胞(PDLC)增殖及成骨分化能力的影响。方法:体外培养PDLC并进行组织来源鉴定,取第3代细胞进行实验。MTT四唑盐比色法、碱性磷酸酶(ALP)检测试剂盒、Q-PCR检测成骨相关基因等方法观察不同浓度木犀草素对PDLC增殖及成骨分化能力的影响。结果:MTT结果显示不同浓度的木犀草素可以促进PDLC增殖,ALP试剂盒检测结果表明木犀草素也可以促进PDLC的ALP活性,且浓度为1 μmol/L的ALP OD值最高。Q-PCR结果显示木犀草素可以上调PDLC内ALP及成骨转录因子mRNA的含量。结论:一定浓度的木犀草素对PDLC增殖及成骨分化能力有一定的促进作用,为未来木犀草素应用于临床治疗牙周疾病提供依据。
木犀草素;人牙周膜细胞;增殖;碱性磷酸酶;RUNX2基因
[Abstract]Objective:To evaluate the biological effects of Luteolinl on the proliferation and differentiation in human periodontal ligament cells(PDLC).Methods:MTT,ALP kit and Q-PCR was used to detect the expression of osteogenesis related gene. Results:Luteolinl(100,10,1,0.1,0.01 μ mol/L)could increase the proliferation of PDLC,and there were significant differences compared with control group(P<0.05).The ALP Kit results showed that Luteolinl could increase the ALP actiuty of PDLC(P<0.05).The Q-PCR results showed that Luteolin could increase the expression of ALP and RUNX2(P<0.05). Conclution:At proper concentration,Luteolinl can increase the proliferation and differentiation of PDLC.
[Key words]Luteolinl;human periodontal ligament cell;proliferation;ALP;RUNX2
牙周膜细胞(periodontal ligament cell,PDLC)具有多向分化的潜能,可分化为成纤维细胞、成骨细胞和成牙骨质细胞,在一定的培养条件下可以形成骨结节,并表达骨相关蛋白,如碱性磷酸酶(ALP)、骨涎蛋白、骨钙素等[1-4],在牙周组织的更新和再生方面起着重要的作用。木犀草素具有抑制肿瘤、调节免疫、抗炎、抗氧化、降低破骨细胞活性等药理活性[5-7],Choi等[8]报道木犀草素可以促进小鼠成骨细胞MC3T3-E1 ALP及骨钙素的增加,但木犀草素对PDLC的作用尚未见报道。本实验旨在通过体外培养PDLC,观察木犀草素作用于PDLC后细胞增殖及成骨分化能力的变化。
1 材料和方法
1.1主要试剂DMEM培养液(美国,Gibco),胎牛血清(FBS)(美国,Sigma),木犀草素(河南大学刘绣华教授惠赠),ALP试剂盒(南京建成生物科技有限公司)。
1.2人PDLC体外培养取因正畸需要而拔出的新鲜恒牙,于无菌超净工作台内用刀片刮取牙根中1/3牙周膜组织,充分剪碎后以一定间隔平铺于6孔板,上置盖玻片,加入1~2 ml DMEM培养液(10%FBS,1%双抗),置于饱和湿度、5%二氧化碳、37℃环境下,每3 d换液一次,直至细胞从组织块中游离出并长满。胰酶消化传代,取第3~5代细胞用于实验。
1.3木犀草素对PDLC增殖的影响将生长状况良好的第3代PDLC以2×l03个/ml接种于3块96孔培养板,每块96孔板分6组,每组6个复孔,每孔200 μl,周边孔填充无菌PBS液。将3块96孔板放在5%CO2、37℃培养箱内24 h,待细胞贴壁后加入不同培养液(100、10、1、0.1、0.01 μmol/L)200 μl,在24、48、72 h分别取一块培养板每孔加入MTT 10 μl,继续培养4 h后弃去上清,每孔加二甲基亚飒(DMSO)200 μl,在振荡器上缓慢震荡10 min使结晶溶解,用酶联免疫检测仪在490 nm处测定每孔吸光度值(A490),取各孔均值,以A490数值反映活细胞数目。
1.4木犀草素对PDLC ALP活性的影响取生长状况良好的第3~5代PDLC,以5×104个/ml的浓度铺于96孔板,每组6个复孔,5%CO2、37℃培养24 h,细胞贴壁,按分组分别加入含不同浓度木犀草素(100、10、1、0.1、0.01 μmol/L)的矿化诱导液[DMEM培养基(10%FBS),地塞米松10-7mol/L,抗坏血酸Vc 50 μg/ml,β-甘油磷酸钠10 mmol/L]200 μl,5%CO2、37℃培养72 h后,按ALP试剂盒说明书操作,酶标仪520 nm处测OD值。
1.5Q-PCR检测木犀草素作用于PDLC后成骨相关基因的表达(1)将含100、10、1、0.1、0.01 μmol/L木犀草素的矿化诱导液分别培养PDLC 72 h后Trizol提取细胞内总RNA,PCR引物设计:从Genbank中查找人ALP及RUNX2基因序列,RT-PCR实验由广州必思恩生物科技有限公司完成。RT-PCR引物序列:Hom-ALP-F:5'-CCCC CGAGTCGGACGTGTAC-3';Hom-ALP-R:5'-CCGC CATGGACTTTCGTCAC-3';Hom-RUNX2-F:5'-GAG ATTTGTGGGCCGGAGTG-3';Hom-RUNX2-R:5'-CCTAAATCACTGAGGCGGTC-3';GAPDH-h-209-F:5'-AACGGATTTGGTCGTATTGG-3';GAPDH-h-209-R:5'-TGGAAGATGGTGATGGGATT-3'。(2)检测指标:读取Ct(Cytle threshold)值,参照文献报道的比较阈值法[1],利用2-△△Ct进行计算。
1.6统计学方法应用SPSS 17.0软件,进行多样本间的方差分析及两两间的LSD检验,Q-PCR数据进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1PDLC的培养及筛选所选择的细胞大部分呈长梭形,胞体饱满,具有细而长的胞突,胞质均匀,细胞核位于细胞中央、呈圆形或卵圆形。少量细胞较小且形态不规则。10~15 d后细胞呈放射状、旋涡状铺满培养板。见图1。
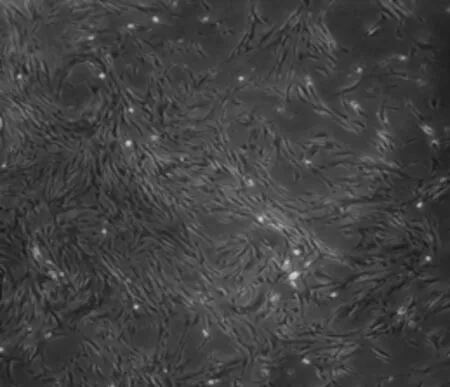
图1 PDLC的形态(×40)
2.2不同浓度木犀草素对PDLC增殖的影响在24、48、72 h时,各浓度木犀草素均可促进PDLC的增殖(P<0.05),经多样本均数间两两比较显示在24 h、48 h、72 h时各浓度组同一时间点间PDLC的增殖比较差异意义无统计学(P>0.05)。见表1。
2.3不同浓度木犀草素对PDLC的ALP活性的影响各浓度木犀草素均可促进ALP活性(P<0.05),经多样本均数间两两比较显示100 μmol/L浓度组木犀草素对PDLC中ALP活性的促进与其他组相比差异有统计学意义(P<0.05),100 μmol/L浓度组较其他实验组的ALP活性降低,其余各组之间差异无统计学意义(P>0.05)。见表2。
表1 木犀草素对PDLC增殖的影响(OD值)(A490,±s,n=6)
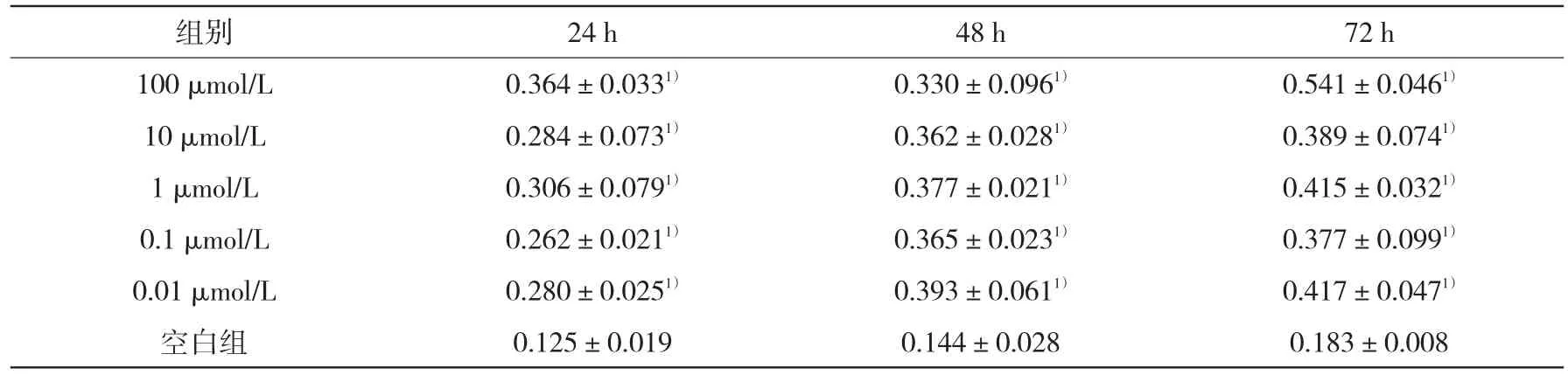
表1 木犀草素对PDLC增殖的影响(OD值)(A490,±s,n=6)
注:与空白组比较,1)P<0.05
72 h 0.541±0.0461)0.389±0.0741)0.415±0.0321)0.377±0.0991)0.417±0.0471)0.183±0.008组别100 μmol/L 10 μmol/L 1 μmol/L 0.1 μmol/L 0.01 μmol/L空白组24 h 0.364±0.0331)0.284±0.0731)0.306±0.0791)0.262±0.0211)0.280±0.0251)0.125±0.019 48 h 0.330±0.0961)0.362±0.0281)0.377±0.0211)0.365±0.0231)0.393±0.0611)0.144±0.028
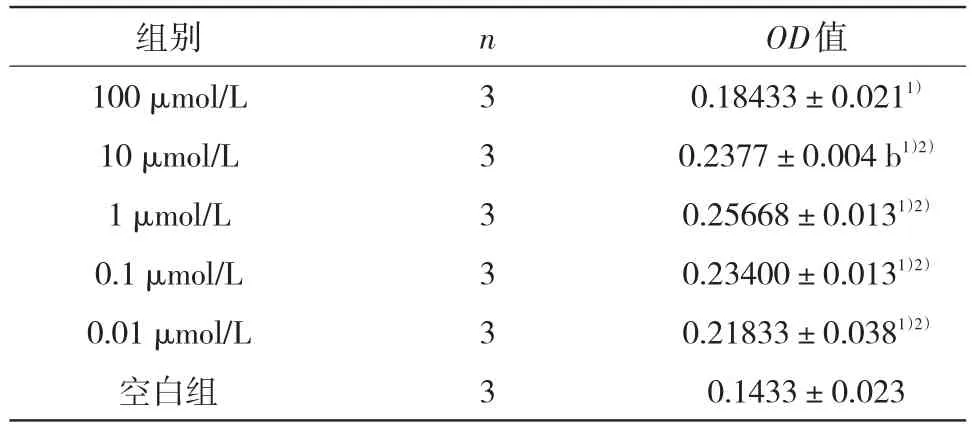
表2 木犀草素作用于PDLC 72 h后ALP平均光密度值(OD值)
2.4Q-PCR检测木犀草素作用的PDLC中骨相关基因ALP、RUNX2的表达ALP表达变化为:木犀草素作用72 h后,与空白组比较,除0.01 μmol/L组外,实验组ALP表达均呈上调趋势(P<0.05),1 μmol/L组ALP表达上调明显高于其他实验组(P<0.05),见表3。RUNX2表达变化为:木犀草素作用于PDLP 72 h后,1、0.1 μmol/L组较空白组RUNX2表达上调,差异有统计学意义(P<0.05),其他浓度组RUNX2表达较空白组上调,但差异无统计学意义(P>0.05),实验组组间比较差异无统计学(P>0.05),见表3。
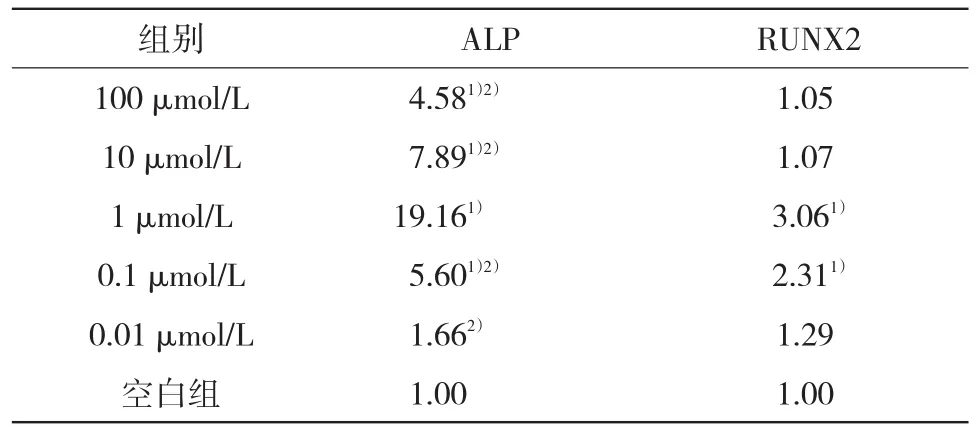
表3 木犀草素诱导PDLC 72 h后ALP及RUNX2的相对表达量
3 讨论
牙周膜是围绕牙根并连接牙根与牙槽骨的致密结缔组织,含有多种细胞。实验证实,PDLC群在一定条件下具有多向分化能力[9],在牙周组织的改建和修复过程中起着重要作用[10]。木犀草素又名黄色黄素或黄示灵,是一种天然四羟基黄酮化合物,分子式:C15H10O6,分子量:286.23。最初因从木犀草的叶、茎、枝中分离得到而得名,可从多种天然药材、蔬菜果实中分离得到,如金银花、荆芥、芹菜、卷心菜、裸花紫珠、西兰花、苹果皮、菊花、胡萝卜、胡椒和洋葱的叶子等[5],在自然界中常以糖基化的形式存在[6]。木犀草素具有多种药理活性,富含木犀草素的植物常被用作中药治疗疾病。而且木犀草素还具有抗炎、抗氧化、免疫调节以及降低破骨细胞活性等作用[5-7]。张毅等[11]将木犀草素用于脂多糖(LPS)干扰下的小鼠单核巨噬细胞,结果发现木犀草素抑制促炎因子PGE2等的表达,且在RNA水平抑制了COX-2的表达,说明木犀草素的抗炎作用可能与抑制PGE2和COX-2的表达有关。但是木犀草素对间充质细胞骨分化的作用尚未见报道。
MTT实验结果表明木犀草素浓度在0.01~100 μmol/L,明显促进人PDLC增殖,与对照组比较,差异有统计学意义。
ALP是一种非特异性磷酸单酯酶,在人体内大量存在,能够反映细胞成骨活性,是早期成骨细胞分化的标志[12]。无论是新鲜正常牙周组织,还是体外培养的PDLC,都具有较高的ALP活性(比牙龈组织或细胞高数倍至十几倍)[13-14]。组织化学研究表明,牙槽骨、成骨细胞、牙周韧带ALP染色强阳性[8]。这表明PDLC具有较强的成骨倾向。ALP活性检测已成为PDLC成骨分化功能的一项重要指标[12]。本实验结果表明,木犀草素可促进PDLC对ALP活性的表达,说明木犀草素具有促进PDLC向可以形成矿化组织的细胞即成牙本质细胞和成骨分化细胞分化的作用。但其作用机制还需进一步实验研究探索。在本研究中,应用ALP试剂盒检测不同浓度木犀草素作用于PDLC后ALP活性的变化,结果显示:各浓度木犀草素作用于PDLC 72 h后均可促进ALP活性的增加(P<0.05),Q-PCR检测进一步证实各浓度的木犀草素可以使ALP表达上调(除0.01 μmol/L浓度木犀草素)(P<0.05),且0.1 μmol/L浓度木犀草素对PDLC中ALP活性的促进与其他实验组相比显著增加(P<0.05)。说明一定浓度的木犀草素可以促进PDLC的成骨分化,增强ALP活性。
RUNX2基因是一种成骨细胞分化特异性转录因子,在成骨细胞早期增殖的过程中起着重要的作用[15],是检测PDLC骨向分化的常用指标之一[16-17]。Q-PCR结果显示:各浓度木犀草素在矿化诱导条件下均可上调RUNX2基因的表达,其中1 μmol/L组和0.1 μmol/L组RUNX2基因的表达上调与空白组比较差异有统计学意义(P<0.05)。上述结果说明一定浓度的木犀草素可以提高PDLC成骨细胞分化特异性转录因子,提示木犀草素可以促进PDLC成骨分化。
综上所述,一定浓度(0.01~100 μmol/L)的木犀草素在一定条件下可以促进PDLC的增殖、蛋白合成及成骨分化,为以后的研究提供一定的基础。
[1]刘娟,赵红宇,轩东英,等.人牙周膜细胞群多向分化潜能的实验研究[J].华西口腔医学杂志,2010,28(2):185-189.
[2]Lekic P,Rojas J,Birek C,et al.Phenotypic comparison of periodontal ligament cells in vivo and in vitro[J].J Periodontal Res,2001,36(2):71-79.
[3]Murakami Y,Kojima T,Nagasawa T,et al.Novel isolation of alkalinephosphatase-positivesubpopulationfrom periodontal ligament fibroblasts[J].J Periodontol,2003,74(6):780-786.
[4]Wu L,Wei X,Ling J,et al.Early osteogenic differential protein profiledetectedby proteomic analysis in human periodontal ligament cells[J].J Periodontal Res,2009,44(5):645-656.
[5]何煜舟,丁关萍.木犀草素对H2O2氧化损伤的血管内皮细胞的影响[J].中国病理生理杂志,2007,23(7):1285-12881.
[6]Verbeek R,van Tol EA,van Noort JM.Oral flavonoids delay recovery from experimental autoimmune encephalomyelitis in SJL mice[J].Biochem Pharmacol,2005,70(2):220-228.
[7]Kim TH,Jung JW,Ha BG,et al.The effects of luteolin on osteoclast differentiation,function in vitro and ovariectomy-induced bone loss[J].J Nutr Biochem,2011,22(1):8-15.
[8]ChoiEM.Modulatoryeffectsofluteolinonosteoblasticfunction and inflammatorymediatorsin osteoblastic MC3T3-E1 cells[J]. Cell Bio Int,2007,31(9):870-877.
[9]Trzeciakiewicz A,Habauzit,Mercier S,et al.Hes-peretin stimulates differentiation of primary rat osteoblasts involving the BMP signalling pathway[J].J Nutr Biochem,2010,21(5):424-431.
[10]Palmon A,Roos H,Edel J,et al.Inverse dose-and Time-dependment effect of basic fibroblast growth factor on the gene expression of collagen typeⅠand MMP-1 by periodontal ligament cells in culture[J].J Periodontol,2000,71(6):974-980.
[11]张毅,王旭光.木犀草素的体外抗炎机制研究[J].广州中医药大学学报,2007,24(3):231-234.
[12]Coleman JE.Structure and mechanism of alkaline phosphatase[J].Annn Rev Biophy Biomol Struct,1992,21:441-483.
[13]Arceo N,Sauk JJ,Moehring J,et al.Human periodontal cells initiatemineral-likenodulesinvitro[J].J Periodantol,1991,62(8):499-503.
[14]Tenorio D,Cruchley A,Haghes FJ.Immunocytochemical investigation of the rat cementoblast phenotype[J].J Periodont Res,1993,28(6):411-419.
[15]Dalle CarbonareL,Innamorati G,Valenti MT.Tramscription factor RUNX2 and its application to bone tissue engineering[J]. Stem Cell Rev,2012,8(3):891-897.
[16]Lee JH,Um S,Jang JH,et al.Effects of VEGF and FGF-2 on proliferation and differentiation of human periodontal ligament stem cells[J].Cell Tissue Res,2012,348(3):475-484.
[17]Park JC,Kim JM,Junq IH,et al.Isolation and characterization of human periodontal ligament(PDL)stem cells(PDLSCs)from the inflamed PDL tissue:in vitro and in vivo evaluations[J].J Clin Periodontol,2011,38(8):721-731.
Effects of Luteolinl on the Proliferation and Differentiation in Human Periodontal Ligament Cells
ZHANG Miao1,LIU Xiuhua2,ZHAO Hongyu3*
(1.Department of Stomatology,The Xinjiang Uygur Autonomous Region People's Hospital,Urumgi 830000,China;2.Key Laboratory of Natural Medicine and Immunology,Henan University;3.Guangdong Provincial Stomatological Hospital)
R781
A
1008-2344(2016)05-0340-04
10.16753/j.cnki.1008-2344.2016.05.006
2016-03-28
(吴迪 编辑)
赵红宇(1965—),女(汉),主任医师,研究方向:牙周病与全身性疾病的关系.zhongyu93@163.com

