非M3型急性髓系白血病细胞遗传学及分子生物学特征和预后分析
熊术道,胡林辉,蒲莲芳,丁洋洋,李曼曼,刘军,杨冬冬,王会平,张翠
(安徽医科大学第二附属医院血液科 血液病实验室 安徽医科大学血液病研究中心,安徽 合肥 230601)
非M3型急性髓系白血病细胞遗传学及分子生物学特征和预后分析
熊术道,胡林辉,蒲莲芳,丁洋洋,李曼曼,刘军,杨冬冬,王会平,张翠
(安徽医科大学第二附属医院血液科血液病实验室安徽医科大学血液病研究中心,安徽 合肥230601)
目的探讨和分析非M3型急性髓系白血病(AML)细胞遗传学及分子生物学特征以及预后影响因素。方法回归性分析99例非M3型初治AML患者临床及实验室数据,探讨和分析患者性别、年龄、初诊时白细胞数、血小板数、有无贫血、乳酸脱氢酶水平、染色体核型以及融合基因等因素对AML患者无疾病进展生存时间(DFS)及总体生存时间(OS)的影响。结果患者中位发病年龄为44岁(1~84岁),中位随访时间为12.6月(0.33~59.47月),化疗后达完全缓解(CR)率为62.7%,复发率为44.1%,不同年龄段患者CR率有明显差异(P=0.035);单因素及多因素分析显示老年及染色体数目异常为AML患者OS的独立预后不良因素,t(8,21)/inv(16)系其独立预后良好因素。结论老年及染色体数目异常为非M3型AML患者独立预后不良因素;t(8,21)/inv(16)是其独立预后良好因素。AML临床应结合年龄、细胞遗传学及分子生物学等预后因素进行预后评估,据此制定个体化治疗,对延长患者生存时间,提高生活质量,具有重要指导意义。
白血病,髓样,急性;核型;基因融合;危险因素;预后
急性髓系白血病(Acute myeloid leukemia,AML)是一类起源于髓系造血干/祖细胞的单克隆恶性血液病,其白血病细胞可大量增殖,广泛浸润肝、脾、淋巴结等各种组织器官,临床病程进展迅速,预后不良。近年来,尽管AML的诊疗取得了一定的进展,但是,除M3型之外的AML患者化疗完全缓解后容易复发,难于获得良好长期预后。研究表明,AML患者的年龄、白细胞数、血小板数、细胞遗传学和分子生物学等诸多因素可能与疾病预后相关[1]。因此,分析和探讨非M3型AML患者临床及实验室数据与预后的相关性,可能为该类AML临床治疗及预后评估提供相关线索和依据,对延长其长期生存时间以及提高生活质量可能具有重要的指导意义。
1 资料与方法
1.1研究对象选取2010年10月至2016年3月就诊于安徽医科大学第二附属医院血液内科及儿科血液病区初治AML(非M3型)患者99例。所有患者诊断均参照《白血病诊断及疗效标准》第3版[2]。其中,5例初治AML患者因病情进展快及经济等因素放弃治疗,本文仅对94例AML(非M3型)患者的临床及实验室数据进行进一步的疗效及预后相关分析。本研究获安徽医科大学第二附属医院伦理委员会批准,患者或近亲属对研究方案知情并签署知情同意书。
1.2临床及实验室数据收集收集入组患者的临床及实验室检查等相关数据,包括发病年龄、性别、初诊时血常规数据、血清乳酸脱氢酶水平、FAB分型、细胞遗传学以及分子生物学等实验室检测结果。
1.3临床治疗所有AML患者采用以阿糖胞苷为基础的IA或者DA方案(去甲氧柔红霉素6~8 mg·m-2或柔红霉素40 mg·m-2,1次/d×3 d,阿糖胞苷150 mg·d-1×5~7 d)进行诱导治疗。缓解后按原方案行巩固治疗,后予以强化维持治疗。
1.4疗效判断所有入组患者的疗效判断标准均参照《白血病诊断及疗效标准》第3版[2]。总体生存时间(overall survival,OS)定义为第一次诊断时间至死亡或者随访结束时间,失访病例则为失访日期。无疾病进展生存时间(disease free survival,DFS)定义为第一次诊断时间至第一次复发,死亡或随访结束时间,失访病例则为失访日期。随访时间截止为2016年5月24日。
1.5统计学方法采用SPSS19.0统计软件进行统计学分析,卡方检验用于率的比较,采用Kaplan-Meier生存曲线对OS以及DFS进行分析,采用Log-rank对预后影响因素进行单因素分析,多元COX回归模型进行预后多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1患者基本资料99例初治AML(非M3型)患者中,男性45例,女性54例,发病年龄1~84岁,中位44岁。儿童患者(≤14岁)24例,成人患者(15~59岁)49例,老年患者(≥60岁)26例(表1)。初诊中位白细胞数(WBC) 8.16×109·L-1[(0.55~629)×109·L-1],中位血红蛋白(Hb) 83.5 g·L-1(41~340 g·L-1),中位血小板计数(PLT)30×109·L-1[(5~212)×109·L-1]。细胞遗传学显示,99例入组患者中,62例患者骨髓检出染色体核型异常,检出率为62.6%。异常核型主要包括t(8,21)/inv(16) 24例,不含t(8,21)/inv(16)染色体结构异常的核型17例,不含t(8,21)/inv(16)染色体数目异常的核型10例,不含t(8,21)/inv(16)的结构以及数目均存在异常的复杂核型9例,正常核型37例。涉及到的染色体数目异常为-5、-7、+8、-14、-16、-17、-18、-20、+22、-Y;涉及到的染色体结构异常为t(16,21)、t(6,14)、del(9p)、del(6q)、del(5q)、del(8q)、del(11q)等。共有33例患者分子生物学检测出融合基因,其中AML-ETO检出率为20.2%,CBF-MYH11检出率为6%,MLL相关融合基因检出率为4%,HOX11检出率为4%,TLS-ERG检出率为2%(表1)。
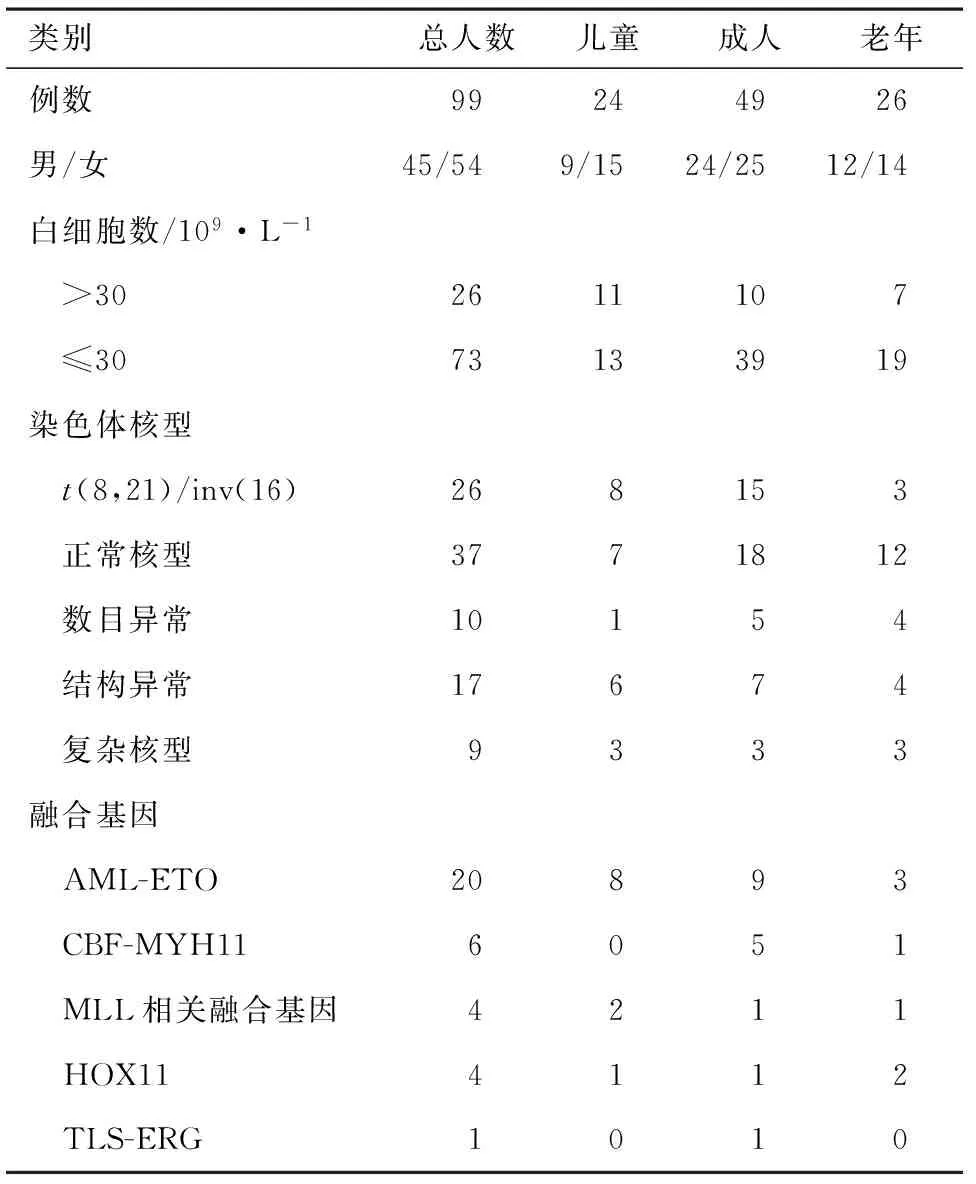
表1 AML患者一般临床及实验室资料
2.2患者FAB分型及细胞遗传学或分子生物学特征99例患者按FAB分型,其中M01例,M13例,M254例,M413例,M513例,M62例,未分类13例。M0中1例为染色体结构异常;M1中,2例为正常核型,1例为染色体数目异常;M2中,20例正常核型,2例染色体数目异常,8例染色体结构异常,5例复杂核型,19例t(8,21)异常,inv(16)1例;M4中,6例正常核型,2例染色体数目异常,1例复杂核型,4例inv(16);M5中,6例正常核型,2例染色体数目异常,4例染色体结构异常,1例复杂核型;M6中,2例染色体数目异常;未分类AML中,6例正常核型,1例染色体数目异常,4例染色体结构异常,2例复杂核型。
而入组的AML患者融合基因检查结果显示:M2中,AML-ETO阳性20例(其中1例细胞遗传学未检测出t(8,21)易位),HOX11阳性4例,CBF-MYH11阳性1例,TLS-ERG阳性1例(细胞遗传学未检测出t(16;21)(p11;q22)),MLL-AF6,MLL-AF10双阳性1例;M4中,CBF-MYH11阳性4例(其中1例细胞遗传学未检测出inv(16)),MLL-AF10阳性2例, CBF-MYH11,MLL-AF10双阳性一例;M5中,TLS-ERG阳性1例(细胞遗传学未检测出t(16;21)(p11;q22));M0、M1、M6以及未分类AML中未见融合基因异常。AML的FAB分型与细胞遗传学及分子生物学特征见表2。

表2 AML(非M3)的FAB分型与细胞遗传学及分子生物学特征/例
2.3疗效及预后分析99例初治AML患者中,只有94例全部完成诱导化疗(5例未完成诱导化疗的患者中,4例为M2患者,1例为未分类AML),中位随访时间为12.6月(0.33-59.47)。其中59例化疗后达到CR(CR率为62.7%),未缓解35例。26例患者复发,均为骨髓复发,复发率为44.1%。疗效分析显示,不同年龄段之间患者CR率存在明显差异,差异有统计学意义(P=0.035);而性别、白细胞数、染色体核型,血小板数等因素均与患者CR率无关(P=0.482,P=0.647,P=0.111,P=0.619)。
2.4相关预后单因素分析94例AML患者中位随访时间为12.6月,Kaplan-Meier分析显示,患者平均生存为(26.8±2.9)月,中位OS 24.0月,平均DFS (21.7±2.4)月,中位DFS 17.4月。随访过程中共有52例患者死亡,其中死于复发26例,死于疾病过程中发生的肺部感染,内脏出血,多器官衰竭等并发症患者26例。将患者按年龄划分为儿童,成人以及老年组,按染色体核型以及融合基因特征将患者划分为t(8,21)/inv(16)、正常核型、染色体结构异常核型、染色体数目异常核型、复杂核型,其中t(8,21)/inv(16)中包含染色体未检测出异常但有分子生物学改变的患者。Kaplan-Meier生存分析结果显示,儿童组的OS时间以及DFS时间最长,其次为成人组,最后为老年组,进一步分析显示,成人组与儿童组之间DFS时间以及OS时间无明显差异(图1)。AML伴t(8,21)/inv(16)患者OS时间以及DFS时间最长,其次为正常核型、染色体结构异常核型、复杂核型和染色体数目异常核型(图2)。而性别、初诊时白细胞数、血小板数、有无贫血以及乳酸脱氢酶水平对患者OS时间以及DFS时间均无影响(OS:P=0.117,P=0.754,P=0.281,P=0.261,P=0.525;DFS:P=0.126,P=0.319,P=0.186,P=0.463,P=0.512)。
2.5相关预后多因素分析将单因素分析中对OS以及DFS有影响的因素纳入多因素COX回归分析,年龄段中以老年组为基线水平,结果显示儿童组以及成人组的OS时间均较老年组长,而DFS时间并无差异;染色体核型分组中,以t(8,21)/ inv(16)为基线水平,结果显示染色体数目异常对OS以及DFS时间均存在影响(表3)。
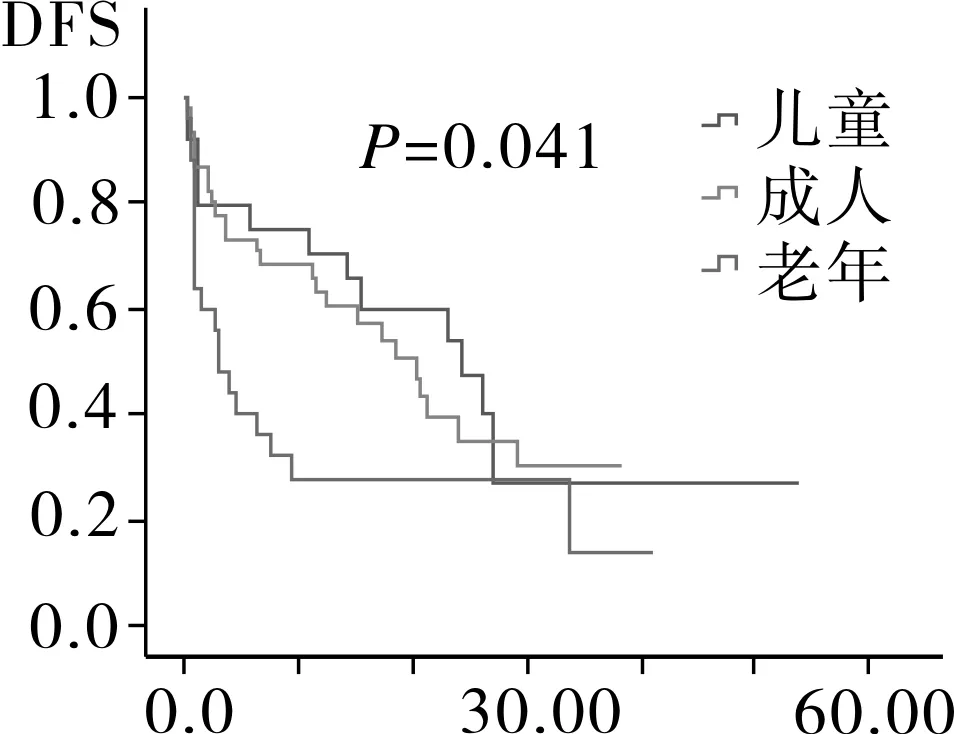
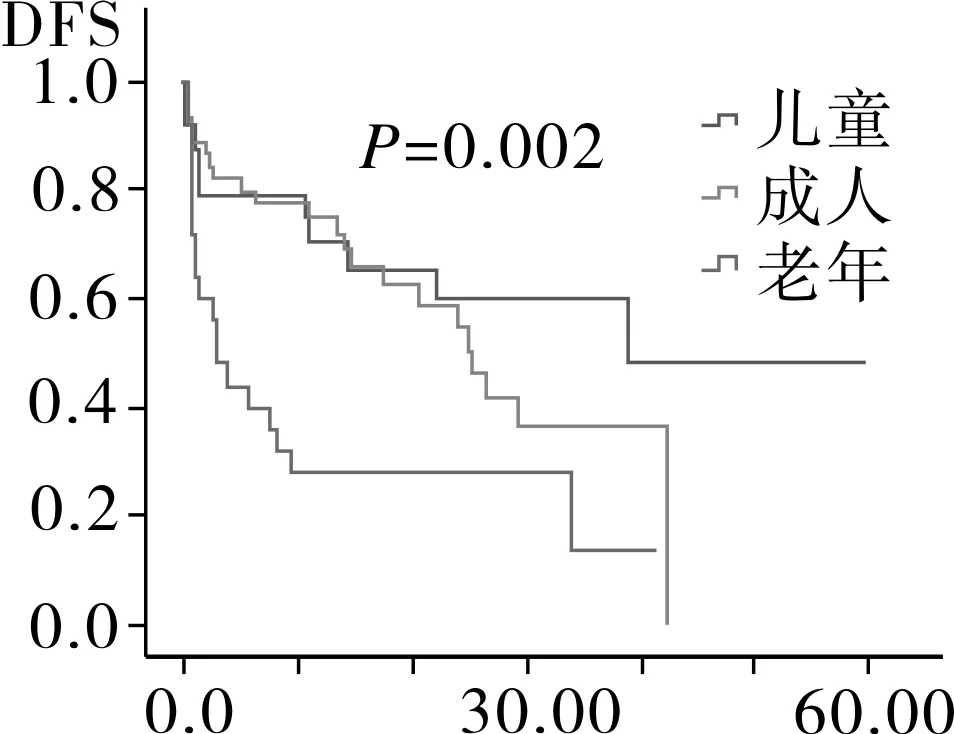
图1 不同年龄段AML患者DFS和OS生存分析

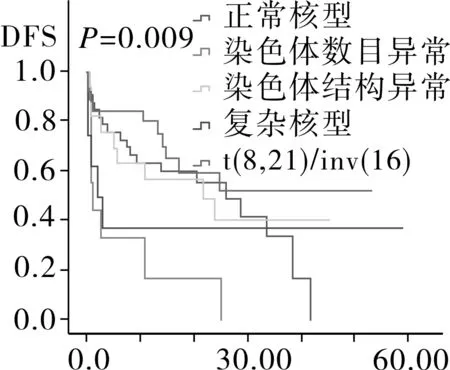
图2 不同染色体核型的AML患者DFS和OS生存分析

表3 影响AML患者总体生存时间多因素分析
注:Ref:基线水平分组。
3 讨论
AML除伴有t(15,17)即M3型具有靶向药物治疗且取得相对较好的临床疗效及预后外,其他类型AML并无明确的靶向药物,其临床治疗及预后受多种因素影响[3-5]。细胞遗传学及融合基因等分子生物学检查对AML分型诊断、治疗及预后意义重大[5-6]。本文发现,非M3型AML中,常见的遗传学及分子生物异常是t(8,21)/ AML-ETO(M2)及inv(16)/ CBF-MYH11(M4Eo),与他人研究报道类似[7-8]。值得注意的是,本文入组的AML患者中有4例分子生物学检发现异常,而相应染色体核型并未发现,据WHO分型标准[5],我们将具有分子生物学异常的患者划入相应染色体异常患者中做进一步研究。此外,本文还发现4例核型正常的AML(M2)患者检出HOX11基因高表达,2例发现TLS/ERG融合基因阳性(染色体核型未检出)。其原因可能为分子生物学敏感性较细胞遗传学高,也可能与染色体分散度、染色体显带技术及分析经验等因素有关[9]。因此,AML患者应该同时行全面的细胞遗传学及分子生物学检查,这样可扬长避短,相互补充,进而提高AML的分层诊断和预后评估水平。
预后方面,有研究表明,患者性别,血小板数与AML临床预后无明显相关性[10],但Klein等人发现性别及白细胞数对M2患者临床预后相关[11]。本研究未发现性别,血小板数与临床预后之间存在相关性。M2患者中,也未发现初诊白细胞数对其临床预后具有相关性。此外,AML患者有无贫血以及乳酸脱氢酶水平与临床预后之间的相关性本文也未发现。
年龄是AML患者长期预后的独立影响因素,老年AML患者获得CR的概率以及中位生存期较年轻患者明显低,其原因可能是老年患者体能状态差,高危细胞遗传学改变多见以及对化疗药物易产生耐药所致[12-14]。本文的疗效分析发现儿童组CR率最高,其次为成年组及老年组,其DFS和OS依次递减。多因素分析结果显示年龄是AML患者预后独立的影响因素,儿童较成人和老年人OS长,但成人与儿童之间OS以及DFS并无差异,其原因可能系年轻AML患者发病常伴随染色体结构易位以及融合基因的形成,而AML中常见的染色体易位及融合基因一般预示着较好的预后[15]。
研究显示,染色体核型对AML预后起着重要预示作用[11,16]。染色体核型可分正常核型,染色体结构异常核型,染色体数目异常核型以及复杂核型,其中结构异常核型中t(8,21)以及inv(16)被归入为预后良好核型,正常核型归入预后中等组,复杂核型归入预后不良组,而排除t(8,21)/inv(16)的数目异常及结构异常对预后的影响尚不明确[17]。为此本文研究了不同类型的核型对预后的影响,结果发现AML伴t(8,21)/inv(16)的OS以及DFS时间最长,其次依次为正常核型、染色体结构异常、复杂核型和染色体数目异常,分析结果显示染色体数目异常为AML独立的预后不良因素。
综上所述,AML(非M3)患者预后受多种因素影响,其中,年龄是AML患者预后的独立影响因素,年龄越小,预后越好;t(8,21)/inv(16)是独立良好的预后因素,而染色体数目异常为独立预后不良因素。因此,临床上应早期联合检查患者细胞遗传学以及分子生物学变化,并根据患者年龄、染色体核型、融合基因以及其他风险因素(有条件者,可检测预后相关基因突变)对患者进行预后分层,依此对不同患者进行个体化治疗,以延长患者长期生存时间,进一步提高生活质量。
[1]Fey M,Dreyling M.Acute myeloblastic leukemia in adult patients:ESMO clinical recommendations for diagnosis,treatment and follow-up[J].Ann Oncol,2009,20 (Suppl 4):100-101.
[2]张之南,沈悌.血液病诊断及疗效标准 [M].3版.北京:科学出版社,2007:106-115.
[3]Lallemand-Breitenbach V,de Thé H.Retinoic acid plus arsenic trioxide,the ultimate panacea for acute promyelocytic leukemia? [J].Blood,2013,122(12):2008-2010.
[4]张前鹏,韩永胜,皖湘.急性未分化白血病 2 例并文献复习[J].安徽医药,2016,20(2):350-351.
[5]DA Arber,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[6]Vardiman JW,Thiele J,Arber DA,et al.The 2008 revision of the World Health Organization(WHO) classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood,2009,114(5):937-951.
[7]Li X1,Li X,Xie W,et al.Comprehensive profile of cytogenetics in 2308 Chinese children and adults with de novo acute myeloid leukemia[J].Blood Cells Mol Dis,2012,49(2):107-113.
[8]Ruiz-Delgado GJ,Macías-Gallardo J,Lutz-Presno J,et al.Core binding factor acute myeloid leukemia(CBF-AML) in Mexico:a single institution experience[J].Rev Invest Clin,2011,63(1):25-30.
[9]熊术道,胡林辉,蒲莲芳,等.伴FUS/ERG融合基因急性白血病3例并文献复习 [J].临床荟萃,2015,30(10):1126-1129.
[10] Yang J,Yao DM,Ma JC,et al.The prognostic implication of SRSF2 mutations in Chinese patients with acute myeloid leukemia[J].Tumour Biol,2016,(Epub ahead of print).
[11] Klein K,Kaspers G,Harrison CJ,et al.Clinical impact of additional cytogenetic aberrations,cKIT and RAS mutations,and treatment elements in pediatric t(8;21)-AML:Results from an international retrospective study by the international Berlin-Frankfurt-Munster study group[J].J Clin Oncol,2015,33(36):4247-4258.
[12] Appelbaum FR,Gundacker H,Head DR,et al.Age and acute myeloid leukemia[J].Blood,2006,107(9):3481-3485.
[13] Nand S,Othus M,Godwin JE,et al.A phase 2 trial of azacitidine and gemtuzumab ozogamicin therapy in older patients with acute myeloid leukemia[J].Blood,2013,122(20):3432-3439.
[14] Achille NJ,Othus M,Phelan K,et al.Association between early promoter-specific DNA methylation changes and outcome in older acute myeloid leukemia patients[J].Leuk Res,2016,42:68-74.
[15] Grimwade D,Ivey A,Huntly BJ.Molecular landscape of acute myeloid leukemia in younger adults and its clinical relevance[J].Blood,2016,127(1):29-41.
[16] 张露露,夏海龙.急性髓系白血病预后相关因素分析[J].白血病·淋巴瘤,2015,24(2):105-110.
[17] Khaled S,Al Malki M,Marcucci G.Acute myeloid leukemia:Biologic,prognostic,and therapeutic insights[J].Oncology,2016,30(4):318-329.
Cytogenetics and molecular biology characteristics and prognosis of de novo non-M3acute myeloid leukemia
XIONG Shudao,HU Linhui,PU Lianfang,et al
(DepartmentofHematology/HematologicalLab,TheSecondAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230601,China)
ObjectiveTo investigate the changes of cytogenetics and molecular biology in patients with de novo non-M3acute myeloid leukemia(AML),and to explore the related factors of prognosis for AML patients.MethodsNinety-nine cases of newly diagnosed de novo non-M3AML were enrolled in this study.The relationship between disease free survival(DFS),overall survival(OS) and clinical and laboratory data of all AML patients,including gender,age,WBC counts,PLT counts,Hb values,LDH level,chromosome karyotype and fusion gene were retrospectively analyzed.ResultsThe median age of 99 patients with AML in this study was 44(1~84) years old.The median follow-up was 12.6(0.33~59.47) months,the total complete remission(CR) rate was 62.7% and relapse incidence was 44.1%.CR rate was influenced by factors such as age(P=0.035).Univariate and multivariate analyses showed that the factors including age and numerical abnormalities of chromosomes were the independent unfavorable prognostic factors while t(8,21)/inv(16) was an independent favorite one for OS in patients with de novo non-M3AML.ConclusionsBoth elderly patients and changed chromosome numbers are the independent poor prognostic factors in patients with de novo non-M3AML,while t(8,21)/inv(16) is an independent favorite one.So the patients with de novo non-M3AML should be treated with individual therapy according to the prognostic prediction,which then may prolong the survival time and improve the quality of life.
Leukemia,myeloid,acute;Karyotype;Gene fusion;Risk factors;Prognosis
国家自然科学基金(81272259)
10.3969/j.issn.1009-6469.2016.09.032
2016-04-18,
2016-06-12)

