刺参体内RNA干扰方法的初步研究
张宇鹏+田燚+宸帆+海龙+亚青

摘 要:以刺参溶菌酶基因(lysozyme gene, LYZ)为靶基因探索构建刺参体内RNA干扰体系。构建了3个刺参溶菌酶基因特异性的RNA干扰重组质粒,以刺参体腔液原代培养细胞为靶细胞进行筛选;分别以口腔注射和腹腔注射的方式以及不同的注射剂量对刺参LYZ进行体内RNA干扰,并运用qPCR技术测定刺参LYZ的表达量;最后,对刺参LYZ进行体内RNA干扰,并分别运用qPCR技术和比浊法测定刺参LYZ的表达量及其酶活性。结果显示:3种RNA干扰重组质粒的沉默效率分别为40%、45%、0%;体腔注射RNA干扰重组质粒时,各组织中LYZ的表达量均出现了显著的上升(P<0.05),而从口腔注射时,体腔液和肌肉中LYZ的表达量均出现极为显著的下降(P <0.01),而在管足中未出现明显变化;当其注射剂量为0.5 μg和5 μg时未对LYZ的表达产生有效的抑制作用;当注射剂量为10 μg和25 μg时,刺参体内LYZ的表达受到了明显抑制,但是注射剂量为25 μg时,部分刺参个体出现吐肠现象;在转染12 h后,刺参体腔液、肌肉、体壁、疣足和管足组织中LYZ的表达量开始下降,到第四天后开始回升。表明:只有从口腔注射RNA干扰重组质粒且注射剂量达到10 μg时才能有效地抑制靶基因的表达;刺参体内RNA干扰具有系统性,可以在各个组织间相互传导。
关键词:刺参;溶菌酶基因;RNA干扰
中图分类号:S917.1
文献标识码:A
RNA干扰(RNA interference)是指双链RNA(dsRNA)在细胞内特异性的诱导与之同源互补的mRNA的降解,从而使相应基因的表达关闭,最终引发基因转录后水平沉默的现象(PTGS)[1-3]。到目前为止,RNA干扰是最准确和有效的在“体外”和“体内”条件下抑制特异基因表达的方法[4]。现在,RNA干扰技术被越来越广泛地应用于水生动物基因组学的研究中。Genciana Terova等[5]利用dsRNA和shRNA抑制肌肉生长抑制素(MSTN)的表达,从而验证该基因的功能。Liu等[6]使用dsRNA使QM表达沉默,表明QM对于凡纳滨对虾和太平洋白虾的主动防御起到了正向调节作用。在进行体内RNA干扰时,可以通过浸泡、饲喂和注射等方式将人工构建的RNA干扰序列导入实验动物体内。Genciana Terova等[5]分别通过电脉冲和注射的方式成功地将dsRNA和shRNA导入海鲈体内。Naoki等[7]的研究表明动物体内RNA干扰存在剂量和时间依赖性的效应。
刺参(Apostuchopus japonicas)具有较高的经济价值和药用价值[8],是目前中国水产养殖业的主要养殖品种之一。但是,近年来刺参细菌性和病毒性病害屡屡大面积发生,给养殖业者带来了巨大损失[9-10]。故提升刺参养殖业者的防病和治病能力显得愈发迫切。溶菌酶是生物体内极为重要的一种非特异性免疫因子,在机体免疫过程中不仅能催化水解细菌细胞壁而导致细菌溶解死亡[11-12],还可诱导其他免疫因子。水生动物血清溶菌酶活力的高低是衡量机体免疫状态的指标之一。血清溶菌酶活力提高,其免疫能力也相应提高[13]。Nermeen M Abu-Elala等[14]使用生物活性免疫增强剂-壳源壳聚糖刺激尼罗罗非鱼(Oreochrmis niloticus),吞噬活性/指数、NBT、溶菌酶活性及ACH50等免疫参数均显著上升,且对嗜水气单胞菌的抗感染能力增强。Patrizia Pagliara等[15]使用高浓度锌处理海胆(Paracentrotus lividus)后,溶菌酶活性等免疫指标出现短暂下降,同时抗溶藻弧菌V. alginolyticus活性也相应下降,表明海胆的免疫力下降。
本研究以刺参溶菌酶基因的cDNA序列为依据,设计用于RNA干扰的miRNA前体序列,分析不同注射方式和注射剂量条件下刺参溶菌酶基因的表达量变化,为构建刺参体内RNA干扰体系提供参考依据。
1 材料与试剂
1.1 实验材料
实验用刺参取自辽宁省大连市东北部海域,暂养于水槽内,饲养温度为12~16℃,饲料为海参配合饲料。
1.2 主要实验试剂
大肠杆菌感受态细胞和壮观霉素购自美国Sigma公司;无内毒素质粒大提试剂盒购自北京天根公司,Entranster-in vivo转染试剂购自北京英格恩公司,Trizol总RNA提取试剂购自Life Technologies公司,EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒购自北京全式金生物技术有限公司,SYBR Premix Ex TaqTMII购自大连宝生物工程有限公司, BLOCK-iT Pol II miR RNAi Expression Vector Kit with EmGFP 均购置于Invitrogen公司,HQ高纯度质粒抽提试剂盒购置Invitrogen公司。引物合成和测序由上海生工生物工程股份有限公司完成。
2 方法与操作
2.1 刺参溶菌酶基因miRNA干扰前体序列及主要引物的设计
根据刺参溶菌酶基因(GenBank: KF773759.1)序列设计刺参溶菌酶基因的miRNA干扰前体序列。设计所得序列见表1。
2.2 刺参溶菌酶基因RNA干扰重组质粒的构建
将合成的寡聚单链DNA退火连接成双链DNA,然后将退火的双链DNA与RNA干扰载体按下列体系在室温连接30 min构建RNA干扰重组质粒:5×ligation buffer 4 μL、pcDNA6.2-GW/EmGFP 2 μL、ds oligo(10 nm) 4 μL、T4 DNA ligase(1 U/μL)1 μL、ddH2O 9 μL。接下来将连接产物转化到大肠杆菌感受态细胞中并涂布于含壮观霉素的LB固体培养基上于37 ℃恒温过夜培养至平板上有可见菌落。最后,挑取一个单菌落放入1.5 mL离心管中(试管内有1 mL含壮观霉素的LB液体培养基),于200 r/min、37 ℃培养箱中摇菌过夜培养。运用PCR技术对菌液进行检测后选取含正确条带的阳性克隆菌液送上海生工公司测序。
2.3 制备RNA干扰重组质粒
在含壮观霉素的LB培养基中接种目标菌株,于37 ℃摇床200 r/min振荡培养 16 h,按照北京天根公司的质粒提取试剂盒的说明书提取质粒,完成后将质粒置于-20℃保存以用于后续试验。
2.4 RNA干扰重组质粒的筛选
转染前一天将刺参体腔液原代培养细胞以5×106个/mL 浓度接种于24孔板中。转染前换用1 mL无血清和抗生素的LB液体培养基。每孔加入的转染复合物体积为18 μL,其中含2 μg RNA干扰重组质粒、2 μL Lipofecter脂质体转染试剂和相应体积的待用培养液。接下来将细胞在37 ℃恒温培养箱中培养4~6 h后,换上含抗生素的完全培养液,放置在37 ℃的恒温培养箱中继续培养,每24 h更换一次培养液。在细胞瞬时转染48 h后,提取细胞样品中的总RNA用于测定溶菌酶基因的表达量,所用引物如表2所示。qPCR反应体系的总体积为20 μL且各组分的体积如下:SYBR 10 μL,Primer F/R 各0.8 μL,ROX 0.4 μL,cDNA 1 μL,ddH2O 7 μL;反应条件如下:预热阶段为95 ℃,30 s,PCR反应阶段共40个循环分别为95 ℃,5 s、60 ℃,32 s,获得熔解曲线阶段为95 ℃,15 s,60 ℃,60 s,95 ℃,15 s,60 ℃,15 s。
2.5 刺参体内RNA干扰方法的探索
2.5.1 刺参体内RNA干扰的最佳注射方式 选取生长一致、健康状况良好的刺参随机分为5组,每组3头,使用250 μL规格的微量进样器注射RNA干扰重组质粒,每头刺参的注射剂量为0.625 μg/g。其中:第一、二组为实验组,第一组为体腔注射RNA干扰重组质粒miRNA-2,第二组为口腔注射RNA干扰重组质粒miRNA-2;第三、四组为阴性对照组,第三组以体腔注射阴性对照质粒,第四组以口腔注射阴性对照质粒;第五组为空白对照组,未做任何处理。注射48 h后,提取刺参体腔液、管足和肌肉组织的总RNA,使用qPCR技术检测刺参溶菌酶基因的相对表达量。
2.5.2 刺参体内RNA干扰的最佳注射剂量 选取生长一致、健康状况良好的刺参随机分为6组,每组3头,第一、二、三和四组为实验组,第五组为阴性对照组,第六组为空白对照组。均以口腔注射的方式将转染复合物注射进入刺参体内。其中,第一组每头刺参注射0.5 μg RNA干扰重组质粒miRNA-2,第二组每头刺参注射5 μg RNA干扰重组质粒miRNA-2,第三组每头刺参注射10 μg RNA干扰重组质粒miRNA-2,第四组每头刺参注射25 μg RNA干扰重组质粒miRNA-2,第五组每头刺参注射等体积的阴性对照质粒,第六组刺参不做任何处理。注射48 h后,分别提取各实验组刺参体腔液、管足和肌肉组织的总RNA,使用qPCR技术检测溶菌酶基因的相对表达量。
2.5.3 刺参体内RNA干扰的时间效应 选取生长一致、健康状况良好的刺参随机分为7组,每组3头,用250 μL微量进样器以口腔注射的方式注射RNA干扰重组质粒。其中:第一、二组分别为空白对照组和阴性对照组,每头刺参分别注射等体积的PBS和10 μg阴性对照质粒,然后提取刺参各组织总 RNA;第三至七组为实验组,每头刺参分别注射10 μg RNA干扰重组质粒miRNA-2,依次于12、24、48 h及4 d和8 d后提取各组织用于后续实验。最后,应用qPCR技术检测溶菌酶基因的相对表达量,并使用溶菌酶活性检测试剂盒检测各组织样品中的溶菌酶活性(具体操作见南京建成生物科技有限公司的产品说明书)。
2.6 数据处理
基因相对表达量的计算采用2-ΔΔCT法。溶菌酶基因的表达量是与内参基因CYTB相比的相对表达量。△△CT=(待测样品目的基因CT的平均值-待测样本内参基因CT的平均值)-(对照样品目的基因CT的平均值-对照样本内参基因CT的平均值)。基因的表达量F=2-△△CT ,目标基因的干扰效率为1-2-△△CT。
此外,溶菌酶活性按下述公式计算:
待测样本蛋白浓度(g/L)= [(测定OD值-空白OD值)/(标准OD值-空白OD值)]
×标准品浓度(0.563 g/L)
溶菌酶的活力(U/mL)=(空白OD值-测定OD值)×1 000×稀释倍数
溶菌酶的比活(U/mg)=测试物溶菌酶活力(U/mL)/测试物蛋白浓度(mg/mL)
3 实验结果
3.1 RNA干扰重组质粒的鉴定与测序
将转化至感受态大肠杆菌中的RNA干扰重组质粒进行普通PCR检测后,使用琼脂糖凝胶电泳观察片段长度,电泳图显示目的片段长度与预期一致,282 bp(图1 );为进一步检测插入RNA干扰重组质粒中的DNA片段是否为相应的目的片段及插入方向是否正确,将菌检正确的菌样送至生工公司测序,结果表明各个RNA干扰重组质粒中插入的DNA片段均为正确的目的片段且插入方向正确(图2 )。
3.2 溶菌酶基因特异性的RNA干扰重组质粒筛选结果
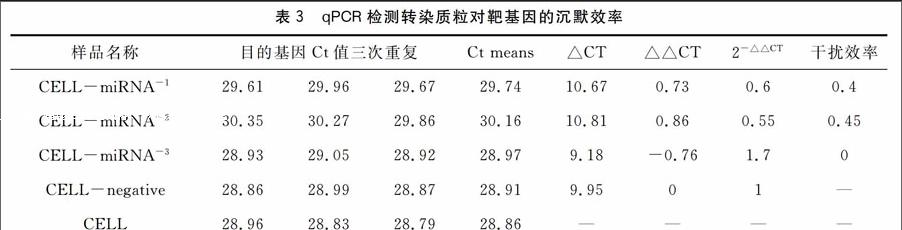
将溶菌酶基因特异性的RNA干扰重组质粒转染到培养的刺参体腔液原代细胞48 h后,收集细胞并提取总RNA进行qPCR检测。3种RNA干扰重组质粒对溶菌酶基因的沉默效率分别为40 %、45 %、0 %(见表3)。
3.3 刺参体内RNA干扰的最佳注射方式
为了探索刺参体内RNA干扰时RNA干扰重组质粒的最佳注射方式,运用qPCR技术对分别从刺参口腔和腹腔注射RNA干扰重组质粒48 h后的刺参各组织样品中溶菌酶基因表达量进行检测。结果如图3所示:从体腔注射RNA干扰重组质粒后,各组织中溶菌酶基因表达量均出现了显著的上升;而从口腔注射RNA干扰重组质粒后,体腔液和肌肉中溶菌酶基因表达量均出现非常显著的下降,而管足中溶菌酶基因表达量略微上升。
3.4 刺参体内RNA干扰的最佳注射剂量
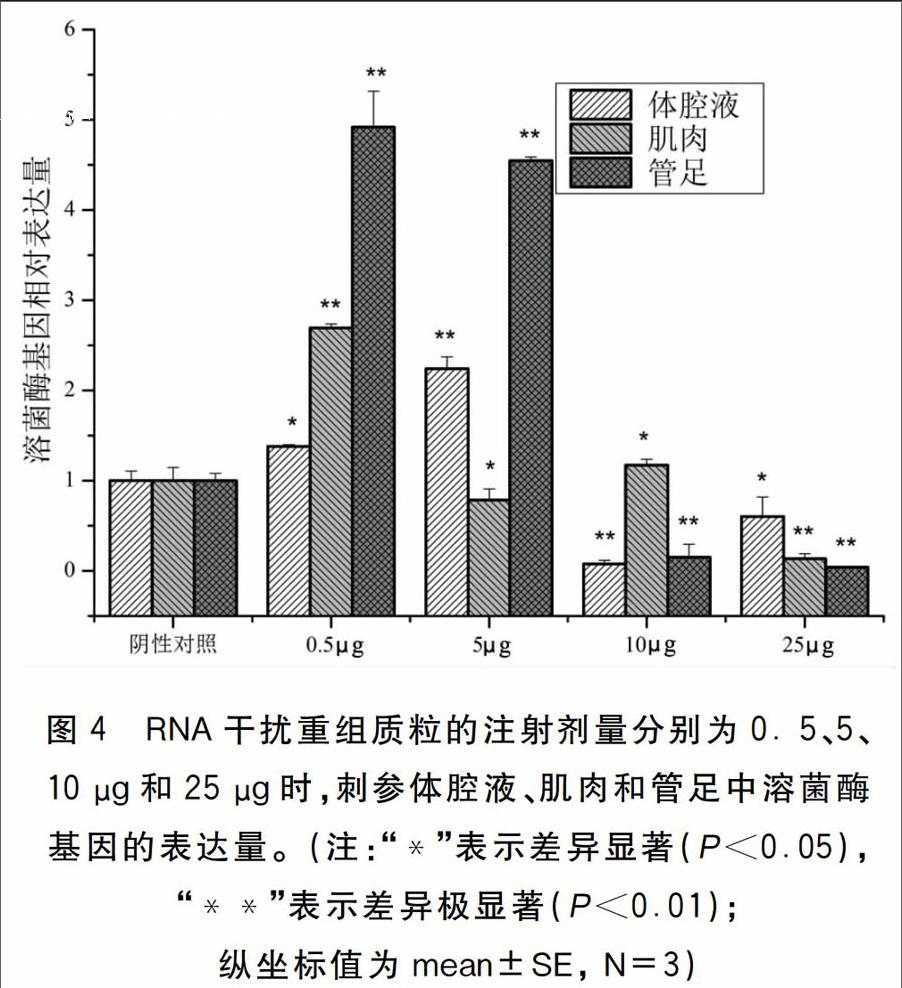
为确定RNA干扰重组质粒的最佳注射剂量,分别以口腔注射的方式给各实验组刺参注射不同剂量的RNA干扰重组质粒。结果如图4所示:注射剂量为0.5 μg时刺参各组织中溶菌酶基因表达量均出现显著上升(P<0.05);注射剂量为5 μg时管足和体腔液中的溶菌酶基因表达量出现极为显著的上升(P<0.01),而在肌肉的表达量则显著下降(P<0.05);注射剂量为10 μg时,管足、肌肉和体腔液中溶菌酶基因表达量均出现显著地下降(P<0.05);注射剂量为25 μg时,管足、肌肉和体腔液中溶菌酶基因表达量亦出现显著下降(P<0.05),且刺参个体中出现吐肠现象。
3.5 刺参体内RNA干扰的时间效应
为探索刺参体内RNA干扰在其各个组织中的表达模式,使用 RNA干扰重组质粒miRNA -2对刺参进行体内RNA干扰,以口腔注射的方式将其注射进入刺参体内,分别在转染后12、24、48 h、4 d和8 d提取刺参体腔液、肌肉、体壁、疣足和管足组织样品测定其mRNA表达量和溶菌酶活性,计算每个实验组3个平行样品的平均值并作图,结果如图5所示:体腔液中溶菌酶基因的表达量在前48 h呈下降趋势,之后其表达量快速上升,而其酶活性却持续下降;肌肉中溶菌酶基因的表达量呈阶梯下降并在48 h达到最小值0.1,之后逐步回升,而其酶活性呈波动式变化并在12 h达到最大值468 U/mL;体壁中溶菌酶基因表达量及其酶活性的变化趋势基本一致,分别在12 h达到最大值1.4和245 U/mL,之后呈下降趋势;疣足中溶菌酶基因表达量及其酶活性在前48 h未出现显著变化,分别在48 h达到其最小值,之后其表达量开始逐步回升;管足中溶菌酶基因的表达量在12 h显著上升(P< 0.05),在48 h其表达量达到最小值0.18,之后逐步回升而其酶活性在12 h达到最大值,之后逐渐下降。
4 讨论
自1998年Fire和Mello发现了RNA干扰现象以来[3],RNA干扰技术已经被广泛应用于癌症研究、抗病毒及基因功能研究等众多领域。随着RNA干扰技术的逐渐成熟,近年来RNA干扰技术在水产动物研究中的应用逐渐增多。本研究旨在刺参中探索建立一种稳定的RNA干扰技术,以帮助研究人员进行刺参基因功能研究及抗病毒等方面的研究。
在动物机体中,RNA干扰质粒可以用电穿孔导入和液体动力注射导入静脉、皮下及肌肉等方法导入体内[16]。Genciana Terova等[5]用肌肉注射然后使用电脉冲仪导入的方法成功介导了RNA干扰使靶基因沉默。而Liu等[6]通过在太平洋白虾和凡纳滨对虾腹部注射的方法成功介导RNA干扰使QM沉默,证明QM对于凡纳滨对虾和太平洋白虾的主动防御起到了正向调节作用。在本研究中,分别从刺参的体腔和口腔注射RNA干扰重组质粒以介导RNA干扰使溶菌酶基因沉默,结果表明:体腔注射的方法未能成功介导RNA干扰使溶菌酶基因沉默,而通过口腔注射则可以成功介导RNA干扰使溶菌酶基因沉默,体腔液和肌肉等组织中的溶菌酶基因表达量出现了极为显著的下降。
以往的研究表明:RNA干扰对靶基因的抑制效率具有一定的剂量依赖效应[17]。Naoki等[7]给小鼠尾静脉注射不同剂量的pu6-stem21 RNA干扰重组质粒后发现随着质粒DNA剂量的增加,RNA干扰的沉默效率逐渐提高。此外,何国平等[18]将外源报告基因和编码短发夹RNA的质粒共转染HEK293H细胞,结果表明:在一定范围内,RNA干扰载体介导的抑制效应与干扰载体剂量大小有关,当剂量加大到足以抑制外源基因表达时,抑制效应则维持在一“平台期”。由此,从刺参口腔注射不同剂量的RNA干扰重组质粒,结果发现:当RNA干扰重组质粒的注射剂量为0. 5 μg和5 μg时,刺参体腔液、肌肉和管足中溶菌酶基因的表达量显著上升,这与Naoki等[7]的实验结果基本一致,即RNA干扰重组质粒的注射剂量过低时,其靶基因的表达不仅未受到抑制,相反其表达量出现显著上升,可能是由于靶基因的mRNA未被充分地降解并在细胞自身的调节下大量转录靶基因mRNA予以补充,接下来随着质粒DNA剂量的增加,RNA干扰的沉默效率逐渐提高,但是,当RNA干扰重组质粒剂量为25 μg时,RNA干扰重组质粒介导的抑制效应未出现显著提升且刺参出现吐肠现象,初步推测是由于RNA干扰质粒剂量过大导致刺参出现了强烈的应激反应,从而削弱了RNA干扰重组质粒的抑制效应。
研究表明:在体内和体外RNA干扰中,RNA干扰具有时间依赖性。Naoki等[7]对小鼠的体内RNA干扰实验显示:在注射RNA干扰重组质粒6 h后靶基因的表达量才开始下降;而何国平等[18]进行的体外RNA干扰实验显示:EGFP mRNA表达水平在6 h无变化,直到12 h后才出现微弱的降低,表明细胞内siNRAs生成需要一定时间诱导表达。在本实验中,注射RNA干扰重组质粒后12 h,溶菌酶基因表达量上升,之后其表达量下降,表明转染12 h后,刺参体内开始产生有效的RNA干扰效应,而12 h时溶菌酶基因表达量上升可能是在注射时刺参体内产生应激反应。此外,RNA干扰效应在不同组织之间的传递是RNA干扰系统性发生的决定性因素。以前的研究表明,RNA干扰的系统性在不同物种中是不一样的[19]。某些甲壳动物和线虫的RNA干扰效应能够系统性发生[20-21],而果蝇的 RNA 干扰效应则不能系统性发生[19]。本研究发现,不同注射部位能够引起不同的RNA干扰效应-体腔注射不会引发RNA干扰效应:从体腔注射RNA干扰重组质粒时只在个别组织如管足中引发RNA干扰效应,而从口腔注射则能够系统性地在刺参各个组织中引发RNA干扰效应;在刺参体内RNA干扰的时间效应实验中,注射RNA干扰重组质粒12 h后,刺参管足中溶菌酶基因的表达量持续下降,而其酶活性下降后从24 h开始逐步回升,与体腔液中溶菌酶基因的表达量变化趋势基本一致。通过对刺参的解剖实验表明:管足和疣足等组成刺参的水管系统,管足中的体液来自体腔液和疣足。推测体腔液和疣足中合成的溶菌酶通过体液循环到达管足,从而导致管足中溶菌酶活性上升。
综上所述,当RNA干扰重组质粒的注射剂量为10 μg且从口腔注射时能够在刺参体内引发有效的RNA干扰效应,该RNA干扰效应具有系统性即能够在不同组织之间的传递,且RNA干扰重组质粒介导的刺参体内RNA干扰最长能持续4 d左右。
参考文献:
[1]Zammore P D, Tuschl T, Sharp P A, et a1. RNAi:double-stranded RNA directs the ATP- dependent cleavage of Mrna at 21 to 23 nucleotide intervals[J]. Cell. 2000, 10l(1): 25-33
[2] Bernstein E; Caudy A A; Hammond S M. Role for a bidentate rebonuclease in the initiation step of RNA entergerence[J]. Nature, 2001,409(6 818): 363-366
[3] Fire A. Xu S. Montgomery M K. et a1. Potent and specific genetic interference by double- stranded RNA in Caenorhabditis elegans [J]. Nature, 1998, 391(6669): 806-811
[4] Shim, M. S., & Kwon, Y. J. Efficient and targeted delivery of siRNA in vivo[J]. FEBS Journal,2010, 277:4814–4827
[5] Genciana Terova, Simona Rimoldi, Giovanni Bernardini, Marco Saroglia. Inhibition of Myostatin Gene Expression in Skeletal Muscle of Fish by In Vivo Electrically Mediated dsRNA and shRNAi Delivery[J]. Mol Biotechnol.2013, 54:673–684
[6] Yongjie Liu, Zhaoying Qian, Rongfeng Qu , et a1. Molecular characterization, immune responsive expression and functional analysis of QM, a putative tumor supperssor gene from the Pacific white shrimp, Litopenaeus vannamei[j]. Fish & Shellfish Immunology 2014 (37) : 1-10
[7] Naoki Kobayashi, Yumi Matsui, Atsushi Kawase,et al. Vector-Based in Vivo RNA Interference: Dose- and TimeDependent Suppression of Transgene Expression [J]. The journal of pharmcology and experimental therapeutics,2004,308(2): 688-693
[8] 樊绘曾. 海参: 海中人参-关于海参及其成分保健医疗功能的研究与开发[J].中国海洋药物, 2001 (4):37-44
[9] 王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析[J]. 中国水产科学, 2006, 13(4): 610-616
[10] 张春云, 王印庚, 荣小军. 养殖刺参腐皮综合征病原菌的分离与鉴定[J]. 水产学报, 2006, 30(1): 118-123
[11] Mori K, Nakanishi T, Suzuki T, et al. Defense mechanisms in invertebrates and fish[J]. Tanpa- kushitsu Kakusan Koso, 1989, 34(3): 214-223
[12] Boman H G, Faye I, Gudmundsson G H, et al. Cell-free immunity in cecropia. A model system for antibacterial proteins[J]. Eur J Biochem, 1991, 20(1): 23-31
[13] 郑清梅, 吴悦全, 叶星. 水生动物溶菌酶的研究进展[J]. 上海水产大学学报, 2006, 15(4): 484-486
[14] Nermeen M Abu-Elala; Samah H Mohamed; Manal M Zaki; Alaa E Eissa. Assessment of the immune-modulatory and antimicrobial effects of dietary chitosan on Nile tilapia (Oreochrmis niloticus) with special emphasis to its bioremediating impacts[J] . Fish & shellfish immunology , 2015 , 8(4):678-685
[15] Patrizia Pagliara ; Loredana Stabili. Zinc effect on the sea urchin Paracentrotus lividus immunological competence[J]. Chemosphere,2012, (89):563-568
[16] 陈芸, 朱作言. RNA干扰在抗病毒研究中的应用[J]. 水生生物学报, 2006, 30(3): 356 -359
[17] Gruber J, Manninga H, Tuschl T, et a1. Specific RNAi mediated gene knockdown in zebrafish cell lines [J]. RNA Biology, 2005(2):101- 105
[18] 何国平,张思仲,王英成,等. 短发夹RNA介导RNA干扰的时间和剂量效应研究[J].生物化学与生物物理进展, 2005, 32(3):258-267
[19] 董超华. 软体动物毛蚶 RNA干扰技术的应用研究[J]. 中国农学通报 2012, 28(23): 113-117
[20] Robalino J, Bartlett T, Shepard E, et al. Double-stranded RNA induces sequence -specific antiviral silencing in addition to nonspecific immunity in a marine shrimp: convergence of RNA interference and innate immunity in the invertebrate antiviral response[J]. Journal of virology,2005,79:13561-13571
[21] Hunter C P, Winston W M, Molodowitch C, et al. Systemic RNAi in Caenorhabditis elegans[J].Cold Spring Harbor symposia on quantitative biology, 2006, 71: 95-100
(收稿日期:2016-05-19;修回日期:2016-05-23)

