支链氨基酸影响猪免疫功能的研究进展
董小英,李均祥,任晓强,唐胜球*
(1.韶关学院英东农业科学与工程学院,广东韶关512005;2.韶关学院粤北生猪生产及疾病防控协同创新发展中心,广东韶关512005;3.韶关学院英东生命科学学院,广东韶关512005)
综述
支链氨基酸影响猪免疫功能的研究进展
董小英1,2,李均祥3,任晓强1,唐胜球1,2*
(1.韶关学院英东农业科学与工程学院,广东韶关512005;2.韶关学院粤北生猪生产及疾病防控协同创新发展中心,广东韶关512005;3.韶关学院英东生命科学学院,广东韶关512005)
支链氨基酸(BCAAs)作为猪体内的必需氨基酸,具有营养支持、调节免疫、促进分泌和参与代谢等多种重要的生物学功能。本文主要就支链氨基酸影响猪免疫功能的新近成果作一综述,并初步探讨其作用机理,以期为相关研究提供科学参考。
支链氨基酸;猪;免疫功能;机理
支链氨基酸(BCAAs)又名分支氨基酸,是指一组化学结构类似,在α-碳上含有分支脂肪烃链的中性氨基酸,为亮氨酸(Leu)、异亮氨酸(Ile)与缬氨酸(Val)三者的统称。研究证实,BCAAs均不能在人和动物体内自身合成,必须由外界食物供给,是机体维持正常生命功能和生长发育所必需的氨基酸,在机体中具有提供能量、营养支持、调节免疫,以及促进激素分泌、参与蛋白合成和生理代谢等多种重要的生物学功能(刘春生等,2006;Harris等,2005)。BCAAs作为唯一在肝外代谢的氨基酸,主要分布在骨骼肌,约占骨骼肌蛋白质中必需氨基酸的35%,是体内氨基酸系统供能的重要来源。本文主要就BCAAs的免疫调节机制及其在提高猪免疫功能上的应用进行概述。
1 BCAAs调节免疫功能的机理
1.1影响免疫细胞功能动物机体的免疫系统由免疫组织、免疫器官、免疫细胞及免疫活性分子等组成,具有免疫监视、防御与调控等生理作用,能及时发现并清除异物、外来病毒或病原微生物等引起内环境波动的因素。BCAAs之所以能有效调节动物机体的免疫功能,其机理之一就是该类氨基酸为维持淋巴细胞敏感性与免疫细胞功能所必需的功能物质,可直接影响到免疫器官细胞的发生、分化、发育与成熟。免疫学研究指出,补充BCAAs可提高骨骼肌中该类氨基酸的能量代谢,同时促进其向谷氨酰胺转变;而谷氨酰胺是淋巴细胞和嗜中性粒细胞发挥正常功能的重要能源物质,可间接提高白细胞与淋巴细胞的增殖性能,以改善机体免疫作用(Negro等,2008)。
研究发现,动物摄入BCAAs不足可导致体内免疫球蛋白水平升高,引起免疫功能异常亢进,进而对自身器官或组织产生伤害,严重时可导致胸腺与脾脏等免疫器官萎缩,淋巴组织明显受损;现已证实,缬氨酸在免疫球蛋白中所占的比重较其他氨基酸都高,若动物体内缺乏该氨基酸还会导致补体C3和运铁蛋白水平急剧降低,显著抑制胸腺与外周淋巴组织的正常生长发育,并抑制嗜酸性粒细胞及嗜中性粒细胞的增殖分化,甚至出现淋巴细胞功能严重耗竭的后果(陈熠等,2008)。还有文献报道,缬氨酸具有促进骨骼T细胞转化为成熟T细胞的作用(徐琪寿,1996;Petro等,1981)。Dunshea等(2005)利用细胞培养研究发现,亮氨酸是淋巴细胞合成蛋白、DNA、RNA和分化应激反应所必需的;经鼠的在体试验表明,亮氨酸还能限制机体免疫功能多方面消弱,加强病原体的受损伤程度。
此外,靳继德等(2001)报道,适量增加BCAAs摄入有助于改善创伤后机体的营养代谢状况,可有效增强免疫防御功能,并能促进小肠黏膜细胞的增殖。最近研究发现,在饮水中添加0.5%或2.5%异亮氨酸可提高鼠血清抗氧化能力,促使脾脏脾小结增大、增多,还能增厚动脉周围的淋巴鞘,并且淋巴细胞的排列更为密集(宫碧霜等,2015)。
1.2调节免疫因子活性BCAAs参与机体免疫机能的生理调节,其作用机制还与它促进免疫因子活性具有密切关系。陈熠等(2008)报道,BCAAs可通过影响免疫活性物质中免疫球蛋白的形成或活性等途径,以实现对机体免疫功能的调控作用。如缬氨酸缺乏会显著阻碍胸腺与外周淋巴组织细胞的正常生长,进而抑制嗜中性白细胞的增殖,可明显降低免疫球蛋白水平、补体C3和运铁蛋白的水平(Calder,2006;Petro等,1981;Chevalier等,1977)。然而,Petro(1980)在研究BCAAs影响小鼠血中免疫球蛋白、补体C3及运铁蛋白水平时发现,BCAAs中任何一种氨基酸缺乏均可使免疫球蛋白水平有所升高,而补体C3仅受异亮氨酸缺乏的影响,运铁蛋白对支链氨基酸缺乏却不敏感,但异亮氨酸缺乏可降低小鼠腹腔渗出液中的运铁蛋白水平;此外,当给动物接种热处理过的伤寒沙门氏菌后,缬氨酸缺乏可使补体C3、血凝集素、运铁蛋白水平显著下降,亮氨酸缺乏仅使补体C3水平明显下降,而异亮氨酸缺乏却无显著影响。Calder(2006)报道,小鼠缺乏亮氨酸可使补体C3水平降低,缺乏异亮氨酸还能使动物腹腔渗出液中运铁蛋白水平下降。另有研究证实,腹腔注射缬氨酸可增加绵羊红细胞免疫后的脾免疫球蛋白M(IgM)分泌细胞数(Belokrylov等,1990)。
黄红英等(2007)报道,与对照组相比,在泌乳母猪日粮中添加BCAAs可极显著提高仔猪血清中免疫球蛋白G(IgG)的浓度(P<0.01),研究结果揭示在母猪日粮中添加BCAAs能通过母体效应影响仔猪的生长发育与免疫功能,且其作用效果与添加水平有密切关系。研究证实,IgG是动物自然感染和人工主动免疫后机体产生的主要抗体,在体内可发挥抗菌、抗病毒、抗毒素等免疫学功能(陶义训,1999)。还有试验指出,在母猪日粮中添加缬氨酸,可显著提高其泌乳第10、18 d血清白蛋白浓度(P<0.05),同时增加血清IgM和IgG浓度,减少腹泻发生率(陈熠等,2009)。
2 BCAAs对猪免疫功能的影响
2.1提高母猪免疫力多年来的研究显示,BCAAs对于母猪免疫功能具有重要的生理学意义。黄红英等(2008)研究发现,在哺乳母猪饲粮中添加BCAAs,可显著提高仔猪血清中白蛋白、血糖水平及乳酸脱氢酶活性,明显降低血清尿素氮含量,同时显著增加仔猪血清IgG浓度,明显减少腹泻率,说明BCAAs可通过母体效应,对提高仔猪的免疫力、抗贫血和促进生长等方面产生积极作用。而王勇(2010)在哺乳母猪日粮中添加适量缬氨酸时发现,与对照组相比,处理组可提高母猪哺乳14 d和21 d血液中淋巴细胞和白细胞个数,以及7 d血液中淋巴细胞个数(P<0.05),同时提高哺乳14 d血清中IgG和补体C3水平(P<0.05)以及21 d母猪血清中补体C3和补体C4含量(P<0.01);此外,还能提高母猪血清中IgM浓度,其中在哺乳7、14、21 d分别增加22.2%(P<0.01)、14%(P<0.05)和11.9%(P<0.05)。
2.2提高仔猪免疫力Petro等(1981)证实,当断奶仔猪缺乏BCAAs时,虽对细胞免疫无影响,但会导致合成特异性抗体的能力下降,并发现缬氨酸具有促进骨骼T细胞转化为成熟T细胞的作用(Petro等,1981)。黄红英等(2007)报道,哺乳母猪日粮中添加BCAAs能通过增加仔猪血清IgG浓度改善仔猪机体免疫功能,进而降低其腹泻率。另有研究发现,在断奶仔猪日粮中添加0.27%的亮氨酸,与对照组相比可显著提高其采食后1、2、3、4 h血浆免疫球蛋白A(IgA)和IgM的质量浓度,但对IgG的质量浓度无显著影响(李奇等,2012)。
Ren等(2015)研究报道,在断奶仔猪日粮中添加BCAAs,有利于小肠肠绒毛形态的保护与发育,并能增加十二指肠绒毛高度,减少上皮内淋巴细胞数量,增加空肠IgA、IgM水平,以及回肠I-gA、IgG的水平,从而全面增强断奶仔猪肠道免疫防御功能。
3 应用BCAAs的注意事项
3.1适宜的添加量猪对BCAAs的生理需要量除受BCAAs间拮抗作用的程度,以及与其他营养素的互作效应影响外,还受到其自身生产性能、日粮能量水平及其生理状况等因素的影响。Gatnau等(1995)研究指出,影响BCAAs及其转氨基作用的中间产物对动物免疫刺激调节效果的因素,主要来自于BCAAs的添加形式、添加量与适用动物的种类等方面,如过量的亮氨酸(3.12%)对断奶仔猪的生长和免疫均将产生有害的负面影响;若在4%蛋白质水平的饲料中添加过量亮氨酸,可使断奶仔猪的免疫反应受到严重抑制;添加适量的异亮氨酸或/和缬氨酸可大大减弱过量亮氨酸所造成的免疫抑制作用。该课题组还在以断奶仔猪为研究对象的试验中发现,向含l.12%亮氨酸的饲粮中分别添加1.12%亮氨酸、l.12%α-酮异己酸或0.4%β-羟基-β-甲基丁酸均对仔猪生长和免疫功能无不良影响,但向含1.56%亮氨酸的饲粮中添加1.56%的亮氨酸则对仔猪生长和免疫功能均有不利的影响(Gatnau等,1995)。
Richert等(1997a)研究报道,哺乳母猪对异亮氨酸的需要量为0.85%,该需要量比NRC(1988)标准量约高0.2%。Franco等(2013)发现,妊娠母猪从早期到晚期对异亮氨酸的需要量是逐渐增加的。Htoo(2014)研究认为,使18~40 kg仔猪增重达最大的回肠表观可消化异亮氨酸需要量为日粮的0.51%,而饲料转化率达最高的相应值为0.55%;在亮氨酸不超量的基础上,体重为10~ 22 kg与24~39 kg猪对异亮氨酸∶赖氨酸平均最佳标准回肠可消化(SID)比率分别约为51%与54%。哺乳母猪对BCAAs需要量的多少还与其哺仔数的数量有关,一般情况下哺仔数多的母猪要比哺仔数少的母猪需要更高的BCAAs总需要量。Richert等(1997b)进一步研究报道,当饲粮BCAAs比例平衡时,高产哺乳母猪对BCAAs的总需要量至少占饲粮的3.27%(每天203 g),其中异亮氨酸为0.85%、缬氨酸为1.07%、亮氨酸为1.35%;此外,饲粮中BCAAs含量不平衡时将增加哺乳母猪对其总的需要量。由此可见,饲粮中BCAAs的含量及比例(或模式)是同等的重要,倘若过量添加BCAAs反而不利于猪免疫力的正常发挥。
此外,Mavromichalis等(1998)报道,仔猪在体重为10 kg阶段采食低蛋白质(13.5%)玉米-大豆粕日粮时,缬氨酸对仔猪生产性能的限制程度与色氨酸、苏氨酸或蛋氨酸相似,但其限制程度要高于异亮氨酸;结果还提示,10kg仔猪对缬氨酸的需要量可能高于NRC(1998)的推荐标准(0.79%)。综合众多研究发现,在8~25kg体重阶段,仔猪标准回肠可消化缬氨酸(SID)需要量最高可达到0.92%(Gaines等,2006),而最低仅为0.53%(Barea等,2009)。
综上可知,猪对BCAAs的生理需要量及其组成模式除了与BCAAs间的拮抗效应有关外,还受到猪的基因类型、饲粮能量水平与生理阶段等因素的影响。表1概括了美国NRC(1998)标准中猪对BCAAs的推荐需要量及其模式,可为BCAAs在猪日粮中的应用提供科学参考。
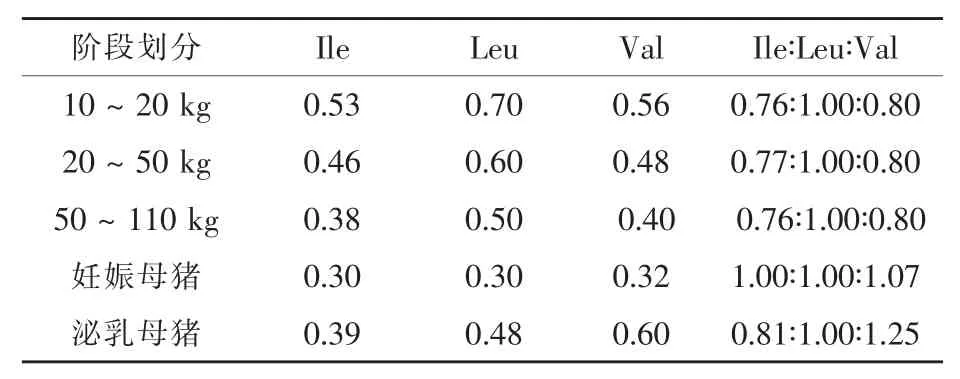
表1 美国NRC(1998)标准中猪对BCAAs的需要量及其模式%
3.2BCAAs的拮抗反应BCAAs均具有相似的侧链结构,故在小肠壁吸收转运与通过各种细胞膜时会相互竞争转运体系,而且3种BCAAs在分解代谢过程中还会竞争相同的降解酶。研究发现,当日粮中任一种BCAAs含量升高或过量或比例失衡时,均会增加BCAAs转氨酶的活力,促使其他BCAAs分解加剧,导致其他两种BCAAs不平衡性加剧(代腊等,2012;Mello等,1970)。因此,三种BCAAs间存在一定的拮抗效应,并已得到了多种动物试验的研究证实。Peter等(1988)报道,羔羊日粮中添加亮氨酸水平过高,动物机体对异亮氨酸与缬氨酸的转化效率将大幅度降低;同时,随着异亮氨酸的减少,亮氨酸的氧化将逐渐增加。此外研究还发现,异亮氨酸过低可导致细胞间质内异亮氨酸含量减少,进一步降低白蛋白与纤维蛋白的合成率(杜宗亮,2006)。
目前,以玉米为主要原料的基础日粮中,亮氨酸水平偏高较为普遍,该配比容易导致异亮氨酸与缬氨酸相对性的缺乏。Taylor等(1977)研究证实,将含0.38%异亮氨酸的生长猪日粮中1.34%亮氨酸添加量提高到2.04%,可拮抗另外两种BCAAs的正常功效,以致影响到生长猪饲料转化率、日增重与胴体品质等生产性能;若将0.38%的异亮氨酸提高到0.45%,却能显著促进猪的生长(陈熠等,2008)。Gloaguen等(2012)研究也发现,日粮中缺乏缬氨酸会抑制生长猪的采食,而且摄入过多的亮氨酸会进一步加剧以上采食抑制作用;该结果进一步印证过量的亮氨酸会增加另外两种BCAAs的分解代谢,进而加重由缬氨酸和异亮氨酸缺乏所引起的生产抑制效应。王彬等(2012)试验也指出,在日粮蛋白质不足(9%酪蛋白)时添加3%的高水平亮氨酸可抑制老鼠生长,但能通过添加异亮氨酸得到部分缓解;而在蛋白质充足(18%酪蛋白)日粮中,添加3%的亮氨酸并不引起老鼠生长抑制,同时还未发现高水平异亮氨酸和缬氨酸的拮抗效应。可见,3种BCAAs不仅相互存在拮抗作用,而且在人类与动物体内主要由亮氨酸所引起。
另有文献表明,BCAAs在生化代谢过程中所产生的拮抗作用,还会进一步影响到动物机体免疫功能的正常发挥(Beisel,1982)。
4 结语
BCAAs作为氮的载体,是猪的必需氨基酸,具有构成肌肉蛋白、刺激胰岛素分泌、促进蛋白合成等多方面的生物学功能,特别是对猪免疫防御机能发挥着调节作用。但在猪日粮中添加BCAAs时,要十分注意其不当应用所带来的负面影响。如猪饲料中某种BCAAs含量过高或比例不当都会引起BCAAs之间的拮抗现象和免疫抑制作用。相信随着畜牧科学研究的不断深入,养猪业中应用BCAAs会日渐变得更加科学化与合理化。
[1]陈熠,贺建华,彭艺,等.猪的支链氨基酸营养[J].饲料广角,2008,9:23~25.
[2]陈熠,彭艺,贺建华,等.添加缬氨酸对泌乳母猪血清和乳中生化免疫指标及激素水平的影响[J].中国饲料,2009,17:15~20.
[3]代腊,邹晓庭.缬氨酸在畜禽生产中的应用[J].饲料与畜牧,2012,1:20~23.
[4]杜宗亮.支链氨基酸在哺乳母猪营养中的研究进展[J].饲料工业,2006,27(21):19~22.
[5]宫碧霜,任曼,靳二辉,等.异亮氨酸对大鼠血清抗氧化水平及脾脏组织结构的影响[J].安徽科技学院学报,2015,6:1~5.
[6]黄红英,贺建华,范志勇,等.添加缬氨酸和异亮氨酸对哺乳母猪及其仔猪生产性能的影响[J].动物营养学报,2008,3:281~287.
[7]黄红英,贺建华,范志勇,等.母猪日粮中支链氨基酸水平对仔猪血液生化指标和部分免疫指标的影响[J].饲料工业.2007,28(21):24~6.
[8]李奇,王彬,袁珍虎.亮氨酸对断奶仔猪生长和免疫性能的影响[J].饲料研究,2012,8:3~5.
[9]刘春生,张大鹏,刘文宽,等.支链氨基酸及其在泌乳母猪营养中的研究现状[J].饲料工业,2006,1:25~26.
[10]靳继德,郑子新,王钢乐,等.Ala-Gln和BCAA对创伤大鼠营养支持作用的实验研究[J].中国临床营养杂志,2001,1:19~23.
[11]陶义训.免疫测定进展[J].上海免疫学杂志,1999,2:2~5.
[12]王彬,李奇.亮氨酸的代谢及营养生理作用研究进展[J].饲料研究,2012,1:14~16.
[13]王勇.缬氨酸对高产哺乳母猪生产性能、免疫机能及氮利用率的影响研究:[硕士学位论文][D].杭州:浙江大学,2010.
[14]徐琪寿.氨基酸药理学研究进展[J].氨基酸和生物资源,1996,1:30~32.
[15]Aschkenasy A.Prevention of the immunodepressive effects of excess dietary leucine by isoleucine and valine in the rat[J].J Nutr,1979,109(7):1214~22.
[16]Belokrylov G A,Molchanova I V,Sorochinskaya E I.Immunomodulatory properties of certain amino acids influence the immunostimulating properties of specific peptides[J].Int J Immunopharmacol,1990,12(8):841~5.
[17]Beisel WR.Single nutrients and immunity[J].Am J Clin Nutr.1982,35(2):417~68.
[18]Barea R,Brossard L,Le Floc'h N,et al.The standardized ileal digestible valine-to-lysine requirement ratio is at least seventy percent in postweaned piglets[J].J Anim Sci,2009,87(3):935~947.
[19]Calder P C.Branched-chain amino acids:metabolism,physiological function,and application:session III,branched-chain amino acids and immunity[J]. American Society for Nutrition,J Nutr,2006,136:288S~93S.
[20]Chevalier P,Aschkenasy A.Hematological and immunological effects of excess dietary leucine in the young rat[J].Am J Clin Nutr,1977,30:1645~54.
[21]Dunshea F R,Bauman D E,Nugent E A,et al.Hyperinsulinaemia,supplemental protein and branched-chain amino acids when combined can increase milk protein yield in lactating sows[J].British Journal of Nutrition,2005,93(3):325~332.
[22]Franco D J,Josephson J K,Moehn S,et al.Isoleucine requirement of pregnant sows[J].J Anim Sci,2013,91(8):3859~66.
[23]Gaines A M,Srichana P,Ratliff B W,et al.Evaluation of the true ileal digestible(TID)valine requirement of 8 to 20 kg pigs[J].J Anim Sci,2006,84(1):284.
[24]Gatnau R,Zimmerman D R,Nissen S L,et al.Effects of excess dietary leucine and leucine catabolites on growth and immune responses in weanling pigs[J].J Anim Sci,1995,73(1):159~65.
[25]Gloaguen M,Le Floc'h N,Corrent E,et al.Providing a diet deficient in valine but with excess leucine results in a rapid decrease in feed intake and modifies the postprandial plasma amino acid and α-keto acid concentrations in pigs[J].J Anim Sci,2012,90(9):3135~42.
[26]Harris R A,Joshi M,Jeoung N H,et al.Overview of the molecular and biochemical basis of branched-chain amino acid catabolism[J].J Nutr,2005,135(6):1527S~30S.
[27]Htoo J K,Zhu C L,Huber L,et al.Determining the optimal isoleucine:lysine ratio for ten-to twenty-two-kilogram and twenty-four-to thirtynine-kilogram pigs fed diets containing nonexcess levels of leucine[J].J Anim Sci,2014,92(8):3482~90.
[28]Mavromichalis I L,Webel D M,Emm ert J L,et al.Limiting order of amino acids in a low-protein corn-soybean meal-whey-based diet for nursery pigs[J].J Anim Sci,1998,76(11):2833~7.
[29]Mello J P F,Lewis D.Amino acid interactions in chick nutrition[J].British Poultry Science,1970,11(3):367~385.
[30]Negro M,Giardina S,Marzani B,et al.Branched-chain amino acid supplementation does not enhance athletic performance but affects muscle recovery and the immune system[J].J Sports Med Phys Fitness,2008,48(3):347~51.
[31]NRC.Nutrient Requirements of Swine(10thED.).National Academy Press,Washington,DC.1998.
[32]Papet I,Breuille D,Glomot F,et al.Nutritional and metabolic effects of dietary leucine excess in preruminant lamb[J].J Nutr,1988,118(4):450~5.
[33]Petro T M,Bhattacharjee J K.Effect of dietary essential amino acid limitations upon susceptibility to Salmonella typhimurium and the effect upon humoral and cellular immune response in mice[J].Infect Immun,1981,32:251~9.
[34]Ren M,Zhang S H,Zeng X F,et al.Branched-chain Amino Acids are Beneficial to Maintain Growth Performance and Intestinal Immune-related Function in Weaned Piglets Fed Protein Restricted Diet[J].Asian-Australas J Anim Sci,2015,28(12):1742~50.
[35]Richert B T,Goodband R D,Tokach M D,et al.Increasing valine,isoleucine,and total branched-chain amino acids for lactating sows[J].J Anim Sci,1997a,75(8):2117~28.
[36]Richert B T,Tokach M D,Goodband R D,et al.The effect of dietary lysine and valine fed during lactation on sow and litter performance[J].J Anim Sci,1997b,75(7):1853~60.
[37]Taylor S J,Cole D J,Lewis D.An interaction of leucine,isoleucine and valine in the diet of the growing pig[J].Proc Nutr Soc,1977,36(1):36A.■
Branched-chain amino acids regarding as essential amino acids for pig,have many important biological functions,such as providing nutrition,regulating immune,promoting secretion and participating in metabolism.In this study,the latest research results of the branched-chain amino acids in pig with immune function were reviewed,and the mechanism of branched-chain amino acids in immunological functions was further discussed,to provide scientific references for the related research.
branched-chain amino acids;pig;immune function;mechanism
10.15906/j.cnki.cn11-2975/s.20161603
S816.7
A
1004-3314(2016)16-0010-04
国家自然科学基金项目(31372394);香港铭源基金(2011-165);广东省自然科学基金(2014A030313699、2015A030310094)

