云南玛咖中功能性成分的分析研究
杜 萍,杨 敏,朱艳琴,黄绍军,贺与平,刘润民
(昆明理工大学分析测试研究中心,云南昆明 650093)
云南玛咖中功能性成分的分析研究
杜萍,杨敏,朱艳琴,黄绍军,贺与平,刘润民
(昆明理工大学分析测试研究中心,云南昆明 650093)
研究云南栽培玛咖(LepidiummeyeniiWalpers)的功能性成分。采用经典的植物化学研究方法硅胶色谱柱法对云南玛咖进行分离纯化,通过红外光谱、核磁共振光谱、质谱及色谱的相关数据及结合文献进行分析研究。从玛咖中分离鉴定了3个化合物,分别为β-谷甾醇(β-sitosterol)、n-苄基十六烷酰胺(N-benzylhexadecanamide)、蔗糖(Sucrose);从玛咖提取物中分析确定含有5个玛咖酰胺、2个咪唑生物碱和2个芥子油苷化合物。
玛咖,n-苄基十六烷酰胺,β-谷甾醇,蔗糖,玛咖酰胺,咪唑生物碱,芥子油苷
玛咖为十字花科(Cruciferae)独行菜属(Lepidium)植物,学名LepidiummeyeniiWalpers,一年生或两年生草本。此植物原生长在秘鲁海拔3500~4500 m的安第斯山区[1-2],属于高海拔半野生植物,种植过程完全人工进行。玛咖含有丰富的营养成分,国内主要报道有余龙江[3]对干粉的营养成分及抗疲劳作用研究,杨晶明[4]对玛咖干品营养成分分析研究,杜萍[5]、孙晓东[6]、单云[7]对云南玛咖营养成分及挥发性成分的研究等。
玛咖具有强身健体、增强人体免疫力、提高生育力、快速恢复体力、抗疲劳等功效[8-9],因此自2002年引进到我国以来,已有10余年的历史,90%以上种植区域在云南。对于秘鲁原产地种植玛咖的化学成分(次生代谢部分)自2000年以来国外已有相应的报道,主要集中在玛咖酰胺、玛咖烯、芥子油苷、甾醇和酚类[10-13]等。有关云南栽培玛咖的化学成分分离、分析方面的研究报道较少,而云南又为最大的种植区域,因此本文采取提取分离纯化及多种分析技术,研究云南玛咖的化学成分,为有效地评价云南玛咖的营养功能价值,综合利用云南玛咖提供科学依据。
1 材料与方法
1.1材料与仪器
玛咖来自云南丽江玉龙县人工栽培的玛咖;薄层层析硅胶板(G板50 mm×150 mm)和柱层析硅胶(200~300目)青岛海洋化工厂;乙醇、石油醚、乙酸乙酯、无水硫酸钠、硫酸分析纯,天津化学试剂公司;蔗糖、果糖、麦芽糖、葡萄糖分析纯,上海国药试剂公司。
DFT-200手提式高速万能粉碎机(功率:900 W、细度:50~200目、转速25000 r/min)国产;AVANCE III-600 MHz超导核磁共振仪美国Bruker公司;AutoSpec Premier P776双聚焦三扇型磁质谱仪美国Waters;TENSOR27傅立叶变换中红外光谱仪美国Bruker公司;Agilent 1100 LC-MSD/TOF美国Agilent公司;Waters Xevo TQ-S超高压液相色谱三重四极杆串联质谱联用仪美国Waters;U3000双三元高效液相色谱仪(附蒸发光检测器(ELSD)和变色龙软件7.1色谱工作站)美国戴安公司。
1.2实验方法
1.2.1样品提取分离与分析
1.2.1.1活性成分的提取分离[13]玛咖干燥根茎2 kg,粉碎至50目,用75%乙醇两次回流提取,每次用乙醇5 L,每次回流2 h,滤出提取液后,物料再用50%乙醇回流提取两次,每次用乙醇4 L,每次回流2 h,滤出提取液,将全部醇提取液合并,减压浓缩成膏状物约1.3 kg。
取上述玛咖乙醇浸膏1 kg,加入1 L的蒸馏水,搅拌均匀得混悬液,置分液漏斗中,用石油醚(60~90 ℃)萃取3次,共得石油醚萃取液约4500 mL,将石油醚液浓缩至约1000 mL,加入无水硫酸钠干燥,滤出,石油醚液再浓缩至干,得到石油醚提取物15 g。
取石油醚提取物,经硅胶(200~300目)柱(直径100 mm×长度50 mm)减压柱层析,以石油醚-乙酸乙酯进行梯度洗脱(8∶2~2∶8,v/v),按TLC指示合并流分(以250 mL一份收集洗脱液),获得18个流分(Fr.1~Fr.18)。Fr.4~Fr.6流分合并浓缩后放置,析出结晶,用甲醇反复纯化,得白色结晶85 mg,编号为MF(化合物A)。由上述Fr.7~Fr.9合并流分,经硅胶短柱(直径100 mm×长度50 mm)进行减压柱层析分离,以石油醚-乙酸乙酯进行梯度洗脱(95∶5~80∶20,v/v),按TLC指示合并流分(以200 mL一份收集洗脱液),获得30个流分(Fr.1~Fr.30)。Fr.21~Fr.23流分合并,合并液减压蒸干后,用甲醇处理,得黄白色粉状物,经甲醇重结晶得白色结晶25 mg,编号为MI-B(化合物B)。
石油醚萃取过的混悬液置旋转蒸发器中减压蒸干至无水滴出现,加入无水乙醇800 mL,回流提取2 h,上清液放置过夜,倾出上清液,置冰箱冷藏层放置48 h,析出黄白色粒状结晶,用少量甲醇洗涤结晶,得到白色粒状结晶,编号MS(化合物C)。
1.2.1.2玛咖活性部位的成分分析[14]称取100 g玛咖浸膏(70%乙醇提取),用无水乙醇400 mL分两次溶解,于离心机中3000 r/min离心30 min。上清液转入锥形瓶中,置冰箱冷藏层放置过夜。次日,上清液于50 ℃以下减压浓缩至无乙醇味,加水100 mL搅拌均匀,转入分液漏斗中,用2%氢氧化钠调pH至9,再用氯仿萃取3次,合并氯仿萃取液,用无水硫酸钠干燥后,减压浓缩至干,所得提取物部分为总生物碱。此部分经超高压液相色谱三重四极杆串联质谱联用仪检验,结合并依据相关文献,分析鉴定其中主要成分。
上述氯仿萃取后的母液用2%盐酸中和(最好操作在5 ℃以下进行),再用乙酸乙酯萃取三次,合并乙酸乙酯液,于3000 r/min离心15 min,取上清液减压浓缩至干,此提取物部分经超高压液相色谱三重四极杆串联质谱联用仪检验,结合并依据相关文献,分析鉴定其中主要成分。
1.2.2质谱条件电离方式:EI+、离子源温度:250 ℃、电子能量:70 eV、分辨率:10000、扫描范围:检测质量数±40 pDa。
1.2.3红外光谱条件分辨率:4 cm-1、扫描范围:400~4000 cm-1、制样方式:KBr压片。
1.2.4Agilent 1100 LC-MSD/TOF条件质谱条件:离子源:ESI;测定模式:正离子模式;毛细管电压:3800 V;毛细管温度:300 °C;干燥气流速:7.0 L/min;雾化气压力:15 psig;裂解电压:210 V;分离锥电压:60V;八级杆电压:250 V。
色谱条件:流动相甲醇∶水∶异丙醇70∶10∶20(v∶v∶v);流速0.2 mL/min。
1.2.5Waters Xevo TQ-S超高压液相色谱三重四极杆串联质谱联用仪条件色谱柱:Aglilent zorbax SB-C18(4.6 mm×150 mm,5 μm);流动相:A为乙酸乙酯,B为乙腈;流速:1 mL/min;柱温:28 ℃;梯度洗脱程序:0~15 min,75% A~25% B;15~35 min,5% A~95% B;35~60 min,5% A~95% B。
离子源:电喷雾离子源(ESI);扫描方式:负离子扫描;检测方式:多反应监测(MRM)模式;毛细管电压:3800 V;离子源温度:150 ℃;脱溶剂气温度:350 ℃;脱溶剂气流速:800 L/h。
1.2.6高效液相色谱条件色谱柱氨基柱XB-C18内径(4.6 mm×250 mm,5 μm);流动相:乙腈∶水=80∶20;流速:1 mL/min。蒸发光检测器(ELSD):漂移管温度20.3 ℃,氮气流量:2.7 L/min,增益:1。
1.3定性分析
通过波谱、质谱、色谱分析数据鉴定化合物:由质谱确定样品离子的质量,推导其分子式;由红外光谱确定其化学键及官能团;核磁共振数据(氢谱)结合对照文献报道初步确定化合物结构。
2 结果与分析
2.1三种化合物的结构鉴定
从1.2.1.1中分离的三个化合物A、B、C,采用波谱解析技术鉴定,分别为β-谷甾醇(β-sitosterol)、n-苄基十六烷酰胺(N-benzylhexadecanamide)、蔗糖(sucrose)。三种化合物的结构鉴定的数据如下:
2.1.1化合物A白色针晶,易溶于乙酸乙酯、石油醚等溶剂。该化合物EI质谱显示m/zM+414为分子离子峰,红外光谱证明有羟基(3424 cm-1),不饱和度为5,结合核磁共振氢谱确定其分子式为C29H50O。结合文献[15],可推断化合物A为β-谷甾醇,结果见图1、图2。
1H-NMR(500 MHz,CDCl3):5.33,5.34(1H,br.d,=C6-H),3.75,3.74,3.72(1H,t,=C3-H),0.99(3H,S,C19-CH3),0.67(3H,s,C18-CH3),2.27(2H,m,C4-CH2),1.99(2H,t,C7-CH2)。

图1 化合物A谷甾醇1H-NMR图谱 Fig.1 1H-NMR spectrum of compound A

图2 化合物A分子结构图(谷甾醇)Fig.2 Stucture of compound A
2.1.2化合物B白色结晶,易溶于乙酸乙酯、石油醚等溶剂。该化合物EI质谱显示m/zM+345为分子离子峰,TOF-MS m/z 346.3219(C23H40NO),m/z 368.2932(C23H39NONa),m/z713.6018(C46H78N2O2Na),由此可推断化合物B分子式为C23H39NO,分子量为345.3026,上述三个化学式分别为其M+1、M+Na、2M+Na峰;红外光谱数据证明有酰胺基(3441,3443 cm-1);核磁共振氢谱δ7.27附近多重峰,5个芳氢原子;δ5.70 单峰为NH氢;δ4.43三重峰,2个氢原子,它们构成苄基酰胺结构,其余各峰为十六烷酸长链的氢原子。上述数据及结合文献[16]鉴定化合物B为n-苄基十六烷酰胺。见图3、图4。
1H-NMR(500 MHz,CDCl3):7.27(5H,m,5Ar-H),5.70(1H,s,N-H),4.43(2H,t,C-17-H),2.18(2H,t,C-2-H),1.63(2H,m,C-3-H),1.28(2H,m,C-15-H),0.86(3H,C-16 CH3)。

图3 化合物B n-苄基十六烷酰胺1H-NMR图谱Fig.3 1H-NMR spectrum of compound B

图4 化合物B n-苄基十六烷酰胺结构图谱 Fig.4 Stucture of compound B
2.1.3化合物C白色粒状结晶,易溶于水,有甜味。从核磁共振氢谱数据推测该物质为蔗糖,分子式为C12H22O11;用HPLC,与蔗糖、果糖、麦芽糖及葡萄糖标样进行对照分析,证实化合物C为蔗糖。
1H-NMR(500 MHz,CDCl3):5.25(1H,d,C1-H),3.40(1H,dd,C2-H),3.60(1H,t,C3-H),3.32(1H,t,C4-H),3.68(1H,m,C5-H),3.66(2H,d,C6-H)上述均为葡萄糖单元;3.52(2H,s,C1′-H),4.06(1H,d,C3′-H),3.90(1H,t,C4′-H),3.73(1H,m,C5′-H),3.67(2H,d,C6′-H)上述均为果糖单元。氢谱见图5。液相色谱图见图6、结构式见图7。

图5 化合物C玛咖糖1H-NMR图谱Fig.5 1H-NMRspectrum of compound C
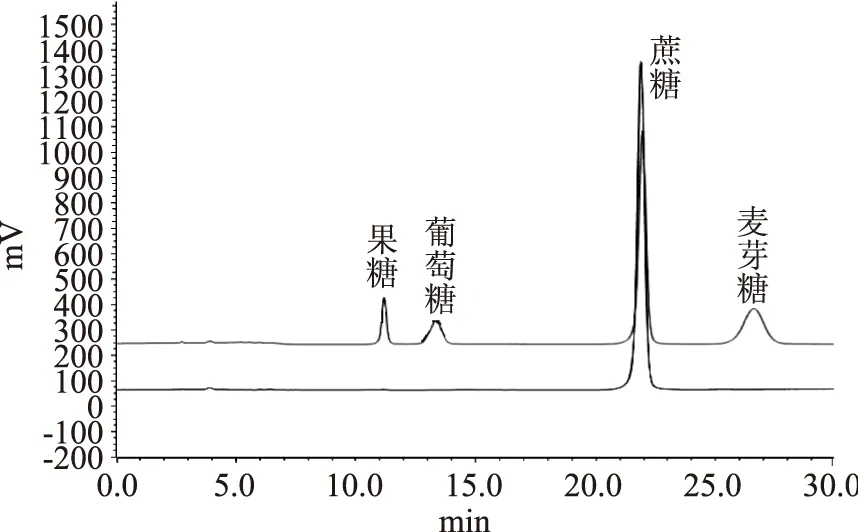
图6 化合物C玛咖糖HPLC图谱 Fig.6 HPLC spectrum of compound C

图7 化合物C 玛咖糖 分子结构式Fig.7 Structure of compound C
2.2活性部位中化合物的UPLC-UV-MS的结果与分析
通过1.2.1.2的提取方式,将其提取物中功能活性的化学成分集中,并通过UPLC-UV-MS分析鉴定,结合国外的相关文献,分析确定含有5个玛咖酰胺、2个咪唑生物碱及2个芥子油苷系列的化合物。
2.2.1玛咖酰胺根据保留时间,获得质荷比及相对分子质量,依据文献报道[11-13,16],推测其分子离子峰,得到相应的分子式。化合物的总离子流图和离子质谱图见图8。

图8 五个玛咖酰胺化合物的色谱图、质谱图Fig.8 Chromatograms and MS spectra of five macamides
1、N-Benzyl-9-oxo-12Z,15Z-octadecadienamidem/z(M+Na)+406、(M+H)+384,Rt32.949 min
2、n-benzyl-(9Z,12Z,15Z)-octadecatrienamidem/z(M+Na)+390、(M+H)+368,Rt35.551 min
3、n-benzyl-(9Z,12Z)-octadecadienamidem/z(M+Na)+392、(M+H)+370,Rt36.969 min
4、n-benzyl-(9Z)-octadecenamidem/z(M+Na)+394、(M+H)+372,Rt39.137 min
5、n-benzyloctadecanamidem/z(M+Na)+396、(M+H)+374,Rt43.105 min
2.2.2玛咖生物碱根据保留时间,获得质荷比及相对分子质量,依据文献报道[17],推测其分子离子峰,得到相应的分子式。Lepidiline A:m/z 291(M-Cl)+,保留时间15.2 min;Lepidiline B:m/z 291(M-Cl)+,保留时间23.158 min。化合物的总离子流图和离子质谱图见图9。

图9 2个玛咖生物碱化合物的色谱图、质谱图Fig.9 Chromatogram and MS spectra of two alkaloids
2.2.3芥子油苷根据保留时间,获得质荷比及相对分子质量,依据文献报道[18-19],推测其分子离子峰,得到相应的分子式。化合物的总离子流图和离子质谱图见图10,11。

图10 玛咖芥子油苷的色谱图、质谱图Fig.10 Chromatogram and MS spectra of glucosinolate of maca

图11 玛咖芥子油苷的色谱图、质谱图Fig.11 Chromatogram and MS spectra of glucosinolate of maca
2.2.3.1m-Methoxyglucotropaeolin:m/z 438(M-H)-,保留时间9.39 min。
2.2.3.2Glucotropaeolinm/z 408(M-H)-,保留时间8.354 min。
3 结论
玛咖营养成分对玛咖的功效起到促进作用,因此国内大量的基础工作集中在营养成分的分析研究上,活性成分研究甚少。本文主要研究云南栽培玛咖的功能活性成分。通过在实验室采取不同的提取分离及纯化技术方式获得三个化合物单体及确定含有5个玛咖酰胺、2个咪唑生物碱及2个芥子油苷化合物,其目的主要是观察云南栽培玛咖中功能活性成分情况。从实验结果中得到:其一玛咖中分离出的蔗糖具有特殊的玛咖香气,属首次,对拓展食品天然添加剂的开发有一定的开发前景;其二玛咖功能性的成分主要为一些天然酯溶性的化合物[8],其玛咖烯、玛咖酰胺、芥子油苷、甾醇及酚类物质等都存在于60%~70%乙醇提取物中,因此可以利用其功能性成分特性,采取相应的提取方式,集中活性成分,为玛咖作为膳食补充剂的食品营养产业起到有效的辅助作用。
[1]Mummenhoff K,Hurka H,Bandelt HJ. Systematics of AustralianLepidiumspecies(Brassicaceae)and implications for their origin:Evidence from IEF analysis of Rubisco[J]. Plant Syst
Evol,1992,183(1):99-112.
[2]DerMarderosian A,ed. Maca In Guide to Popular Natural Products[M].St Louis,MO:Wolters Kluwer Company,2001:157-158.
[3]余龙江,金文闻.玛伽(Lepidiummeyenii.)干粉的营养成分及抗疲劳作用研究[J].食品科学,2004,25(1):164-166.
[4]杨晶明,王竹,杨月欣.玛伽(Maca)干品营养成分分析与比较[J].中国食品卫生杂志,2007,19(3):201-205.
[5]杜萍,单云,孙卉,等. 云南玛卡营养成分分析[J]. 食品科学,2010,31(24):345-347.
[6]孙晓东,杜萍,单云,等. 丽江玛卡片和秘鲁玛卡片营养成分比分析和评价[J]. 食品科学,2011,32(19):214-216.
[7]单云,孙晓东,杜萍,等. 丽江产玛卡根茎裂解-气相色谱-质谱分析[J]. 食品科学,2011,32(24):244-247.
[8]Muhammad I,Zhao J,Khan I. Maca(Lepidiummeyenii)In Encyclopedia of Diatary Supplements[M]. New York:Coates,P,ed,2009:518-526.
[9]沈维治,邹宇晓,林光月,等.玛咖抗疲劳作用及活性组分研究[J].食品与生物技术学报,2014,33(7):721-726.
[10]Zheng BL,He K,Kim CH,et al. Effect of a lipidic extract fromLepidiummeyeniion sexual behavior in mice and rats[J]. Urology,2000,55(4):598-602.
[11]Muhammad I,Zhao J,Dunbar DC,et al. Constituents ofLepidiummeyenii‘maca’[J].Phytochemistry,2002,59(1):105-110.
[12]Ganzera M,Zhao J,Muhammad I,et al. Chemical profiling and standardization ofLepidiummeyenii(Maca)by reversed phase high performance liquid chromatography[J]. Chem Pharm Bull(Tokyo),2002,50(7):988-991.
[13]Zhao J,Muhammad I,Dunbar DC,et al. New alkamides from maca(Lepidiummeyenii)[J].Agric Food Chem,2005,53(3):690-693.
[14]郑茜,张庆贺,卢丹,等.吉林产玛咖的化学成分研究[J].中草药,2014,45(17):2457-2460.
[15]董雪云,文波,沈云亨.宽叶兔儿风的化学成分研究[J].中草药,2014,45(15):2148-2152.
[16]McCollom MM,Villinski JR,McPhail KL,et al. Analysis of macamides in samples of Maca(Lepidiummeyenii)by HPLC-UV-MS/MS[J].Phytochem Anal,2005,16(6):463-469.
[17]Cui B,Zheng BL,He K,et al. Imidazole alkaloids fromLepidiummeyenii[J]. Nat Prod,2003,66(8):1101-1103.
[18]Piacente S,Carbone V,Plaza A,et al. Investigation of the tuber constituents of maca(LepidiummeyeniiWalp.)[J]. Agric Food Chem,2002,50(20):5621-5625.
[19]艾中,程爱芳,孟际勇,等.国产玛咖芥子油苷的组分分析和含量测定[J].食品科技,2012,37(4):182-186.
Analysis of the functional constituent in Maca (Lepidiummeyenii)from Yunnan
DU Ping,YANG Min,ZHU Yan-qin,HUANG Shao-jun,HE Yu-ping,LIU Run-min
(Research Center for Analysis and Measurement,Kunming University of Science and Technology,Kunming 650093,China)
Study on chemical constituents of Maca(Lepidiummeyenii)in Yunnan. The classical phytochemical technique and silica gel column chromatography were isolated and purified. Structure and chromatographic and spectral properties of identified compounds had been identified. Compounds from three different extraction methods had been identified:β-sitosterol(A),n-benzylhexadecanamide(B)and sucrose(C). It was found that there were five main secondary metabolic product macamides,two imidazole alkaloids and two glucosinolates from the maca extract.
LepidiummeyeniiWalpers(Maca);N-benzylhexadecanamide;β-sitosterol;sucrose;macamides;imidazole alkaloids;glucosinolates
2016-01-04
杜萍(1968-),女,本科,高级工程师,研究方向:天然产物分析与研究,E-mail:duping515@sina.cn。
云南省应用基础研究计划项目(2012F2040)。
TS201.2
A
1002-0306(2016)16-0071-05
10.13386/j.issn1002-0306.2016.16.005

