北五味子乙素对大鼠离体心肌缺血再灌注损伤的保护作用及分子机制
孙红霞,陈建光*
(北华大学药学院,吉林 吉林 132013)
北五味子乙素对大鼠离体心肌缺血再灌注损伤的保护作用及分子机制
孙红霞,陈建光*
(北华大学药学院,吉林 吉林 132013)
目的:观察北五味子乙素(schisandrin B,SchB)对缺血再灌注(ischemia/reperfusion,I/R)大鼠离体心脏功能、梗死面积、乳酸脱氢酶及相关蛋白表达的影响,探讨其对I/R损伤的保护作用及分子机制。方法:Wistar大鼠50 只,随机分为5 组:空白对照组(CON)、缺血再灌注组(I/R)、SchB预保护组(SchB)、PI3K抑制剂组(I/R+SchB+LY)、腺苷酸活化的蛋白激酶(AMP-activated protein kinase,AMPK)抑制剂组(I/R+SchB+CC)。采用Langendorff法建立离体大鼠心脏I/R模型,心肌缺血2 h,再灌注5、15、30、60 min。观察I/R期间室内压最大上升速率(+dp/dtmax)、室内压最大下降速率(-dp/dtmax)、左心室舒张末压、冠脉流量和心率;测定心脏灌流液中乳酸脱氢酶(lactate dehydrogenase,LDH)含量,2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltertrazolium chloride,TTC)染色测定各组心肌梗死面积;免疫印迹检测心肌中总蛋白激酶B(protein kinase B,PKB)、磷酸化Akt(p-Akt)、总糖原合成酶激酶-3β(glycogen synthease kinase-3β,GSK-3β)、磷酸化GSK-3β(p-GSK-3β)蛋白表达。结果:SchB可显著改善I/R所致的心肌功能损伤,减少梗死面积,提高心肌中p-Akt和p-GSK-3β蛋白表达。结论:SchB对大鼠离体心脏I/R损伤具有一定保护作用,其机制可能与激活AMPK和PI3K/Akt信号通路有关。
北五味子乙素;心肌缺血再灌注;损伤;分子机制
孙红霞, 陈建光. 北五味子乙素对大鼠离体心肌缺血再灌注损伤的保护作用及分子机制[J]. 食品科学, 2016, 37(15): 237-241. DOI:10.7506/spkx1002-6630-201615040. http://www.spkx.net.cn
SUN Hongxia, CHEN Jianguang. Protective effect of schisandrin B on the isolated rat heart against myocardial ischemia/ reperfusion injury and its molecular mechanism[J]. Food Science, 2016, 37(15): 237-241. (in Chinese with English abstract)
近年来随着溶栓疗法、经皮冠脉介入疗法、冠状动脉旁路搭桥术(coronary artery bypass graft,CABG)及心脏移植术等广泛用于临床,心脏病的治疗进入再灌注时期。再灌注期间,大量活化的中性粒细胞聚集在心肌微血管内并浸润到心肌组织中,通过释放细胞炎性物质、氧自由基、蛋白酶等物质引起心肌损伤[1-5]。心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)发病机制复杂,至今尚未完全阐明。近几年研究表明五味子具有保护心肌作用,但其保护心肌的活性成分及作用机制目前尚未明确[6]。本实验前期研究已证实北五味子乙素对大鼠对在体MI/RI具有保护作用,本实验采用Langendorff法观察大鼠离体心脏缺血再灌注(ischemia/reperfusion,I/R)模型,观察北五味子乙素(schisandrin B,SchB)对离体心脏I/R损伤的保护作用,探讨其体外作用及其机制,为进一步阐述其对心肌缺血再灌注损伤保护作用及其分子机制提供参考。
1 材料与方法
1.1试剂、动物与仪器
北五味子乙素(SchB),相对分子质量400.46,分子式:C23H28O6,高效液相色谱(high performance liquid chromatography,HPLC)检测其纯度>97.0%,五味子乙素是在中药北五味子中含量最高的联苯环辛烯类木脂素,由中国药品生物制品检定所提供,药物在实验时用任氏液(Krebs-Henseleit,K-H液)配成所需浓度;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒 南京建成生物工程研究所;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tertrazolium chloride,TTC)美国Sigma公司;磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)抑制剂LY294002(简称LY)、腺苷酸活化的蛋白激酶(AMP-activated protein kinase,AMPK)抑制剂复合物C(简称CC)、兔抗大鼠Akt、磷酸化Akt(p-Akt)、糖原合成酶激酶-3β(glycogen synthease kinase-3β,GSK-3β)、磷酸化GSK-3β(p-GSK-3β)抗体美国Cell Signaling公司。
健康雄性Wistar大鼠,体质量180~220 g,购于长春高新医学实验动物研究中心,许可证号:SCXK-(吉)20013-0001。于清洁级饲料室饲养,定时喂食,饮水不限。
MP-72桥式放大器 美国AD Instrument公司。
1.2方法
1.2.1大鼠离体心肌缺血再灌注损伤模型制备
大鼠腹腔注射3%戊巴比妥30 mg/kg,肝素500 IU/kg,麻醉后迅速开胸取出心脏,放入盛有4 ℃ K-H液的玻璃皿中,修剪主动脉根部周围组织,游离主动脉,悬挂于改良Langendorff心脏灌流装置上[7-8],结扎固定,恒压灌流,剪开肺动脉圆锥以开放冠脉流出道,剪开左心耳,将与压力传感器连接的乳胶水囊经左心房通过二尖瓣置于左心室,通过张力换能器连接生物信号采集处理系统,然后将心脏置于37 ℃保温缸内,向球囊内缓慢注入生理盐水,调节乳胶水囊压力,使左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)维持在8~10 mmHg。各组均由主动脉恒压灌注预先升温至37 ℃,并用体积分数95% O2与5% CO2混合气体持续充气平衡30 min的K-H液,灌注压力为90 cm H2O。30 min后分别用相应25 ℃心脏停搏液诱导心脏停搏,灌注流量为15 mL/kg,灌注压为90 cm H2O,每30 min灌注一次。停播期间各组心脏分别浸泡在相应的25 ℃恒温的停搏液中,120 min后以K-H液恢复灌流60 min。
1.2.2实验分组及处理
Wistar大鼠50 只,随机分为5 组:空白对照组(CON)、模型组(I/R)、SchB预处理组(530 μmol/L,I/R+SchB)、PI3K抑制剂组(I/R+SchB+LY)、AMPK抑制剂组(I/R+SchB+CC),每组10 只。空白对照组:在心脏正常跳动之后,用K-H液灌注心脏3 h,不作其他任何处理,其余各组离体心脏均平稳后,停灌120 min,再灌注60 min。SchB处理:先用正常K-H液灌流心脏30 min,待各相关监测指标稳定后,分别对不同各组进行预处理。将LY294002 15 μmol/L和CC 1 μmol/L灌流20 min后加入SchB 50 μmol/L灌流20 min,再进行I/R过程。记录观察数据,采集相关实验数据进行分析。
1.2.3心功能指标测定
参照文献[7]方法,选取心率(heart rate,HR)、冠脉流速(coronary flow,CF)、LVEDP、左 室收缩压最大上升/下降速率(+dp/dtmax和-dp/dtmax)作为心功能观察指标。具体方法是将实验检测到的CF和压力信号经桥式放大器放大后传导至数模转换器,将数字信号转换成形态图像显示在计算机上,后经系统自带软件测量、采集和保存数据,供分析使用。
1.2.4心肌梗死面积的测定
再灌注60 min后,将心脏放入-20 ℃冰箱中速冻20 min左右便于切片,一般切成5~6 片,每隔2 mm切一片,将切片置于1% TTC染色液中,用锡箔纸盖住后,放入37 ℃温箱15~30 min,不时翻动切片,使其均匀接触到染色液,置中性甲醛中固定24 h拍照,结合计算机多功能显微图像分析系统计算梗死面积。染色后效果:正常组织呈现红色,缺血组织呈现白色(梗死)。
1.2.5心肌组织LDH活力测定
收集再灌注后5、15、30、60 min的灌流液检测心脏灌流漏出液中LDH的活性。设置标准品和样本孔,标准品孔加入不同浓度标准品50 mL,待测样本孔先加样本10 μL,再加样本稀释液40 μL。随后标准品孔和样本孔中加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的待检抗体100 μL,用封板膜封住反应孔,恒温箱孵育60 min,弃去液体,吸干。加洗涤液静置1 min,甩去洗涤液,吸干,如此重复5 次。加入底物50 μL,37 ℃避光孵育15 min,加入终止液50 μL,15 min内,在450 nm波长处测定各孔光密度(OD)值。
1.2.6免疫印迹法检测心肌组织中Akt、p-Akt、GSK-3β、p-GSK-3β蛋白表达
取药物处理后的心肌组织,用组织裂解液抽提蛋白,将蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)、蛋白转膜、免疫反应、化学显影和定影,比较各组差异进行分析。
1.3统计学分析
2 结果与分析
2.1各组心功能变化的比较
方差分析显示,心功能指标在各组大鼠之间存在明显统计学差异(P<0.01)。两两比较结果表明,表1中与CON组相比,I/R组HR在灌注不同时间内减慢(P<0.01),与I/R组比较,SchB预保护作用增加了HR(P<0.01),与I/R+SchB组比较,I/R+SchB+CC组HR减慢(P<0.01);表2中,灌注后I/R组LVEDP升高,与I/R组相比,SchB预保护作用降低LVEDP,I/R+SchB+CC组中LVEDP比缺血前有所增加;表3、4中+dp/dtmax及-dp/dtmax经缺血再灌注后均明显降低,I/R+SchB组+dp/dtmax及-dp/dtmax与I/R组相比增加,I/R+SchB+CC组和I/R+SchB+LY组使+dp/dtmax及-dp/dtmax比I/R+SchB组有所下降;表5中,与CON组比较,I/R组CF明显降低(P<0.01),I/R+SchB组CF比I/R组有所提高,I/R+SchB+LY和I/R+SchB+CC组与I/R+SchB组相比不同程度降低CF;表6中,与CON组相比,各组的LDH活性均明显升高(P<0.01),与I/R组相比,I/R+SchB组的LDH活力降低,与I/R+SchB组相比,I/R+SchB+LY组和I/R+SchB+CC组的LDH活力升高。
表1 北五味子乙素对大鼠离体心脏心肌缺血再灌注损伤心率的影响Table 1 Effect of SchB on heart rate of isolated hearts from rats with myocardial ischemia and reperfusion
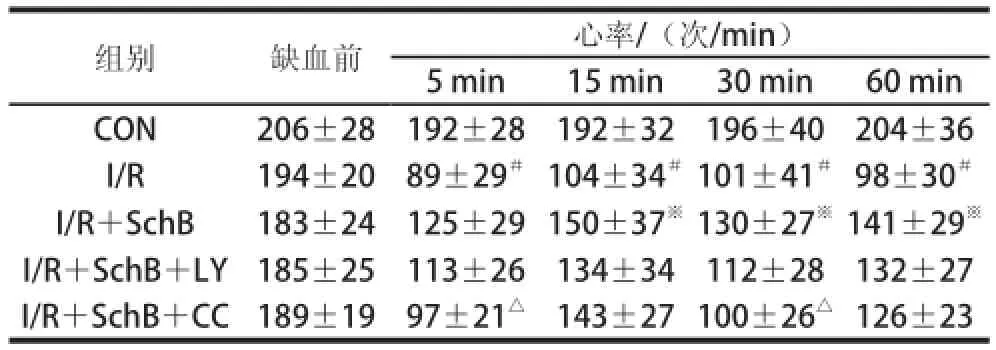
表1 北五味子乙素对大鼠离体心脏心肌缺血再灌注损伤心率的影响Table 1 Effect of SchB on heart rate of isolated hearts from rats with myocardial ischemia and reperfusion
注:#. 与CON组比较,差异显著(P<0.01);※. 与I/R组比较,差异显著(P<0.01);△. 与I/R+SchB组比较,差异显著(P<0.01)。下同。
组别 缺血前心率/(次/min)5 min15 min30 min60 min CON206±28192±28192±32196±40204±36 I/R194±2089±29#104±34#101±41#98±30#I/R+SchB183±24125±29 150±37※130±27※141±29※I/R+SchB+LY185±25113±26134±34112±28132±27 I/R+SchB+CC189±1997±21△143±27 100±26△126±23
表2 北五味子乙素对大鼠离体心脏心肌缺血再灌注损伤左心舒张末期压力的影响TTaabbllee 22 EEffffeeccttss ooff SScchhBB oonn LLVVEEDDPP ooff iissoollaatteedd hheeaarrttss ffrroomm rraattss wwiitthh myocardial ischemia and reperfusion
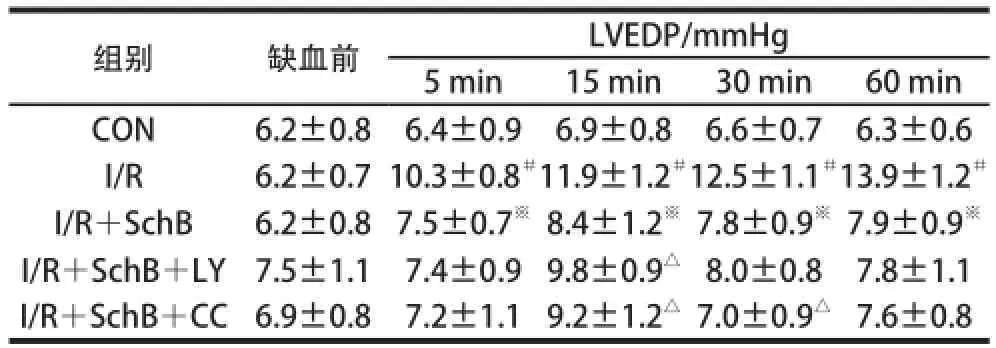
表2 北五味子乙素对大鼠离体心脏心肌缺血再灌注损伤左心舒张末期压力的影响TTaabbllee 22 EEffffeeccttss ooff SScchhBB oonn LLVVEEDDPP ooff iissoollaatteedd hheeaarrttss ffrroomm rraattss wwiitthh myocardial ischemia and reperfusion
组别缺血前LVEDP/mmHg 5 min15 min30 min60 min CON6.2±0.86.4±0.96.9±0.86.6±0.76.3±0.6 I/R6.2±0.7 10.3±0.8#11.9±1.2#12.5±1.1#13.9±1.2#I/R+SchB6.2±0.8 7.5±0.7※8.4±1.2※7.8±0.9※7.9±0.9※I/R+SchB+LY7.5±1.17.4±0.9 9.8±0.9△8.0±0.87.8±1.1 I/R+SchB+CC6.9±0.87.2±1.1 9.2±1.2△7.0±0.9△7.6±0.8
表3 北五味子乙素对大鼠离体心肌缺血再灌注后左室收缩压最大上升速率的影响Table 2 Effects of SchB on LVEDP of isolated hearts from rats with myocardial ischemia and reperfusion (x

表3 北五味子乙素对大鼠离体心肌缺血再灌注后左室收缩压最大上升速率的影响Table 2 Effects of SchB on LVEDP of isolated hearts from rats with myocardial ischemia and reperfusion (x
组别缺血前+dp/dtmax/(mmHg/s)5 min15 min30 min60 min CON5 012±1885 016±2215 120±2204 995±2234 895±230 I/R5 003±268 3 186±322#2 248±320#2 013±350#1 940±332#I/R+SchB5 026±308 4 018±332※3 746±303※3 215±327※3 024±328※I/R+SchB+LY5 045±3803 987±3213 550±3183 002±345 2 042±321△I/R+SchB+CC5 012±2784 001±318 2 780±305△2 500±234△2 237±315△
表4 北五味子乙素对大鼠离体心肌缺血再灌注后左室舒张压最大下降速率的影响(Table 4 Effect of SchB on left ventricular diastolic blood pressure(-d /d max) in isolated rat hearts

表4 北五味子乙素对大鼠离体心肌缺血再灌注后左室舒张压最大下降速率的影响(Table 4 Effect of SchB on left ventricular diastolic blood pressure(-d /d max) in isolated rat hearts
组别缺血前-dp/dtmax/(mmHg/s)5 min15 min30 min60 min CON4 560±188 4 572±245 4 512±220 4 589±223 4 563±230 I/R4 580±168 3 162±222#3 001±220#2 980±250#2 787±232#I/R+SchB4 566±208 3 518±232※3 646±203※3 715±227 3 924±228 I/R+SchB+LY4 578±280 3 687±221 3 550±218 3 002±245△2 742±221△I/R+SchB+CC4 596±278 3 535±218 3 280±205 3 200±234△3 037±215△
表5 北五味子乙素对大鼠离体心脏冠脉流速的影响TTaabbllee 55 EEffffeecctt ooff SScchhBB oonn ccoorroonnaarryy ffllooww rraattee (CCFF) iinn iissoollaatteedd rraatt hearrttss
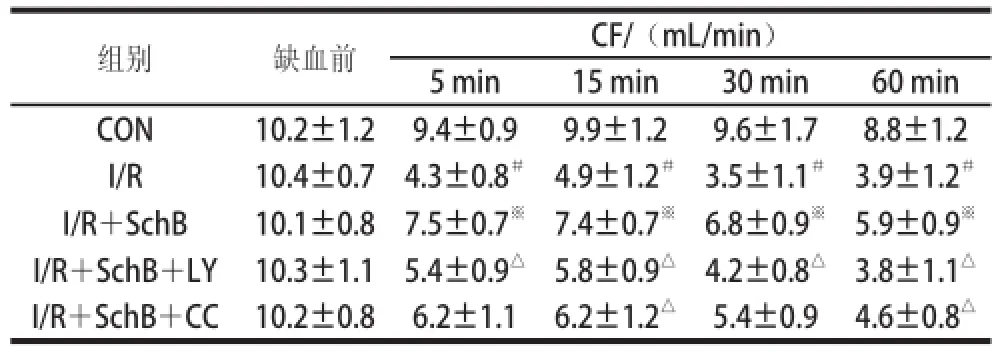
表5 北五味子乙素对大鼠离体心脏冠脉流速的影响TTaabbllee 55 EEffffeecctt ooff SScchhBB oonn ccoorroonnaarryy ffllooww rraattee (CCFF) iinn iissoollaatteedd rraatt hearrttss
组别缺血前CF/(mL/min)5 min15 min 30 min60 min CON10.2±1.29.4±0.99.9±1.29.6±1.78.8±1.2 I/R10.4±0.74.3±0.8#4.9±1.2#3.5±1.1#3.9±1.2#I/R+SchB10.1±0.87.5±0.7※7.4±0.7※6.8±0.9※5.9±0.9※I/R+SchB+LY10.3±1.15.4±0.9△5.8±0.9△4.2±0.8△3.8±1.1△I/R+SchB+CC10.2±0.86.2±1.16.2±1.2△5.4±0.94.6±0.8△
表6 北五味子乙素对大鼠离体再灌注灌流液中乳酸脱氢酶活性的影响Table 6 Effect of SchB on LDH activity in isolated rat hearts

表6 北五味子乙素对大鼠离体再灌注灌流液中乳酸脱氢酶活性的影响Table 6 Effect of SchB on LDH activity in isolated rat hearts
组别缺血前LDH活力/(U/L)5 min15 min30 min60 min CON12.34±4.87 14.21±4.81 12.15±4.25 12.24±5.1714.37±5.27 I/R11.24±2.62 58.02±7.94#67.04±8.45#71.01±14.11#98.73±10.21#I/R+SchB11.43±2.45 35.54±5.95※48.28±7.78※43.42±8.72※44.26±5.95※I/R+SchB+LY 11.26±3.57 53.78±7.65△63.41±10.4868.02±9.84△82.35±10.77△I/R+SchB+CC 12.34±4.97 48.36±6.14△60.14±7.65△60.32±8.65△80.45±8.34△
2.2各组心肌梗死面积(infarct size,IS)
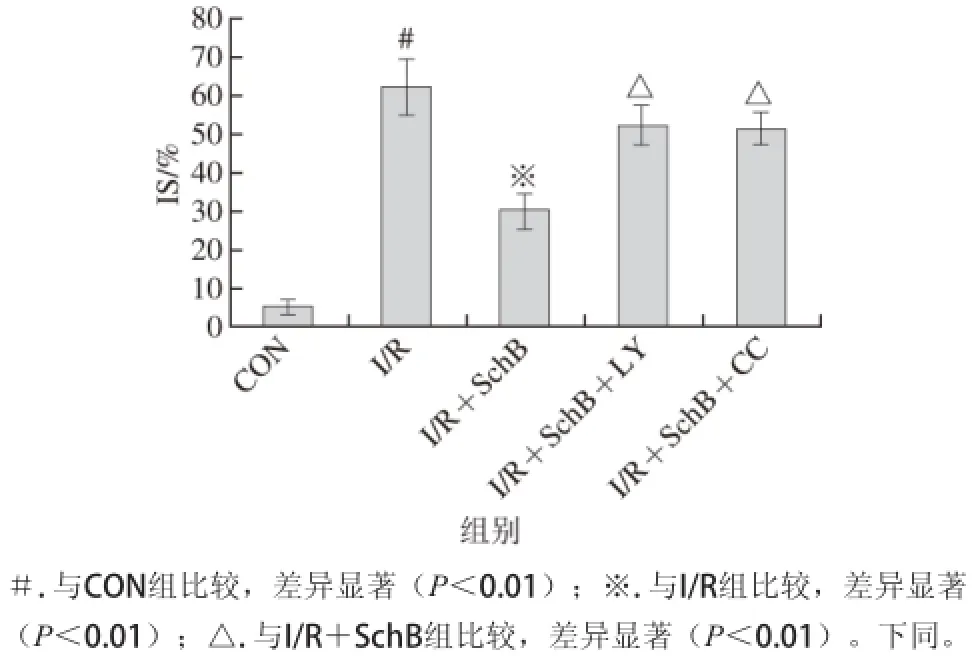
图1 实验各组心肌梗塞面积的变化Fig. 1 Change in myocardial infarction size in control and experimental groups
由图1可知,与CON组相比,I/R组IS显著增加(P<0.01),经SchB预保护作用后,与I/R组相比,IS明显减轻(P<0.01);与I/R+SchB组比较,I/R+SchB+LY组与I/R+SchB+CC组IS均增加(P<0.01)。
2.3免疫印迹检测各组蛋白表达变化
由图2、3可知,与CON组相比,I/R组p-Akt和p-GSK-3β蛋白表达虽有增加,但无统计学差异。与I/R组比较,I/R+SchB组的p-Akt和p-GSK-3β表达明显增加(P<0.01);与I/R+SchB组相比,I/R+ SchB+LY组与I/R+SchB+CC组p-Akt和p-GSK-3β蛋白表达明显减少(P<0.01)。各组总Akt和总GSK-3β均无明显改变。
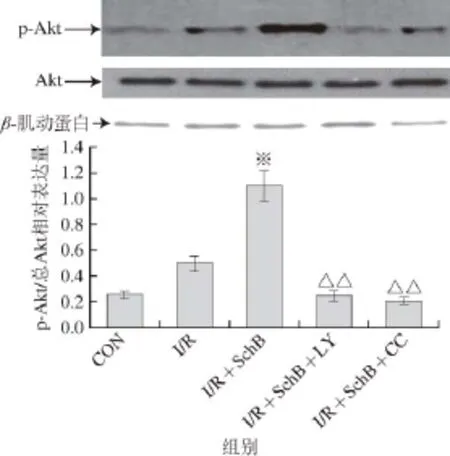
图2 免疫印迹检测实验各组p-Akt蛋白的表达Fig. 2 The expression of p-Akt and total Akt protein in each myocardial tissue examined by Western blotting
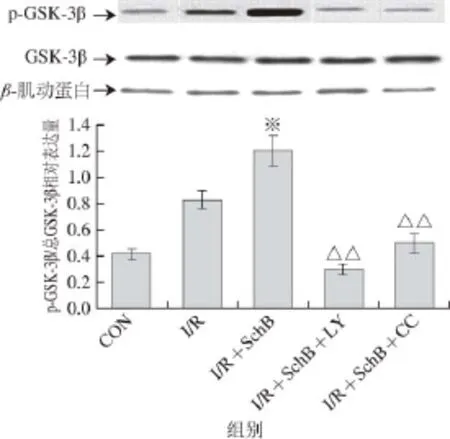
图3 免疫印迹检测实验各组p-GSKK--33β蛋白的表达(Fig. 3 The expression of p-GSK-3β and total GSK-3β protein in each myocardial tissue examined by Western blotting
3 讨 论
缺血/再灌注时,在恢复血流的不同时间里,会导致心室肌收缩和舒张功能发生障碍,表现为心室肌静息张力的增加和发展张力的下降,LVEDP升高;LVEDP下降以及心室内压最大变化速率(左室收缩压最大上升速率(+dp/dtmax))降低[9]。心功能是反映I/R损伤严重程度的指标,LVDP(上升速率(+dp/dtmax))反映左心室的收缩功能,左室收缩压最大下降速率(-dp/dtmax)反映左心室的舒张功能,当心肌损伤程度越重,梗死面积越大,上述水平越低。心肌I/R时心肌细胞膜损伤,破坏了膜的完整性,导致膜通透性增加,大量的心肌酶外漏。心肌酶LDH被认为是心肌细胞受损程度的重要标志酶[10]。本实验结果表明,SchB可改善心肌功能,减少梗死面积,抑制HR、CF、±dp/dtmax的下降,降低LVEDP,抑制I/R大鼠心肌组织中LDH活性的升高,因此SchB可以减少I/R对心肌细胞的破坏作用,保护心肌组织。
PI3K/蛋白激酶B(protein kinase B,PKB)/Akt信号通路作为细胞内重要信号转导通路之一,通过影响下游多种效应分子的活化状态,在细胞内发挥抗凋亡、促细胞生存等功能[11-15]。GSK-3β是蛋白激酶B的下游信号中主要的效应分子,PKB位于PI3K的下游,PI3K/Akt信号通路通过调控GSK-3β的活性,减少线粒体通透性转换孔(mitoc hondrial permeability transition pore,mPTP)的开放,发挥保护心肌功能[16-20]。诸多研究已证实PI3K/Akt/ GSK-3β信号途径在缺氧复氧、缺血再灌注损伤中发挥重要作用,表现为心肌梗死范围减少、改善心脏收缩舒张功能、抑制细胞调亡。许多刺激因子通过PI3K/Akt传导途径的介导促使GSK-3β磷酸化,从而抑制GSK-3β的生物活性。GSK-3β的磷酸化能减轻心肌缺氧复氧损伤、减少细胞调亡,但详细的机制尚未明确。
AMPK不仅是细胞内能量代谢的重要调控因子,而且能通过抗氧化应激、内质网应激、抑制凋亡、调节自噬、抗炎、参与缺血预处理或缺血后处理等心肌保护效应减轻心肌缺血再灌注损伤,AMPK在防治心肌缺血再灌注损伤中发挥重要作用[21-25]。
与空白对照组相比,I/R组p-Akt和p-GSK-3β表达增加,但无统计学意义,说明I/R能够启动PI3K/Akt及下游的GSK-3β信号通路。本实验体外I/R之前给予SchB预处理,总Akt和总GSK-3β蛋白在各组之间无明显改变,心肌组织中p-Akt、p-GSK-3β蛋白表达增加,较I/R组比较有显著差异(P<0.01),说明SchB预处理激活了PI3K/Akt/GSK-3β通路和AMPK通路,减轻了心肌细胞调亡,减少心肌梗死范围,心肌功能得到保护。预先给予PI3K的抑制剂LY294002阻断PI3K/Akt/GSK-3β通路,给予AMPK抑制剂复合物C阻断AMPK通路后,细胞调亡增加,心肌梗死面积加大,心肌组织中p-Akt、p-GSK-3β蛋白表达减少,与I/R+SchB组比较有显著差异(P<0.01),与I/R组比较无差异,即阻断PI3K/Akt/GSK-3β通路和AMPK通路后SchB的保护作用消失,因此可以推断SchB是通过同时激活PI3K/Akt/GSK-3β和AMPK两条并行通路发挥对I/R心肌的保护作用,从而减轻心肌缺血再灌注期间的损伤。
[1] 高夏青, 薛凌. 心肌缺血再灌注损伤相关细胞因子及细胞通路研究进展[J]. 中国动脉硬化杂志, 2013, 21(6): 562-566.
[2] 陈辉, 郑敏, 叶华山. 心肌缺血再灌注损伤机制及治疗研究进展[J].湖北科技学院学报(医学版), 2015, 29(3): 262-265.
[3] 刘玲玲, 颜水进, 潘闽, 等. CD137与心肌缺血-再灌注损伤[J]. 南通大学学报(医学版), 2014(6): 70-74.
[4] 刘春伟, 丛洪良, 于雪芳, 等. PI3K-Akt, mito-KATP通道及mPTP在阿托伐他汀后处理减轻人鼠心肌缺血再灌注损伤中的作用[J]. 天津医药, 2015, 43(1): 49-53. DOI:10.3969/ j.issn.0253-9896.2015.01.012.
[5] 于立明, 杨阳, 刘丽君, 等. 褪黑素减轻心肌缺血/再灌注损伤的作用及机制[J]. 心脏杂志, 2015, 27(3): 255-258.
[6] 孙潇, 姜恩平, 陈建光. 北五味子总木脂素对高脂血症大鼠心肌缺血再灌注损伤的保护作用及其机制[J]. 吉林大学学报(医学版),2009, 35(2): 276-280.
[7] WILLIAMS I A, XIAO X H, JU Y K, et al. The rise of [Na+] during ischemia and reperfusion in the rat heart- underlying mechanisms[J]. European Journal of Physiology, 2007, 454(6): 903-912.
[8] 张中亚, 李刚, 砖席芳, 等. 黄苏试预处理对缺血再灌注大鼠心功能和心肌细胞游离钙的影响[J]. 微循环学杂志, 2015, 25(1): 18-22. DOI:10.3969/j.issn.1005-1740.2015.01.005.
[9] 高啸巍, 刘苑, 杨智承, 等. 毛茛总苷对大鼠离体心脏缺血&再灌注损伤的保护作用[J]. 中药材, 2014, 37(8): 1429-1433. DOI:10.13863/ j.issn1001-4454.2014.08.030.
[10] 段忠心, 刘兴奎, 喻田. 二氮嗪后处理对离体大鼠心功能及线粒体心磷脂的影响[J]. 中国病理生理杂志, 2015, 31(5): 812-816. DOI:10.3969/j.issn.1000-4718.2015.05.008.
[11] 杨述亮, 韩燕, 李占清. PI3K/AKT/GSK 3β信号通路与心肌缺血/再灌注损伤的相关性研究[J]. 医学综述, 2015, 21(9): 1571-1574. DOI:10.3969/j.issn.1006-2084.2015.09.013.
[12] 蔡怀秋, 张改改, 尹新华. AMPK与心肌缺血气再灌注损伤[J]. 国际心血管病杂志, 2013, 40(1): 12-15. DOI:10.3969/j.issn.1673-6583.2013.01.005.
[13] 武怡, 王雨稼, 韩向东. 中药抗心肌细胞缺血再灌注损伤相关信号通路的实验研究进展[J]. 上海中医药大学学报, 2015, 29(2): 84-86.
[14] 韩军, 宣佳利, 胡浩然, 等. 金丝桃苷预处理减轻大鼠心肌缺血再灌注损伤作用与PI3K/Akt信号通路的关系[J]. 中国中药杂志, 2015,40(1): 118-123. DOI:10.4268/cjcmm20150123.
[15] 刘晓敏. 人参皂普Rb3及Rb2组合物对大鼠心肌缺血再灌汪损伤的保护作用及机制研究[D]. 长春: 吉林大学, 2014: 11.
[16] XIE X, LI W, LAN T, et al. Berberine ameliorates hyperglycemia in alloxan-induced diabetic C57B1/6 mice through activation of Akt signaling pathway[J]. Endocrine Journal, 2011, 58(9): 761-768. DOI:10.1155/2014/798093.
[17] ANSLEY D M, WANG B. Oxidative stress and myocardial injury in the diabetic heart[J]. Journal of Pathology, 2013, 229(2): 232-241. DOI:10.1002/path.4113.
[18] HU J, CHAI Y, WANG Y, et al. PI3K p55γ promoter activity enhancement is involved in the anti-apoptotic effect of berberine against cerebral ischemia-reperfusion[J]. European Journal of Pharmacology,2012, 674(2/3): 132-142. DOI:10.1016/j.ejphar.2011.11.014.
[19] 薛凌. 丹酚酸B通过PI3K-Akt信号通路干预大鼠心肌缺血再灌注损伤的实验研究[D]. 济南: 山东大学, 2014: 10.
[20] 张静, 马翠丽, 土志国. 黄茂甲苷对大鼠心肌局部缺血再灌注损伤的改善作用及其对PI3K/Akt/mTOR信号通路的影响[J]. 吉林大学学报, 2014, 40(5): 991-997. DOI:10.13481/j.1671-587x.20140517.
[21] 李艳, 陈震. PI3K-Akt信号通路及β2-AR蛋白在外源性硫化氢后处理减轻大鼠离体心肌缺血再灌注损伤中的作用[J]. 中国现代医药杂志, 2014, 16(9): 1-5. DOI:10.3969/j.issn.1672-9463.2014.09.001.
[22] 陈克克. 小粟碱通过激活AMPK及PI3K/Akt减轻糖尿病大鼠心肌缺血/再灌注损伤[D]. 西安: 第四军医大学, 2014: 5.
[23] FROHLICH G M, MEIER P, WHITE S K, et al. Myocardial reperfusion injury: looking beyond primary PCI[J]. European Journal of Heart, 2013, 34(23): 1714-1722. DOI:10.1093/eurheartj/eht090.
[24] SONY G, OUYANG G, BAO S. The activation of Akt/PKB signaling pathway and cell survival[J]. Journal of Cell Molecular Medicine,2005, 9(1): 59-71. DOI:10.1111/j.1582-4934.2005.tb00337.x.
[25] 何东伟, 刘新伟, 庞勇, 等. 白藜芦醇对人鼠缺血再灌注心肌细胞凋亡的抑制作用与PI3K-Akt信号通路的关系[J]. 中国中药杂志, 2012,37(15): 2323-2326. DOI:10.4268/cjcmm20121529.
Protective Effect of Schisandrin B on the Isolated Rat Heart against Myocardial Ischemia/Reperfusion Injury and Its Molecular Mechanism
SUN Hongxia, CHEN Jianguang*
(Pharmaceutical College, Beihua University, Jilin 132013, China)
Objective: To observe the effect of schisandrin B (SchB) on cardiac function, infarct size, lactate dehydrogenase and related protein expression in the isolated heart from rats with myocardial ischemia/reperfusion (I/R) injury and consequently to explore its protective effect against I/R injury and the underlying molecular mechanism. Methods: Fifty Wistar rats were randomly divided into five groups: control group (Control), ischemia/reperfusion group (I/R) and SchB preconditioning group (SchB), PI3K inhibitor group (I/R + SchB + LY294002), and AMPK inhibitor group (I/R + SchB + Compound C). The Langendorff method was used to establish the isolated rat heart model of I/R injury, ischemia for 2 h, reperfusion for 5, 15, 30 and 60 min respectively. The +dp/dtmax, -dp/dtmax, left ventricular end-diastolic pressure(LVEDP), coronary flow (CF), heart rate (HR) and LDH activity in perfusion fluids were observed during I/R period. The myocardial infarct area was measured with TTC staining and myocardial total Akt, phosphorylation Akt, total GSK-3β and phosphorylation GSK-3β protein expression were evaluated by the Western blotting technique. Results: SchB significantly improved the myocardial damage caused by I/R injury, reduced infarct size, and increased the expression of p-Akt and p-GSK-3β. Conclusion: SchB has protective effects against I/R damage in isolated hearts from rats, which may be related to the activation of the AMPK and PI3K/Akt signaling pathways.
schisandrin B; myocardial ischemia/reperfusion; injury; molecular mechanism
10.7506/spkx1002-6630-201615040
R285.5
A
1002-6630(2016)15-0237-05
2015-09-18
吉林省卫生计生科研计划项目(20142084)
孙红霞(1965—),女,教授,博士,主要从事心血管药理学研究。E-mail:sunhongxiajl@126.com
陈建光(1962—),男,教授,博士,主要从事中药开发及药理学研究。E-mail:chenjg118@sohu.com
10.7506/spkx1002-6630-201615040. http://www.spkx.net.cn
引文格式:

