体素内不相干运动对前列腺癌和前列腺增生结节的鉴别诊断
孙美玉, 刘爱连, 李烨, 陈丽华, 宋清伟, 徐斌
·腹部影像学·
体素内不相干运动对前列腺癌和前列腺增生结节的鉴别诊断
孙美玉, 刘爱连, 李烨, 陈丽华, 宋清伟, 徐斌
目的:分析前列腺癌(PCa)和前列腺增生(BPH)的体素内不相干运动(IVIM)参数,旨在评价IVIM对PCa和BPH的鉴别诊断价值。方法:回顾性分析72例经病理证实PCa(n=32)和BPH(n=40)患者的3.0T MR图像,扫描序列包括常规T2WI、DWI、LAVA平扫及动态增强和IVIM。IVIM成像,扫描采用EPI-STIR序列,b值=0、20、50、100、200、400、600、800、1000和1200 s/mm2。利用GE Functool 4.5工作站的MADC软件,测量PCa和BPH组的标准ADC、慢ADC、快ADC和快ADC分数值,PCa和BPH组的各参数比较采用独立样本t检验。采用受试者工作曲线(ROC)分析标准ADC值、慢ADC值对PCa和BPH的鉴别效能,获得相应曲线下面积(AUC)、诊断PCa的阈值以及相应灵敏度、特异度、阳性预测值(PPV)、阴性预测值(NPV)和准确度。结果:PCa的标准ADC值和慢ADC值分别为(6.21±2.35)×10-4和(7.11±2.49)×10-4mm2/s,BPH的标准ADC值和慢ADC值分别为(11.11±2.62)×10-4和(12.65±1.81)×10-4mm2/s,PCa者明显低于BPH者,二者之间的差异具有统计学意义。PCa和BPH的快ADC值和快ADC值分数之间的差异无统计学意义。标准ADC值、慢ADC值AUC分别为0.912和0.947。以8.325×10-4mm2/s作为标准ADC值的阈值,其诊断PCa的敏感度为78.13%,特异度为97.50%,PPV为96.15%,NPV为84.78%,准确率为88.89%。以10.03×10-4mm2/s作为慢ADC值的阈值,其诊断PCa的敏感度为87.50%,特异度为95.00%,PPV为93.33%,NPV为90.48%,准确率为91.67%。结论:IVIM的定量参数标准ADC和慢ADC值对PCa和BPH鉴别诊断效能好,可作为前列腺增生基础上PCa检出良好的指标。
前列腺肿瘤; 前列腺增生; 磁共振成像
目前临床上诊断前列腺癌(prostate cancer,PCa)的金标准是经直肠前列腺穿刺活检或术后病理,但对临床疑似的PCa患者,假阴性率高达66%~71%。中老年男性,PCa和良性前列腺增生(benign prostatic hyperplasia,BPH)常合并存在,但二者治疗方案和临床预后完全不同[1,2]。部分PCa和BPH的临床表现、实验室检查(PSA水平)存在重叠,常规MR影像鉴别诊断亦存在困扰[3,4]。
磁共振扩散加权成像(diffusion weighted imaging,DWI)获得的ADC图在Pca和BPH的诊断和鉴别诊断中发挥重要作用[5]。常规DWI上PCa与BPH相比,因细胞外间隙减小、弥散受限而表现为高信号,ADC图呈低信号;但既往的一些研究[6-8]显示以高斯弥散为数学模型(单指数)计算的ADC值受不同b值选择的影响。体素内不相干运动(intra-voxel incoherent motion,IVIM)MR成像除了考虑分子热运动所致的分子扩散外,还考虑到基于灌注的假弥散[9],无需对比剂,可无创检测并提取活体组织的扩散(高b值)和灌注(低b值)信息,反映疾病的病理生理改变[9,10]。既往的研究多集中在Pca和正常前列腺组织之间的IVIMMR成像的差别[11-15],对PCa和BPH的IVIM参数的对比研究鲜见。本研究通过对PCa和BPH的IVIM成像及参数分析,旨在评价IVIM成像参数对PCa和BPH的鉴别诊断价值。
材料与方法
1.临床资料
该研究获得大连医科大学附属第一医院伦理委员会核准并免除患者的知情同意。回顾性分析我院2012年11月-2015年7月行前列腺MRI检查且进行手术确诊为PCa和BPH男性患者,纳入标准为:①能配合MRI检查,前列腺成像清晰;②患者在完成MRI检查后一个月内进行超声引导下经直肠前列腺穿刺活检或前列腺切除手术病理证实。排除标准:①MRI检查前进行过活检或相关治疗者;②既往前列腺手术者;③肠道伪影重,图像质量影响分析者。最后共纳入72例,其中PCa组32例,年龄53~88岁,平均年龄71.41岁;BPH组40例,年龄51~90岁,平均年龄68.73岁。
2.成像方法
采用GE Signa 3.0T磁共振扫描仪,梯度场强40 mT·m,切换率为150 T/ms。患者仰卧位,以体线圈为射频发射线圈,8通道腹部相控阵线圈为接收线圈。检查前患者适量饮水,膀胱中度充盈,防止过度充盈引起波动伪影及检查时间过长致患者无法耐受。盆腔置于线圈内,线圈中心对耻骨联合上缘,采用横断面扫描,包括前列腺及精囊腺。
T2WI序列参数:TR 3820 ms,TE 140 ms,层厚4 mm,层间距2 mm,视野30×30,矩阵320×224,激励次数4;DWI序列参数:TR 3575 ms,TE 87 ms,b=0,1000 s/mm2,层厚5 mm,层间距1 mm,视野30×30,矩阵128×128,激励次数8。LAVA动态增强序列参数:TR 3 ms,TE 2 ms,层厚5.2 mm,层间距1.3 mm,矩阵288×180,视野38×30,连续扫描30个期相; IVIM-MR成像具体参数:横断面二维扫描,平面回波成像-短时反转恢复(echo planar imaging-short time inversion recovery,EPI-STIR)序列;TR 3000 ms,TE 86 ms,翻转角90°,视野40 cm×40 cm,层厚5 mm,层间距1 mm,矩阵96×128,激励次数8,方向:所有,b值范围0~1200 s/mm2,分别为b=0、20、50、100、200、400、600、800、1000和1200 s/mm2,扫描时间240 s。
3.病理学检查及图像后处理
72例患者前列腺穿刺、部分或全部切除术后标本由两位(分别有12年和7年前列腺疾病诊断经验)病理医生对病变进行定位和诊断,他们在病理诊断前不知晓MRI检查结果。
IVIM成像一次扫描获得b值0~1200 s/mm2的10组图像,利用GE Functool 4.5工作站的MADC软件,由2位前列腺MRI读片经验分别为14年和6年的放射科医师对MR图像分别进行评估和测量,确定每例PCa和BPH病灶的区域。PCa组癌区为T2WI抑脂序列呈低信号、DWI呈高信号和/或增强扫描明显强化且病理结果为前列腺癌的区域,如果有多个病灶,则选取最大的病灶入组进行测量。BPH组结节性增生者,感兴趣区(region of interest,ROI)覆盖结节 2/3 以上,弥漫性增生者,于中央腺体区(CZ)选取 ROI 进行测量,ROI大小约为50~70 mm2,ROI位于病灶的实性部分,尽量避开囊变、尿道区域,每次测量绘制3个大小相等的ROI,分别测量并记录IVIM的标准表观弥散系数(apparent diffusion coefficient,ADC)值、慢ADC、快ADC和快ADC分数,取3次测量值的平均值用于统计学分析。
4.统计学方法
分别记录两位观察者测量的PCa和BPH的标准ADC、慢ADC、快ADC和快ADC分数,用均数±标准差的方式表示,使用组内相关系数(intra-class correlation coefficients,ICC)检验两观察者测量数据的一致性(ICC值>0.75为一致性很好,ICC在0.5~0.75为一致性良好,<0.5为一致性很差)。选择标准差小的数据进行下一步的统计分析。应用SPSS 17.0软件对相应数据进行独立样本的t检验,P<0.05为差异有统计学意义,使用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析标准ADC值、慢ADC值、快ADC值和快ADC分数对PCa和BPH的鉴别效能,获得相应曲线下面积(area under the curve,AUC)(AUC>0.9为诊断效能高、AUC介于0.7~0.9为诊断效能中等,AUC介于0.5~0.7为诊断效能低),利用约登指数最大原则,对诊断效能高的参数诊断PCa的阈值以及相应灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和准确度。

表1 PCa和BPH 组ADC值(mm2/s)

表2 标准ADC值及慢ADC值诊断阈值、敏感度、特异度、PPV、NPV及准确率
结 果
1.两位观察者之间定量数据比较
两观察者所测量标准ADC值、慢ADC值、快ADC值和快ADC分数的ICC值分别为:0.915、0.937、0.853及0.770,一致性均良好。使用标准差较小的数据进行以下比较。
2.PCa和BPH的IVIM参数比较
PCa组的标准ADC值、慢ADC值明显低于BPH组,二者之间的差异有统计学意义。PCa组的快ADC值及快ADC分数与BPH组之间无显著性差异(表1、图1~6)。
3.ROC曲线分析
PCa组和BPH组的标准ADC值、慢ADC值、快ADC值和快ADC分数的ROC曲线见图7,其中标准ADC值、慢ADC值、快ADC值和快ADC值分数的AUC分别为0.912、0.947、0.504和0.706(表1),其中标准ADC值和慢ADC值的诊断效能高,快ADC值的诊断效能低,而快ADC值分数的诊断效能中等。以8.325×10-4mm2/s作为标准ADC值的阈值,其诊断PCa的敏感度为78.13%,特异度为97.50%,阳性预测值为96.15%,阴性预测值为84.78%,准确率为88.89%。以10.03×10-4mm2/s作为慢ADC值的阈值,其诊断PCa的敏感度为87.50%,特异度为95.00%,阳性预测值为93.33%,阴性预测值为90.48%,准确率为91.67%(表2)。
讨 论
临床上Pca常发生在有BPH基础的前列腺内,中老年男性多见,多需穿刺活检确诊,该方法有较高的假阴性[16],同时会引起疼痛、出血等并发症,因不能多次重复进行而使部分患者无法接受。
在生物组织内,DWI检测到的微观运动既包括水分子的弥散,还包括组织结构成分的影响以及毛细血管网的微循环(灌注),传统的单指数模型忽略了低b值时微灌注造成的快速的信号衰减,使得测得的ADC值受b值的影响[17]。在前列腺组织中,由于细胞内屏障,如细胞膜和细胞器分隔的存在,导致高b值时并不符合Gaussian单指数弥散特点[18,19]。IVIM成像技术通过将DWI技术采集的水分子弥散数据进行双指数模型的后处理分析,提取弥散系数和灌注分数,在无需对比剂的条件下对病变的灌注和弥散信息进行评估[19-21]。
本组研究中PCa标准ADC值和慢ADC值分别为(6.21±2.35)×10-4和(7.11±2.49)×10-4mm2/s,BPH的标准ADC值和慢ADC值分别为(11.11±2.62)×10-4和(12.65±1.81)×10-4mm2/s,PCa者明显低于BPH者,与既往对PCa的研究结果[13,17,20,21]相一致,即PCa的ADC值明显减低。前列腺肿瘤与良性组织相比,扩散系数减低,在病理学上,PCa细胞排列紧密,腺管及腺泡结构紊乱或消失,水分子弥散明显受限,ADC值显著下降;BPH中腺管和腺泡的增生可伴有分泌物增多,弥散相对不受限而表现为相对高的ADC值。慢ADC反映的是组织在高b值时组织的弥散特性,减少了低b值条件下灌注对弥散的影响,更能反映组织的弥散特点。本组研究中慢ADC值诊断前列腺癌AUC为0.947,较标准ADC值的AUC(0.912)略高,二者均体现良好的诊断效能,以8.325×10-4mm2/s为标准ADC值的阈值,其诊断PCa的特异度为97.50%,PPV为96.15%,准确率为88.89%。以10.03×10-4mm2/s为慢ADC值的阈值,其诊断PCa的特异度为95.00%,PPV为93.33%,NPV为90.48%,准确率为91.67%。
本组研究中PCa的快ADC值(D*-假弥散系数)为(12.97±11.27)×10-3mm2/s,较BPH者增高,但二者之间的差异无统计学意义。虽然对前列腺癌DCE-MRI的研究[22,23]表明前列腺癌与正常前列腺组织相比有着更高的血流量,但我们的结果与Kuru等[24]的研究结果相似,即PCa与非癌组织的快ADC值无显著性差异,分析可能与BPH亦会改变组织的灌注,而且不同的增生程度可能对灌注的影响亦不同[25]有关。本组研究中PCa的快ADC分数(f-灌注分数)与BPH者无显著性差异;既往对PCa快ADC值分数的研究得到不同的结果。PCa组织血供丰富,其内的微血管密度、血流量和血管通透性等血流灌注指标高于非癌组织,而快ADC值分数体现的是病灶的灌注因素对总扩散的影响比例,有学者[26-28]研究认为b<200s/mm2时能更好的体现f值的差异,本组研究中的低b值选择为0、20、50、100、200s/mm2,数值间隔范围略大,可能使灌注因素的体现受到一定的影响。Kuru等[24]的研究b值选择为0、50、100、150、200、250和800s/mm2,其结果与我们的结果相一致。部分学者[29,30]分析认为快ADC分数除了反映微血管内水分子假随机运动呈现的血容量,可能还与腔室的横向弛豫时间及其它的大分子(如腺体分泌和导管内液体)流动有关。
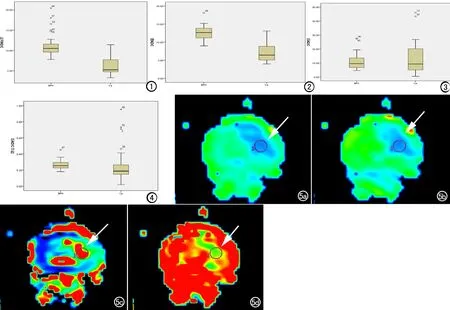
图1 PCa组和BPH组的标准ADC值箱式图。
图2 PCa组和BPH组的慢ADC值箱式图。
图3 PCa组和BPH组的快ADC值箱式图。
图4 PCa组和BPH组的快ADC值分数箱式图。
图5 患者,男,72岁,前列腺癌(Gleason3+4,箭)。a) 标准ADC为4.82×10-4mm2/s; b) 慢ADC为4.94×10-4mm2/s; c) 快ADC为19.6 ×10-3mm2/s; d) 快ADC分数为0.243。
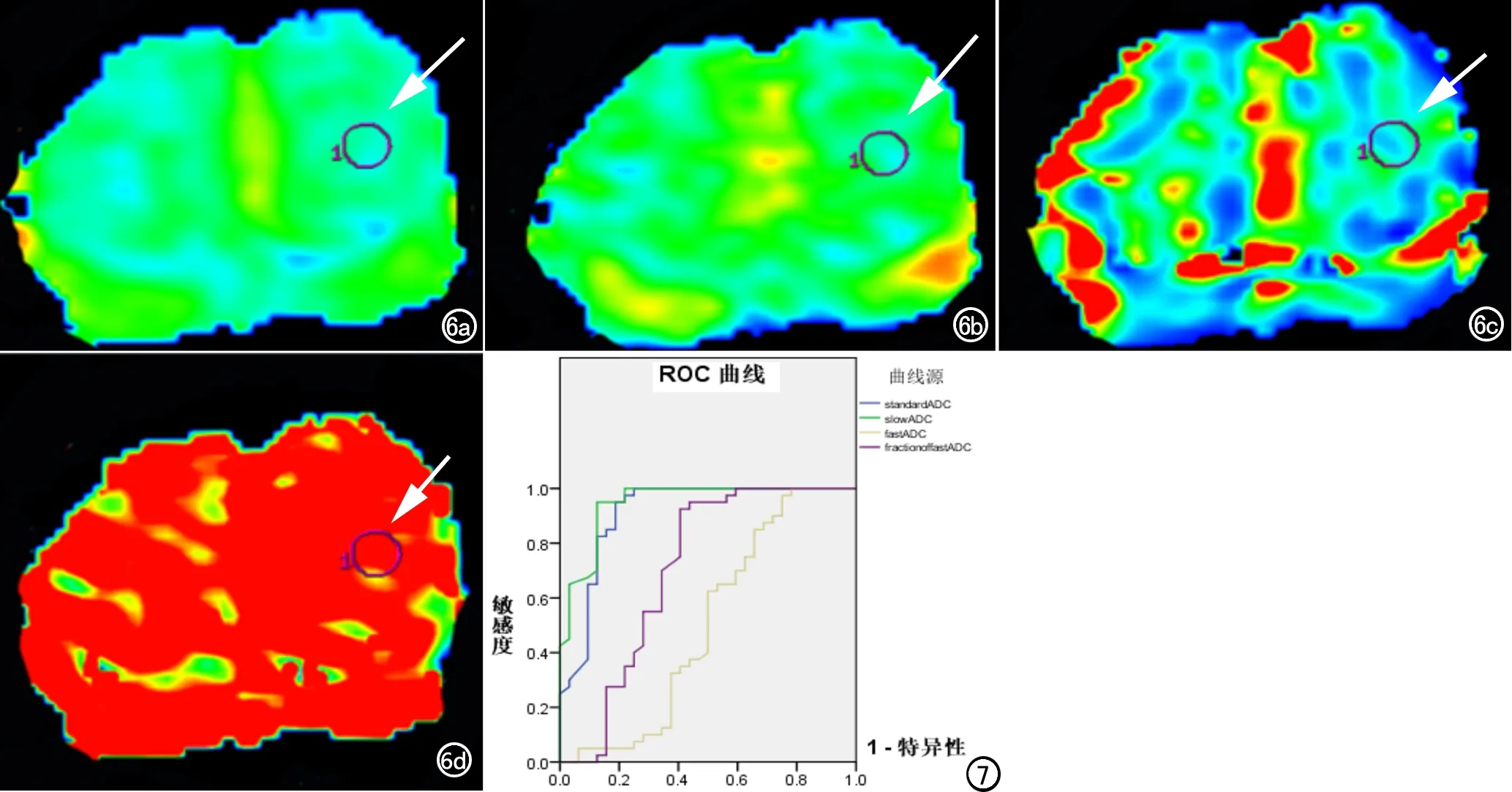
图6 患者,男,64岁,良性前列腺增生(箭)。a) 标准ADC为9.74×10-4mm2/s; b) 慢ADC为10.55×10-4mm2/s; c) 快ADC为7.95×10-3mm2/s; d) 快ADC分数为 0.307。 图7 PCa组和BPH组的标准ADC、慢ADC、快ADC和快ADC分数的ROC曲线。
IVIM可提供标准ADC、慢ADC、快ADC和快ADC分数的多参数成像,同时反映组织的弥散和灌注信息,其中的标准ADC和慢ADC值对PCa和BPH诊断效能好,可作为PCa和BPH鉴别的良好指标。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwise burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-917.
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics 2009[J].CA Cancer J Clin,2009,59(4):225-249.
[3] 陈昌毅,黄满华,王远梅,等.前列腺癌ADC值与PSA浓度的相关性研究[J].放射学实践,2013,28(1):71-74.
[4] 闫晨宇,程敬亮,高雪梅.3.0T磁共振平扫和DWI在前列腺癌诊断中的应用[J].实用放射学杂志,2013,29(1):72-76.
[5] 李鹏,杨文君,陈志强,等.3.0T扩散加权成像对前列腺中央腺体癌和增生的鉴别诊断[J].临床放射学杂志,2013,23(10):1458-1461.
[6] 杨栋,余深平,郭燕,等.标准化ADC值鉴别移行带前列腺癌与间质为主增生结节[J].中山大学学报(医学科学版),2013,34(2):287-291.
[7] 骆众星,郭宁,谢斯栋.多b值DWI在前列腺癌和前列腺增生鉴别诊断中的应用研究[J].湖北民族学院学报(医学版),2013,3(1):5-8.
[8] Peng YH,Jiang YL,Antic T,et al.Apparent diffusion coefficient for prostate cancer Imaging:impact of b values[J].AJR,2014,202(3):w247-253.
[9] Le Bihan D,Breton E,Lallemand D,et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J].Radiology,1988,168(2):497-505.
[10] Le Bihan D.Intravoxel incoherent motion perfusion MR imaging:a wake-up call[J].Radiology,2008,249(3):748-752.
[11] Pang Y,Turkbey B,Bernardo M,et al.Intravoxel incoherent motion MR imaging for prostate cancer:an evaluation of perfusion fraction and diffusion coefficient derived from different b-value combinations[J].Magn Reson Med,2013,69(2):553-562.
[12] Shinmoto H,Tamura C,Soga S,et al.An intravoxel incoherent motion diffusion-weighted imaging study of prostate cancer[J].AJR,2012,199(4):W496-W500.
[13] Riches SF,Hawtin K,Charles-Edwards EM,et al.Diffusion-weighted imaging of the prostate and rectal wall:comparison of biexponential and monoexponential modelled diffusion and associated perfusion coefficients[J].NMR Biomed,2009,22(3):318-325.
[14] Luczyńska E,Heinze-Paluchowska S,Domalik A,et al.The utility of diffusion weighted imaging (DWI).Using apparent diffusion coefficient (ADC) values in discriminating between prostateca ncer and normal tissue[J].Pol J Radiol,2014,79(12):450-455.
[15] Wang SY,Peng YH,Medved M,et al.Hybrid multidimensional T2and diffusion-weighted MRI for prostate cancer detection[J].J Magn Reson Imaging,2014,39(4):781-788.
[16] Roehl KA,Antenor JA,Catalona WJ,et al.Serial biopsy results in prostate cancer screening study[J].J Urol,2002,167(6):2435-2439.
[17] Mazaheri Y,Vargas HA,Akin O,et al.Reduction the influence of b-value selection on diffusion-weighted imaging of the prostate:evaluation of a revised monoexponential model within a clinical setting[J].J Magn Reson Imaging,2012,35(3):660-668.
[18] Quentin M,Blondin D,Klasen J,et al.Comparison of different mathematical models of diffusion-weighted prostate MR imaging[J].Magn Reson Imaging,2012,30(10):1468-1474.
[19] Pang Y,Turkbey B,Bernardo M,et al.Intravoxel incoherent motion MR imaging for prostate cancer:an evaluation of perfusion fraction and diffusion coefficient derived from different b-value combinations[J].Magn Reson Med,2013,69(2):553-562
[20] Dopfert J,Lemke A,Weidner A,et al.Investigation of prostate cancer using diffusion-weighted intravoxel incoherent motion imaging[J].Magn Reson Imaging,2011,29(8):1053-1058.
[21] Xu J,Humphrey PA,Kibel AS,et al.Magnetic resonance diffusion characteristics of histologically defined prostate cancer in humans[J].Magn Reson Med,2009,61(4):842-850.
[22] Farniel T,Ludemann L,Rudolph B,et al.Evaluation of normal prostate tissue,chronic prostatitis,and prostate cancer by quantitative perfusion analysis using a dynamic contrast-enhanced inversion-prepared dual-contrast gradient echo sequence[J].Invest Radiol,2008,43(7):481-487.
[23] McDonald DM,Choyke PL.Imaging of angiogenesis:from microscope to clinic[J].Nat Med,2003,9(6):713-725.
[24] Kuru TH,Roethke MC,Stieltjes B,et al.Intravoxel incoherent motion (IVIM) diffusion imaging in prostate cancer-what does it add?[J].J Comput Assist Tomogr,2014,38(4):558-564.
[25] De Marzo AM,Platz EA,Sutcliffe S,et al.Inflammation in prostate carcinogenesis[J].Nat Rev Cancer,2007,7(4):256-269.
[26] Klauss M,Lemke A,Grunberg K,et al.Intravoxel incoherent motion MRI for the differentiation between mass forming chronic pancreatitis and pancreatic carcinoma[J].Invest Radiol,2011,46(1):57-63.
[27] Sumi M,Van Cauteren M,Sumi T,et al.Salivary gland tumors:use of intravoxel incoherent motion MR imaging for assessment of diffusion and perfusion for the differentiation of benign from malignant tumors[J].Radiology,2012,263(3):770-777.
[28] Sigmund EE,Vivier PH,Sui D,et al.Intravoxel incoherent motion and diffusion-tensor imaging in renal tissue under hydration and furosemide flow challenges[J].Radiology,2012,263(3):758-776.
[29] Patel J,Sigmund EE,Rusinek H,et al.Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrast-enhanced MRI alone and in combination:preliminary experience[J].J Magn Reson Imaging,2010,31(3):589-600.
[30] Lemke A,Laun FB,Simon D,et al.An in vivo verification of the intravoxel incoherent motion effect in diffusion-weighted imaging of the abdomen[J].Magn Reson Med,2010,64(6):1580-1585.
Utility of Intravoxel Incoherent Motion Imaging in Differentiating Prostate Cancer from Benign Prostatic Hyperplasia
SUN Mei-yu,LIU Ai-lian,LI Ye,et al.
Department of Radiology,the First Affiliated Hospital of Dalian Medical University,Niaoning 116011,China
Objective:To analyze the intra-voxel incoherent motion (IVIM) imaging on differentiation of prostate cancer (PCa) and benign prostate hyperplasia (BPH).Methods:This retrospective study was approved by IRB.Seventy-two patients were divided into group PCa (n=32) and group BPH (n=40).Axial T2WI、DWI、LAVA dynamic contrast enhancement and IVIM imaging with EPI-STIR sequence was obtained from GE Signa 3.0T MR scanner with 10 b values of 0,20,50,100,200,400,600,800,1000,1200s/mm2,respectively.The standardADC,slowADC,fastADCand fraction of fastADCwere measured with MADC software in GE Functool 4.5 workstation.These four parameters from PCa and BPH groups were compared using the independent t test.Cut-off values of standard ADC and slowADCwere evaluated with receiver operator characteristic (ROC) analysis.Results:The mean standardADCand slowADCvalues were (6.21±2.35)×10-4mm2/s and (7.11±2.49)×10-4mm2/s for the PCa group,and (11.11±2.62)×10-4mm2/s and (12.65±1.81)×10-4mm2/s for the BPH group.The mean standard ADC and slow ADC values for PCa group were significantly lower than that of BPH group.The AUC of standardADCand slowADCwas 0.912 and 0.947.A threshold of 8.325×10-4mm2/s for the maximum standardADCvalue in the diagnosis of PCa resulted in a sensitivity of 78.13%,and a specificity of 97.50%.The positive predictive value (PPV),negative predictive value (NPV) and diagnostic accuracy for PCa were 96.15%,84.78% and 88.89%,respectively.A threshold of 10.03×10-4mm2/s for the maximum slowADCvalue in the diagnosis of PCa resulted in a sensitivity of 87.50%,and a specificity of 95.00%.The PPV,NPV and diagnostic accuracy for PCa were 93.33%,90.48% and 91.67%,respectively.Conclusion:The standardADCand slowADCvalues are significant IVIM index to differentiate PCa from BPH with satisfying sensitivity and specificity.
Prostatic neoplasms; Prostatic hyperplasia; Magnetic resonance imaging
116011 辽宁,大连医科大学附属第一医院放射科
孙美玉(1975-),女,辽宁大连人,博士,副主任医师,主要从事腹部影像诊断工作。
R445.2; R697.32; R737.25
A
1000-0313(2016)10-0947-05
10.13609/j.cnki.1000-0313.2016.10.010
2015-12-14
2016-04-25)

