黄蜀葵花期不同组织器官中多类型资源性化学成分的分析与利用价值挖掘
刘杰+郭盛+段金廒+严辉+钱大玮+唐海涛+唐仁茂


[摘要]对锦葵科植物黄蜀葵Abelmoschus manihot采收药用部位花冠过程中产生的不同组织器官(根、茎、叶和花)中的主要资源性化学成分进行分析评价,为其资源化利用提供支撑。分别采用高效液相色谱法(HPLC)、超高效液相色谱串联三重四极杆质谱法(UPLC-TQ/MS)分析黄蜀葵不同组织器官中黄酮类、核苷类及氨基酸类资源性化学成分组成及其含量;分别采用紫外-可见分光光度法、粗纤维测定法(Weende)分析黄蜀葵不同组织器官中可溶性多糖类及总纤维含量。结果显示,黄蜀葵花中富含黄酮类资源性化学成分,主要组成为金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、芦丁和槲皮素,总量为25.450 mg·g-1,叶片亦有少量黄酮类资源性化学成分分布。黄蜀葵不同组织器官均富含可溶性多糖类组分和总纤维,其中茎中总多糖量较高,达19.76%,根中总纤维量较高,可达29.88%。在黄蜀葵植物中共检出21种氨基酸类和9种核苷类资源性化学成分,其中花中氨基酸类化学成分种类及含量较为丰富,达4.737 mg·g-1;叶中核苷类化学成分含量较为丰富,为1.474 mg·g-1。黄蜀葵植物中含有丰富的资源性化学成分,且不同组织器官中所含成分的组成和含量有所差异,研究结果为黄蜀葵植物采收花后不同组织器官的精细化利用与产业化开发提供了科学依据。
[关键词]黄蜀葵; 不同组织器官; 资源性化学成分; 资源化利用
[Abstract]This research is to analyze the resourceful chemical composition in different tissues (root, stem, leaf and flower) of Abelmoschus manihot and evaluate their utilizing value. The flavonoids, soluble polysaccharides, cellulose, nucleosides and amino acids in the different tissues of A. manihot were determined by HPLC coupled with UV-Vis spectrophotpmetry, and UPLC-TQ/MS. The flowers are rich in the resourceful chemical compositions of flavonoids which mainly consist of hyperoside, isoquercitrin, cotton-8-O-glucuronide, myricetin, quercetin-3′-O-glucoside, rutin and quercetin. The total content of these flavonoids is 25.450 mg·g-1 in the flowers, while they are trace in the other tissues.Different tissues of A. manihot are rich in soluble polysaccharides and celluloses and the stems have the highest content(19.76%) of soluble polysaccharides, while the roots have the highest content (29.88%) of cellulose. Total of 21 amino acids and 9 nucleosides were detected in this plant, and the flowers have the highest content of amino acids(4.737 mg·g-1), while the leaves have the highest content of nucleosides (1.474 mg·g-1). A. manihot is rich in the resourceful chemical compositions, and its constituents and contents are various in different tissues of this plant.The results provided a scientific basis for the utilization and industrial development of A. manihot plants.
[Key words]Abelmoschus manihot; different organs and tissues; resourceful chemical composition; resourceful utilization
doi:10.4268/cjcmm20162013
黄蜀葵Abelmoschus manihot (L.) Medic.为锦葵科Malvaceae秋葵属Abelmoschus一年至多年生草本植物,原产于我国南方地区,常生于山谷草丛、田边或沟旁灌丛间,现除西北、东北等地外,全国大部分地区均有分布或栽培[1]。黄蜀葵之干燥花冠为常用中药,始载于《嘉佑本草》,其后历代本草多有记述,其味甘性寒,具有清热利湿、消肿解毒之功,内服可用于湿热壅遏、淋浊水肿等症的治疗,外敷可用于痈疽肿毒、水火烫伤。除其花冠外,其种子、根、茎和叶片也有药用记载,其功用与花冠相似,但临床应用较少。现代药理研究表明,黄酮类化学成分是黄蜀葵花含有的主要活性成分之一,具有保护肝脏、保护心脑血管系统及抑制肿瘤细胞增殖等作用,此外对慢性肾炎也具有一定的治疗作用[2-4]。另据文献报道,黄蜀葵植物中含有的多糖类[5]、纤维素类、核苷类及氨基酸类化学成分均具有潜在的开发利用价值。
目前,在黄蜀葵资源植物利用过程中,主要以采摘其花冠用于中医临床或作为中药制剂黄葵胶囊的主要原料,在此过程中大量茎、叶、根等组织器官缺乏有效利用途径而废弃,造成资源浪费与环境污染。据此,本研究采用现代分析方法对黄蜀葵植物在药材采收过程中产生的不同组织器官(花、根、茎、叶)中多类型资源性化学成分(黄酮类、核苷类、氨基酸类、可溶性多糖类及总纤维素)进行分析评价,以期为黄蜀葵植物资源的精细化利用提供数据支撑[6]。
1 材料
Waters ACQUITY UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器;Waters公司,Milford,USA);Xevo TQ 检测器(Waters公司);MassLynxTM质谱工作站软件(Waters公司);Waters-2695型液相色谱仪(包括四元泵、在线脱气及自动进样系统、2996型二极管阵列检测器;Waters公司,Milford,USA);UV-2000紫外-可见分光光度计(北京莱伯泰科仪器有限公司);FIWE 3/6纤维素测定仪(北京盈盛恒泰科技有限公司);Microfuge 22R Centrifuge 离心机(美国Beckman Coulter公司);KQ-500B超声波清洗机(功率150 W,昆山市超声仪器有限公司);Milli-Q Integral 5 超纯水系统(默克密理博公司);马弗炉(上海洪纪仪器设备公司);Sartorius BT125D电子分析天平(德国塞利多斯公司)。
黄酮类化学对照品芦丁、槲皮素购自中国食品药品检定研究院,杨梅素、异槲皮苷、金丝桃苷、槲皮素-3′-O-葡萄糖苷、棉皮素-8-O-葡萄糖醛酸苷购自阿拉丁试剂公司,纯度经HPLC测定均大于98%。
氨基酸类化学对照品亮氨酸、苯丙氨酸、异亮氨酸、色氨酸、γ-氨基丁酸、甲硫氨酸、脯氨酸、缬氨酸、牛磺酸、酪氨酸、半胱氨酸、丙氨酸、反式-4-羟基-脯氨酸、苏氨酸、谷氨酸、赖氨酸、谷氨酰胺、丝氨酸、天冬酰胺、瓜氨酸、精氨酸、组氨酸、鸟氨酸、天冬氨酸均购自中国惠兴生化试剂有限公司,纯度经HPLC测定均大于98%。
核苷及碱基类化学对照品胸腺嘧啶、胸苷、2′-脱氧尿苷、2′-脱氧腺苷、腺嘌呤、次黄嘌呤、2′-脱氧肌苷、胞嘧啶、2′-脱氧腺苷-5′-单磷酸均购自Sigma公司,纯度经HPLC测定均大于98%。
葡萄糖对照品购自Sigma公司,葡萄糖醛酸对照品购自中国食品药品检定研究院。
乙腈、甲醇、甲酸均为色谱纯,购自Merck公司(德国),其他试剂均为分析纯,购自上海国药集团化学试剂有限公司。
黄蜀葵植株于2015年9月(花采收期)采自南京中医药大学药苑,其原植物经南京中医药大学段金廒教授鉴定为黄蜀葵A. manihot。样品采集后,分解成花、根、茎、叶不同部位。以上各样品采集后,40 ℃干燥,粉碎成粗粉,置干燥器中备用。
2 方法与结果
2.1 黄酮类化学成分的分析与评价
2.1.1 供试品溶液制备 取样品粗粉1.0 g,精密称定,置于50 mL具塞锥形瓶中,精密加入70%甲醇20 mL,超声处理1 h,补足失重,离心,取上清液,4 ℃保存,备用。
2.1.2 对照品溶液制备 分别精密称定对照品金丝桃苷1.49 mg、异槲皮苷1.52 mg、棉皮素-8-O-葡萄糖醛酸苷1.53 mg、杨梅素1.51 mg、槲皮素-3′-O-葡萄糖苷1.50 mg、芦丁1.42 mg、槲皮素1.22 mg置于10 mL量瓶中,用70%甲醇溶解并稀释至刻度,配制成混合对照品溶液,于4 ℃保存,备用。
2.1.3 色谱分析条件 色谱柱AlltimaTM C18色谱柱(4.6 mm×250 mm,5 μm)。流动相乙腈(A)- 0.1%甲酸水(B),梯度洗脱0~10 min,16%A;10~40 min,16%~25% A;40~50 min,25%~35% A;50~55 min,35%~60% A;55~56 min,60%~16% A;56~60 min,16%A。体积流量1 mL min-1,检测波长360 nm,柱温35 ℃,进样量10 μL。典型样品色谱图见图1。
2.1.4 标准曲线的制备及线性关系考察 分别精密吸取2.1.2项下制备的混合对照品溶液2, 6, 10, 20, 30 μL,注入液相色谱仪测定;另取混合对照品溶液加70%甲醇稀释10倍后,精密吸取5 μL注入液相色谱仪测定。以对照品进样量为横坐标(X),峰面积的积分值为纵坐标(Y),绘制标准曲线。最低检测限(LOD)与最低定量限(LOQ)分别在信噪比(S/N)为3和10时测定,见表1。由表1可知,所测定7种黄酮类化学成分,其在一定的线性范围内线性关系良好(r>0.999 5),且具有较高的灵敏度。
2.1.5 精密度 取混合对照品溶液,按上述色谱条件重复进样6次,计算其RSD。结果显示,芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素峰面积的RSD依次为1.2%, 1.3%, 1.5%, 2.2%, 2.3%, 1.6%, 0.30%,表明其精密度良好。
2.1.6 重复性 精密称取黄蜀葵花粗粉6份,按照前述方法分别制备供试品溶液,依次进样,分别记录芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素的峰面积积分值,计算其含量及RSD。结果显示上述所测定成分含量的RSD依次为1.8%, 1.1%, 1.5%, 1.6%, 1.7%,表明该方法重复性良好。
2.1.7 稳定性 取重复性试验所制备的供试品溶液1份,12 h内每隔2 h进样1次,记录峰面积,结果显示芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素峰面积的RSD依次为1.8%, 2.1%, 0.9%, 1.2%, 2.0%,结果表明供试品溶液在12 h内稳定。
2.1.8 加样回收率 取黄蜀葵花粗粉6份,每份约0.5 g,精密称定,分别加入与样品中各成分含量等量的对照品,依法制备供试品溶液并进样分析,计算回收率。结果芦丁、金丝桃苷、异槲皮苷、棉皮素-8-O-葡萄糖醛酸苷、杨梅素、槲皮素-3′-O-葡萄糖苷、槲皮素的平均回收率分别为100.4%, 98.8%, 98.7%, 95.6%, 97.4%, 98.9%, 96.4%,RSD为2.3%, 2.0%, 2.5%, 2.3%, 2.4%, 2.0%, 2.8%,表明本方法测定结果准确度较好。
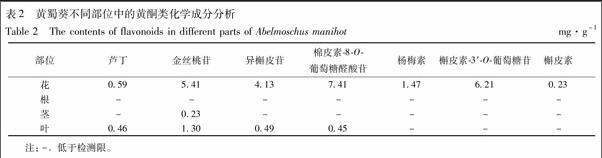
2.1.9 样品测定及结果分析 取黄蜀葵花、根、茎及叶片按2.1.1项下方法制备供试品溶液,依次进样分析,结果见表2。由表可知,各黄酮类化学成分主要集中于花部位,其总量可达25.45 mg g-1,其中尤以棉皮素-8-O-葡萄糖醛酸苷、槲皮素-3′-O-葡萄糖苷、金丝桃苷、和异槲皮苷含量较高。在根中未检测到黄酮类成分,茎中有少量的金丝桃苷分布,在叶片亦有金丝桃苷、异槲皮苷等少量黄酮类化学成分存在,其总量为2.70 mg·g-1。可供进一步开发利用。
2.2 可溶性多糖类化学成分的分析与评价
2.2.1 供试品溶液的制备[7] 取样品粗粉1.0 g,精密称定,置于100 mL具塞锥形瓶中,加入50 mL 80%乙醇,室温静置1 h后超声提取30 min,在75 ℃水浴回流2 h后,趁热抽滤,热乙醇洗涤残渣,烘干,加入20 mL蒸馏水,称重,回流提取2 h,取出放冷,加蒸馏水补足失重,摇匀,15 000 r·min-1离心10 min,取上清液,即得用于中性多糖和酸性多糖的含量测定的供试品溶液。
2.2.2 对照品溶液的制备 精密称取经105 ℃干燥至恒重的无水葡萄糖对照品10.10 mg,置100 mL量瓶中,加蒸馏水定容至刻度,摇匀,即得101.0 mg·L-1的葡萄糖对照品储备液。精密称取经105 ℃干燥至恒重的葡萄糖醛酸对照品10.12 mg,置100 mL量瓶中,加蒸馏水定容至刻度,摇匀,即得101.2 mg·L-1的葡萄糖醛酸对照品储备液。
2.2.3 标准曲线的绘制 参考文献方法[7],精密量取葡萄糖对照品储备液0.2, 0.4, 0.6, 0.8, 1.0 mL, 分别置10 mL干燥具塞试管中,加蒸馏水至1.0 mL,摇匀,精密加入5%苯酚溶液2.0 mL,混匀,再精密加入浓硫酸7.0 mL,充分混匀,置沸水浴中加热20 min,冷却至室温后,于490 nm处测吸光度,以空白溶液为对照。绘制葡萄糖和葡萄糖醛酸标准曲线,以吸光度(Y)为纵坐标,以对照品溶液浓度(X)为横坐标进行线性回归,得用于测定中性多糖的葡萄糖对照品回归方程为Y=2.163 8X+0.099 3,r=0.996 4,线性范围为20.20~101.0 mg·L-1。
精密量取葡萄糖醛酸对照品储备液0.2, 0.4, 0.6, 0.8, 1.0 mL, 分别置 10 mL干燥具塞试管中,加蒸馏水至1.0 mL,摇匀,精密加入12.5 mol·L-1四苯硼钠硫酸溶液5.0 mL,混匀,置沸水浴中加热10 min后,自来水水浴冷却至室温后,混匀,再精密加入0.125%咔唑无水乙醇溶液0.2 mL,充分混匀,置沸水浴中加热15 min, 自来水水浴冷却5 min后,混匀,于512 nm处测吸光度,以空白溶液为对照。分别绘制葡萄糖和葡萄糖醛酸标准曲线,以吸光度(Y)为纵坐标,以对照品溶液浓度(X)为横坐标进行线性回归。得用于测定酸性多糖的葡萄糖醛酸对照品回归方程为Y=6.909 5X+0.127 7,r=0.998 9,线性范围为20.24~101.2 mg·L-1。
2.2.4 精密度、重复性及稳定性试验 取2.2.2项下的对照品溶液2份,每份0.5 mL,分别按2.2.3项下方法显色,依法连续测定6次吸光度,得中性多糖和酸性多糖精密度RSD分别为1.0%和1.2%,表明该方法精密度良好。取黄蜀葵花样品6份,每份1.0 g,按2.2.1项下方法制备供试品溶液,分别按2.2.3项下方法测定,分别得中性多糖和酸性多糖的RSD 1.8%和2.0%。表明该方法重复性良好。另取重复性试验项下1份样品,显色后分别于0, 10, 30, 60, 90, 120 min时测定中性多糖和酸性多糖的吸光度值,结果显示中性多糖及酸性多糖在120 min内吸光度RSD分别为1.4%和1.3%,表明供试品显色后溶液在2 h内稳定。
2.2.5 加样回收率试验 取黄蜀葵花粗粉6份,每份约0.5 g,精密称定,置具塞试管中,分别加入等量的葡萄糖对照品溶液,依法测定,得到中性多糖均回收率为96.50%,RSD为2.5%。另取相同的样品6份,分别加入等量的葡萄糖醛酸对照品溶液,依法测定,得到酸性多糖的平均回收率为102.5%,RSD为2.8%,表明本方法测定结果准确度较好。
2.2.6 样品测定结果及分析 分别取黄蜀葵花、根、茎及叶片,按2.2.1项下方法制备供试品溶液,并按照2.2.3项下方法经显色后分析其可溶性多糖类组分含量,分析结果见表3。由表可知,黄蜀葵各组织器官均富含可溶性多糖类组分。茎中总多糖量最高,达19.76%,总多糖含量由高至低依次为茎>花>叶>根。黄蜀葵不同组织器官中酸性多糖组分含量差异较大,其中茎中酸性多糖量可达13.07%,而根中仅为0.88%。
2.3 总纤维素类化学成分的分析与评价
2.3.1 测定方法[8-9] 参照Weende法,精密称取干燥至恒重的黄蜀葵花、根、茎、叶片粗粉各2.0 g,精密称定,加乙醚脱脂后,干燥,加入煮沸的质量浓度为1.25%硫酸溶液150 mL,并加入数滴正辛醇(消泡剂),煮沸30 min,除去硫酸,用热蒸馏水约30 mL清洗样品3次,再加入已煮沸的质量浓度为1.25%的KOH溶液150 mL,并加入数滴正辛醇,煮沸30 min后,加热蒸馏水约30 mL清洗样品3次,再用丙酮25 mL清洗3次,将清洗残留物及玻璃坩埚一并置于烘箱中130 ℃烘干1 h,在干燥器中冷却至室温并精密称定质量,即为组纤维含灰分质量(W1)。将试样和玻璃坩埚于500 ℃马弗炉中灼烧3 h,在干燥器中冷却至室温并精密称定质量,即为灰分质量(W2)。根据计算公式:粗纤维=(W1-W2)/W × 100%,计算样品中总纤维素类成分含量,其中W1为粗纤维含灰分质量,W2为灰分质量,W为样品质量。
2.3.2 总纤维含量分析 黄蜀葵花、根、茎及叶片中总纤维类分析结果见表3。由表可知,黄蜀葵不同组织器官中除花外均富含纤维类物质,其中根中总纤维量最高,可达29.88%;茎、叶中总纤维量分别为26.61%, 19.88%,可供进一步开发利用。
2.4 核苷及氨基酸类化学成分的分析与评价
2.4.1 供试品溶液制备 取样品粗粉约1.0 g,精密称定,置于50 mL具塞锥形瓶中,精密加入40 mL蒸馏水,称重,静置30 min后,超声提取30 min,再称重,用蒸馏水补足失重,摇匀,3 000 r·min-1条件下离心10 min,取上清液适量,过0.22 μm滤膜,冷藏备用。
2.4.2 对照品溶液制备 精密称取24种氨基酸对照品适量,置于10 mL量瓶中,加蒸馏水定容,制成含天冬氨酸(0.183 g·L-1)、亮氨酸(0.129 g·L-1)、苯丙氨酸(0.177 g·L-1)、异亮氨酸(0.143 g·L-1)、色氨酸(0.130 g·L-1)、γ-氨基丁酸(0.128 g·L-1)、甲硫氨酸(0.117 g·L-1)、脯氨酸(0.177 g·L-1)、缬氨酸(0.127 g·L-1)、牛磺酸(0.224 g·L-1)、酪氨酸(0.111 g·L-1)、半胱氨酸(0.194 g·L-1)、α-丙氨酸(0.142 g·L-1)、反式-4-羟基-脯氨酸(0.306 g·L-1)、苏氨酸(0.192 g·L-1)、谷氨酸(0.184 g·L-1)、赖氨酸(0.136 g·L-1)、谷氨酰胺(0.116 g·L-1)、丝氨酸(0.288 g·L-1)、天冬酰胺(0.187 g·L-1)、瓜氨酸(0.140 g·L-1)、精氨酸(0.136 g·L-1)、组氨酸(0.120 g·L-1)、鸟氨酸(0.145 g·L-1)的混合对照品储备液。
精密称取9种核苷及碱基类对照品适量,置于10 mL量瓶中,加蒸馏水定容,制成含胸腺嘧啶(0.444 g·L-1)、胸苷(0.124 g·L-1)、2′-脱氧尿苷(0.108 g·L-1)、2′-脱氧腺苷(0.145 g·L-1)、腺嘌呤(0.122 g·L-1)、次黄嘌呤(0.104 g·L-1)、2′-脱氧肌苷(0.106 g·L-1)、胞嘧啶(0.144 g·L-1)、2′-脱氧腺苷-5′-单磷酸(0.108 g·L-1)的混合对照品储备液。
2.4.3 色谱分析条件[10-11] 色谱柱ACQUITY UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm);流动相含5 mmol·L-1甲酸铵、5 mmol·L-1乙酸铵和0.2%甲酸的水溶液(A),含1 mmol·L-1甲酸铵、1 mmol·L-1乙酸铵和0.2%甲酸的乙腈溶液(B);梯度洗脱0~3 min,10% A;3~9 min,10%~18% A;9~15 min,18%~20% A;15~16 min,20%~46% A;16~18 min,46%A;18~19 min,46%~10% A;19~20 min,10% A;流速0.4 mL·min-1,柱温35 ℃,进样体积2 μL。典型样品色谱图见图2。
2.4.4 质谱检测条件[10-11] 离子化模式ESI+,毛细管电压3.0 KV,多反应监测(MRM)检测,离子源温度150 ℃,脱溶剂气流量和温度分别为1 000 L·h-1,500 ℃,碰撞气流量为0.15 mL·min-1、锥孔气流量为0.15 mL·min-1,50 L·h-1,所测氨基酸与核苷类物质的碰撞能量和锥孔电压同文献[11]。
2.4.5 标准曲线的制备及线性关系考察 取混合对照品储备液适量,加水稀释成系列浓度的混合对照品溶液,按照2.4.3和2.4.4项条件测定,以峰面积为纵坐标Y,质量浓度(mg·L-1)为横坐标X,得到线性回归方程及相关系数。分别在S/N为3和10时测定得到LOD值和LOQ值。结果见表4。由表可知,其在一定的线性范围内线性关系良好,且具有较高的灵敏度,适用于黄蜀葵不同部位中核苷氨基酸类化合物的含量测定。
2.4.6 精密度 取混合对照品溶液,按照上述色谱、质谱条件分别于重复进样6次测定,得到峰面积,以峰面积的RSD来评价其精密度。结果见表5,所有被测成分峰面积RSD均小于5.0%,表明其精密度良好。
2.4.7 重复性 精密称取黄蜀葵花粗粉6份,按照前述方法分别制备供试品溶液,依次进样,分别记录各待测成分的峰面积积分值,计算其含量,依据其含量的RSD评价其重复性。结果显示上述所测定成分含量的RSD均小于5.0%,表明该方法重复性良好,见表5。
2.4.8 稳定性 取重复性试验所制备的供试品溶液1份,12 h内每隔2 h进样1次,记录峰面积,并计算其RSD。结果显示,上述所测定成分峰面积的RSD均小于4.0%,表明供试品溶液在12 h内稳定,见表5。
2.4.9 加样回收率 取黄蜀葵花粗粉6份,每份约0.5 g,精密称定,分别加入与样品中各成分含量等量的对照品,依法制备供试品溶液并进样分析,计算回收率及RSD,结果见表5。结果显示所有待测化合物其回收率介于94.70%~105.7%,其RSD均小于4.0%,表明本方法测定结果准确度较好。
2.4.10 样品测定结果及分析 取黄蜀葵花、根、茎及叶片分别按2.4.1项下方法制备供试品溶液,依次进样分析,结果见表6。由表6可知,在黄蜀葵花、根、茎及叶片中共检出17种组成蛋白质的游离氨基酸类化学成分,另检测出4种非蛋白质氨基酸γ-氨基丁酸、反式-4-羟基-脯氨酸、瓜氨酸和鸟氨酸。其中游离氨基酸总量以花含量较高,可达4.737 mg·g-1。各氨基酸中以谷氨酰胺含量相对较高,其在花中可达1.010 mg·g-1。
各样品中共测得8种核苷类化学成分,且以叶片中核苷类化学成分总量较高,可达1.474 mg·g-1,其次为花,可达0.738 mg·g-1;根和茎中核苷类化学成分含量相对较低,其总量分别为0.136和0.153 mg·g-1。可作进一步开发。
3 讨论
资源的利用价值在于其可利用物质的多用性和多宜性特点[13]。本研究结果表明,黄蜀葵在其药用部位采收过程中产生的各组织器官黄酮类、可溶性多糖类、纤维类、核苷类和游离氨基酸类化学成分分布及含量差异较大,据此可依据各类资源性化学成分的潜在利用价值进行产业化开发,以提高黄蜀葵植物资源利用效率。研究显示,黄酮类化学成分在其传统药用部位花中种类及含量较高,而在其他部位含量较低或难以检测到,表明该类化学成分在黄蜀葵植物中的分布具有一定的局限性。据文献报道[12],黄蜀葵植物中含有的黄酮类化学成分具有广泛的药理活性,除可用于治疗肾炎及肾纤维化外,尚具有保护心脑缺血损伤、促进血管新生等作用,故以其为主要原料除用于慢性肾炎治疗药物黄葵胶囊的生产外,尚可用于相关心脑血管系统药物的研发。
本研究显示,黄蜀葵花、根、茎和叶片中均富含可溶性多糖类组分,尤其是茎中总多糖量高达19.76%。有研究显示[14-15],黄蜀葵植物多糖类组分多具有凝胶特性及可降解性,因此可以黄蜀葵茎为主要原料提取制备多糖类资源性物质用作食品工业的可食性包装材料及增稠剂、稳定剂等及中药凝胶剂的基质[16]。此外,由于该类多糖组分具有较好的保水性、吸附性及高黏性,也可用于环境治理。研究结果尚显示,黄蜀葵根、茎及叶均富含粗纤维,可以其为主要原料,经生物发酵用于制备纤维素酶、工业乙醇等,或经无氧炭化制备生物炭;也可以其为主要原料,复合黄蜀葵多糖胶用于复合纤维板或木塑板的制备[17]。
源于自然生物资源的氨基酸类及核苷类化学成分为维持生命活动重要的营养保健成分,为重要的资源性化学物质。本研究显示,黄蜀葵花、根、茎及叶均富含游离氨基酸类化学成分。核苷类组分在黄蜀葵叶及花中含量相对较高,也可用于相关产品的开发。
黄蜀葵植物资源在药材生产及产业化加工过程中,产生大量的根、茎、叶等废弃物,目前尚未得到充分利用,一方面造成资源的极大浪费,另一方面也增加了环境承载压力。同科同属植物黄秋葵A. esculentus,其不同部位在医药、食品、畜牧、观赏园艺等方面均得到不同程度的开发利用[18],为黄蜀葵植物非药用部位的资源化利用提供了借鉴。本研究结果为该类生物资源的精细化利用提供了基础数据,对提升黄蜀葵资源利用效率,创新黄蜀葵资源价值,构建基于黄蜀葵药用生物资源的循环利用策略提供支撑。
[参考文献]
[1]段金廒. 中药资源化学:理论基础与资源循环利用[M]. 北京:科学出版社, 2015.
[2]Ai G, Liu Q, Hua W,et al. Hepatoprotective evaluation of the total flavonoids extracted from flowers of Abelmoschus manihot(L) Medic:in vitro and in vivo studies[J]. J Ethnopharmacol, 2013, 146(3):794.
[3]文松,张贵强,汪艳艳,等.黄蜀葵花总黄酮药理活性的研究进展[J].世界中医药,2014,9(8):1105.
[4]Qiu Y, Song J, Wang S. Antioxidant activity of Ablmoschus manihot flower ethanolic extract and its inhibitory effect on the growth of Hela cells [J]. Food Sci, 2011, 19:47.
[5]王雪梅, 施文婷, 吴迷迷,等. 黄蜀葵胶中的糖分析[J]. 食品科学, 2011, 32(6):256.
[6]段金廒. 中药废弃物的资源化利用[M]. 北京:化学工业出版社, 2013.
[7]吕洁丽, 陈红丽, 段金廒, 等. 不同加工方法对当归多糖的影响[J]. 中国中药杂志, 2011, 36(7):846.
[8]张洁梅, 刘冬豪. 细粉类大豆样品粗纤维的检测研究[J]. 现代食品科技, 2005, 21(3):129.
[9]陶小芳, 沈飞, 宿树兰,等. 生脉注射液生产过程五味子药渣中资源性物质的分析与循环利用途径探讨[J]. 中草药, 2015, 46(18):2712.
[10]Ge Y, Tang Y, Guo S, et al. Simultaneous quantitation of free amino acids, nucleosides and nucleobases in Sipunculus nudus by ultra-high performance liquid chromatography with triple quadrupole mass spectrometry [J]. Molecules, 2016, 21(4):408.
[11]Zhang L L, Bai Y L, Shu S L, et al. Simultaneous quantitation of nucleosides, nucleobases, amino acids, and alkaloids in mulberry leaf by ultra high performance liquid chromatography with triple quadrupole tandem mass spectrometry[J]. J Sep Sci, 2014, 37(11):1265.
[12]周雷. 黄蜀葵花总黄酮研究进展[J]. 辽宁中医药大学学报, 2012,6:42.
[13]段金廒, 张伯礼, 宿树兰,等.基于循环经济理论的中药资源循环利用策略与模式探讨[J]. 中草药, 2015, 46(12):1715.
[14]徐中岳, 何小维, 罗志刚,等. 多糖可食性包装膜的研究进展[J]. 食品研究与开发, 2008, 29(7):179.
[15]丁一芳, 李连闯, 赵玺. 多糖的研究进展[J]. 黑龙江医学, 2006, 19(2):123.
[16]段金廒,严辉,李宜华. 从黄蜀葵中提取胶质作为中药凝胶剂基质的应用:中国, CN102526754A [P]. 2012-07-04.
[17]陈佩东,段金廒,严辉. 一种用黄蜀葵秸秆制备塑木材料的方法:中国, CN103525111A[P]. 2014-01-22.
[18]宫慧慧,于倩,王恩军,等. 黄秋葵的应用价值和产业化开发前景[J]. 山东农业科学, 2013, 45(10):131.
[责任编辑 丁广治]

