基于“肠外翻—心肌细胞”联用模型的益气活血方药效学作用评价及机制探讨
耿亚+杨洪军+马月香+张晶晶+张毅+李德凤+张方博+许海玉

[摘要]该研究首先建立过氧化氢(H2O2)诱导大鼠胚胎心肌细胞株(H9c2)氧化损伤模型,并筛选出益气活血方肠吸收液体外心肌保护作用的浓度范围,优选出4个剂量进行实验;通过考察益气活血方肠吸收液对H9c2的保护作用,从而为临床防治与氧化应激损伤相关心脏疾病提供参考;并通过对H9c2心肌细胞活力、细胞形态、超氧化物歧化酶(SOD)、丙二醛(MDA)等指标进行考察,对益气活血方肠吸收液作用机制进行初步评价探讨。结果显示,益气活血方肠吸收液对H2O2诱导H9c2心肌细胞损伤具有较好的保护作用,且呈现出一定的浓度依赖性,可提高SOD的活性,减少MDA的释放,从而降低异常细胞的形成,增强心肌细胞抗氧化能力,提高细胞活力,具有一定的保护作用。
[关键词]益气活血方; 心肌细胞; 氧化应激; MDA; SOD
[Abstract]This research firstly establishes the oxidative damage model of H9c2 induced by H2O2 and screens the concentration range of intestines absorption liquid of Qi benefiting and blood circulation activating formula which possess external myocardium protection function. Then, the thesis chooses 4 dosages to conduct experiments:examining the protection function of intestines absorption liquid of Qi benefiting and blood circulation activating formula on H9c2 to provide reference for clinical prevention and curing of relative heart diseases of oxidative stress injury; as well as examining the H9c2 cardiac muscle cell vigour, cellular morphology, SOD, MDA and other indexes to primarily evaluate and discuss the functional mechanism of intestines absorption liquid of Qi benefiting and blood circulation activating formula. The results show that the intestines absorption liquid of Qi benefiting and blood circulation activating formula has relatively better protection function toward the H9c2 cardiac muscle cell damage induced by H2O2 and presents concentration dependency to some extent. The intestines absorption liquid of Qi benefiting and blood circulation activating formula can increase SOD vigour, and decrease MDA emission, thus decreasing the formation of abnormal cell and strengthening the oxidation resistance of cardiac muscle cell. The intestines absorption liquid of Qi benefiting and blood circulation activating formula has protection function to some extent.
[Key words]supplementing Qi and activating blood circulation; myocardial cells; oxidative stress; MDA; SOD
doi:10.4268/cjcmm20162018
冠心病(coronary heart disease,CHD)是指冠状动脉粥样硬化使管腔狭窄或阻塞,或/和冠状动脉痉挛导致心肌缺血缺氧而引起的心脏病,又称缺血性心脏病(IHD)。中医无“冠心病”病名,根据其临床致病特点,在辩证上应属于中医学所指的“胸痹心痛”等范畴。如《素问·痹论》有言:“心痹者,脉不通,烦则心下鼓,暴上气而喘。”在冠心病中医诊疗研究中,冠心病多为本虚标实之症,因气虚血瘀、心脉痹阻而发病。治疗上多以益气、活血及益气活血之法。张珍玉教授在60余年的临床实践中,总结出益气活血是治疗冠心病的重要法则,所用经验方益气活血方(人参、黄芪、丹参、川芎)为基本方,临床随证加减,该方以益气养心为主,兼以活血通脉,组方精炼,对于冠心病患者疗效显著。本课题选取益气活血方为考察对象,研究其对气虚血瘀型冠心病细胞层面的防治作用,以期为临床防治气虚血瘀型心脏病及后期机制研究提供参考。
研究发现,益气活血方可有效防治心气虚型冠心病,通过提高心肌细胞抗氧化活力,从而减少心肌细胞凋亡数量,进而对大鼠心肌缺血产生保护作用[1];另有研究表明,心肌缺血性冠心病可产生大量氧自由基[2],这也成为诱导心肌细胞凋亡的主要因素[3]。因此选用外源性活性氧H2O2可使心肌细胞产生大量氧自由基,发生氧化应激反应,进而诱导细胞发生凋亡,心肌细胞凋亡模型的建立多选用这种方法[4-5]。本研究选用体外H2O2诱导产生氧化应激反应建立心肌细胞凋亡模型,对益气活血方的作用进行考察,同时选用曲美他嗪作为阳性对照药[6]。通过四甲基偶氮唑盐(MTT)测定细胞存活率,并筛选模型建立的H2O2浓度及药物作用浓度,测定细胞内SOD,MDA含量评价心肌细胞氧化损伤程度,同时观察心肌细胞形态学变化,进而从体外细胞效应角度对益气活血方进行评价。
1 材料
SPF级SD大鼠,雄性,体重(230±10) g,由北京大学医学部实验动物科学部提供,合格证号SCXK(京)2010-0034。大鼠胚胎心肌细胞株H9c2购自中国医学科学院北京协和医学院基础医学研究所细胞库。
氯化钠(NaCl),氯化钾(KCl),碳酸氢钠(NaHCO3),磷酸二氢钠(NaH2PO4),氯化镁(MgCl2),氯化钙(CaCl2),葡萄糖(C6H12O6),二甲基亚砜(DMSO)以上试剂均为分析纯,购自国药集团化学试剂有限公司;DMEM高糖(美国gibco公司);双抗Penicillin-Streptomycin(美国Thermo 公司);胎牛血清(美国Hyclone公司);磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自北京索莱宝科技有限公司;胰酶(美国gibco公司);曲美他嗪(trimetazidine, TMZ)购自美国Sigma;H2O2溶液(美国ACROS,10 mol·L-1);MTT购自美国Sigma;T-SOD,MDA试剂盒购自南京建成。
益气活血方(由人参、黄芪、丹参、川芎组成)由贵州信邦制药有限公司提供。
倒置显微镜(日本OLYMPUS);超级洁净工作台(北京东联哈尔);CO2细胞培养箱(日本三洋);电子分析天平(德国Sartorius);多功能酶标仪(美国SpectraMax M5);台式离心机(上海卢湘仪器);旋转蒸发仪(天津科诺仪器);电子调温电热套(天津市泰斯特仪器);组织-器官水浴系统(上海奥尔科特仪器);循环水真空泵(巩义予华仪器);细胞超声粉碎仪(宁波新芝生物科技有限公司)。
Tyrode 缓冲盐溶液配制:NaCl 8.0 g、NaHCO31.0 g、KCl 0.28 g、NaH2PO40.05 g、MgCl20.1 g溶于500 mL蒸馏水中,4 ℃保存备用; CaCl20.2 g溶于500 mL蒸馏水中,4 ℃保存备用;用时二者混合均匀,加入葡萄糖1.0 g即得[7]。
2 方法
2.1 益气活血方供试液的制备
按人参-黄芪-丹参-川芎3∶2∶2∶1称取益气活血方各饮片,精密称定50 g。以1∶20加入95%乙醇回流提取2 h,自然冷却,抽滤,得滤液。滤液56 ℃旋转蒸发至干,以每4 g 原生药材用25 mL Tyrode缓冲盐溶液,超声混匀后得益气活血方供试液,-20 ℃冰箱保存,使用前置于室温自然解冻。
2.2 益气活血方肠吸收液制备
依据本课题组前期研究制备肠吸收液[8]。充分混匀后于无菌间的超净台上用0.22 μm无菌滤膜滤过除菌,将肠吸收液样品分装于无菌的EP管中,-20 ℃保存待用。
2.3 心肌细胞培养
细胞进行常规培养,DMEM高糖培养基,10%含胎牛血清,0.2%青霉素、链霉素双抗,0.25%胰酶消化传代,置于37 ℃,5% CO2细胞培养箱中培养。选取对数生长期的细胞进行实验。
2.4 H2O2损伤心肌细胞的氧化应激模型制备
消化重悬细胞,并调整细胞浓度至8×103个/L种入96孔板,设为空白对照组(无细胞培养孔),其余每孔培养基200 μL,置于培养箱培养24 h后,弃去原培养液,每孔加PBS 200 μL洗一遍,第1组加入正常培养基,其余各组加入以无血清培养基稀释不同浓度的H2O2(50,100,200,400,500,600,700,800 μmol·L-1)溶液进行造模,放入培养箱培养1 h后,各孔加入10% MTT溶液,继续孵育4 h后,弃去各孔原溶液加DMSO 150 μL,放于摇床上摇动10 min,使用多功能酶标仪测定波长570 nm下吸光度(A),每组6个复孔,取其平均值计算细胞存活率。细胞存活率=(A正常组-A干预组)/(A正常组-A空白组)×100%。
根据浓度实验结果选取600 μmol·L-1H2O2溶液进行在不同时间点(15,30,45,60,75,90,105,120 min)的实验,每组6个复孔,取其平均值计算细胞存活率。
2.5 筛选益气活血方肠吸收液作用H9c2细胞浓度
消化重悬细胞,并调整细胞浓度至8×103个/L种入96孔板,设空白对照组(无细胞培养孔),其余每孔培养基200 μL,置于培养箱培养24 h后,弃去原培养液,第1组加入正常培养基200 μL,药物各组加入以无血清培养基稀释不同浓度的益气活血方肠吸收液(0, 7.8, 15.6, 31.3, 62.5, 125, 250, 500 mg·L-1),阳性对照组加入TMZ(10 μmol),均为200 μL,置于培养箱培养24 h后,弃去原培养液,加入H2O2(600 μmol·L-1 )溶液对药物组及阳性对照组进行造模,置于培养箱作用1 h后,更换培养液,各孔再加入10% MTT溶液,继续孵育4 h后,弃去各孔原溶液加DMSO 150 μL,放于摇床摇动10 min,使用多功能酶标仪测定波长570 nm下A,每组6个复孔,取其平均值计算细胞存活率。
根据益气活血方肠吸收液浓度筛选结果,选取最佳作用浓度(15.6,31.3,62.5,125 μmol·L-1)培养H9c2细胞24 h,不进行H2O2溶液干预,观察该浓度下益气活血方肠吸收液是否对正常培养细胞存在损伤。
2.6 实验分组
根据实验设计方案,分为以下几组,①正常对照组:正常培养的心肌细胞;②模型组(氧化应激组):心肌细胞培养液中添加600 μmol·L-1 H2O2作用1 h;③益气活血方药物组:分别以筛选的益气活血方肠吸收液适宜浓度干预培养心肌细胞24 h后加入600 μmol·L-1 H2O2继续作用1 h;④阳性对照组:以曲美他嗪(TMZ)干预培养心肌细胞24 h后再加入600 μmol·L-1 H2O2作用1 h。
2.7 测定不同给药组中MDA,T-SOD活性
在H9c2细胞给药培养24 h,H2O2溶液作用1 h后,取细胞,消化,离心,置于细胞超声粉碎仪粉碎细胞,吸取细胞粉碎匀浆进行实验,严格按照说明书检测MDA,SOD。每组均设3个复孔。
2.8 统计学方法
所有数据均采用SPSS 17.0统计软件处理,采用单因素方差分析(ANOVA)进行组间比较统计学检验,以P<0.05为差异具有统计学意义。
3 结果
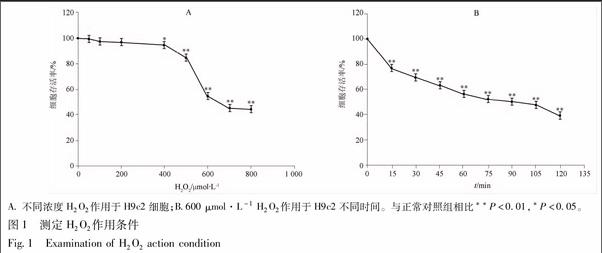
3.1 H2O2作用浓度及作用时间
在不同浓度H2O2(50,100,200,400,500,600,700,800 μmol·L-1)溶液作用H9c2细胞1 h后,随着H2O2浓度的增加,细胞活力逐渐减弱,且在高浓度H2O2(700,800 μmol·L-1)作用于细胞时,心肌细胞存活率与H2O2浓度不成线性关系[9]。在600 μmol·L-1 H2O2溶液作用不同时间(15,30,45,60,75,90,105,120 min)后,发现H9c2细胞在此浓度下存在着时间依赖性,随着作用时间增加,细胞存活逐渐降低。根据浓度、时间实验结果,在600 μmol·L-1H2O2溶液作用1 h的条件下,浓度摸索实验中细胞存活率为54.28%±4.10%(图1A),时间摸索实验中细胞存活率为56.26%±3.68%(图1B),故选取此条件进行以下实验。
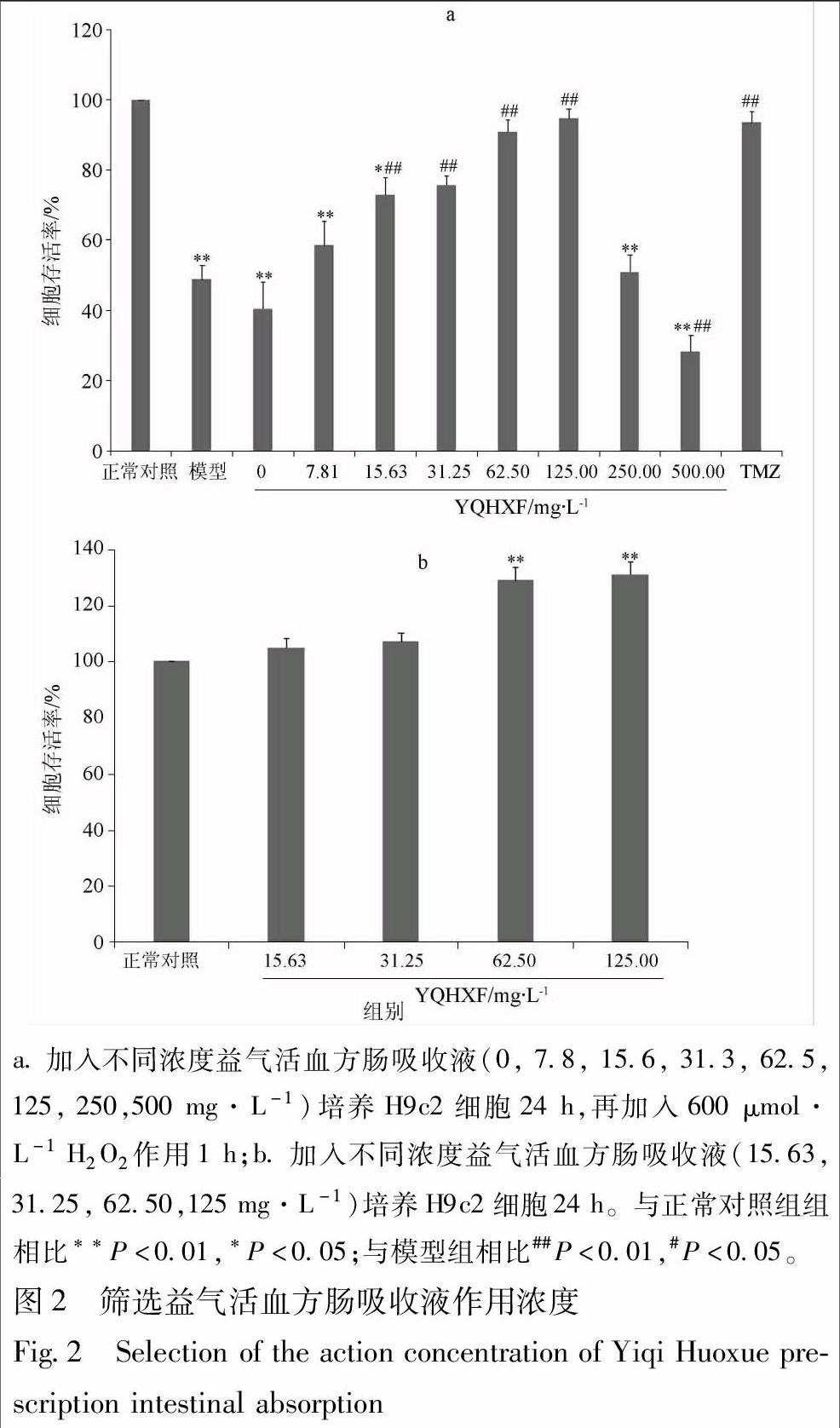
3.2 益气活血方肠吸收液浓度筛选
随着益气活血方肠吸收液质量浓度(0, 7.8, 15.6, 31.3, 62.5,125 mg·L-1)的增加,细胞活力增强,在“量-效”关系上存在一定的剂量依赖性;在低质量浓度(7.8 mg·L-1)时,对细胞存活力作用不明显,说明低浓度的益气活血方肠吸收液对细胞活力没有明显作用;在高质量浓度(250, 500 mg·L-1)时,细胞活力减弱,说明在高浓度的益气活血方肠吸收液存在一定的细胞毒性(图2a)。而在15.63, 31.25, 62.50, 125 mg·L-1孵育正常H9c2时发现无细胞毒性,且具有一定增强细胞活力的作用(图2b)。故选择质量浓度为15.63, 31.25, 62.50, 125 mg·L-1的益气活血方肠吸收液进行后期实验研究。
3.3 益气活血方肠吸收液对H2O2诱导的H9c2细胞的氧化损伤作用
与正常组比较,模型组细胞存活率为49.0%;与模型组比较,药物组细胞存活率明显提高,说明益气活血方对H9c2细胞在H2O2诱导氧化应激中具有一定的保护作用;在益气活血方作用于无H2O2诱导H9c2细胞时,药物处理组细胞存活率高于正常组,显示益气活血方对H9c2细胞也具有一定增殖作用。在益气活血方质量浓度为125 mg·L-1时,细胞抗氧化应激能力最明显,存活率最高(图2)。
3.4 H9c2细胞形态学变化
3.4.1 H2O2诱导的H9c2细胞形态学损伤 将H2O2(50,100,200,400,500,600,700,800 μmol·L-1)溶液加入到心肌细胞中作用1 h后,置于倒置相差显微镜下观察其形态变化。正常H9c2细胞呈长梭形,H2O2诱导后则表现出一种独特的形态变化,与正常心肌细胞相比较,可观察到在H2O2的氧化损伤下,心肌细胞收缩,形状不规则,细胞间差距变大,悬浮细胞增加等现象;在H2O2 600 μmol·L-1组,心肌细胞皱缩明显,在700,800 μmol·L-1组,a.加入不同浓度益气活血方肠吸收液(0, 7.8, 15.6, 31.3, 62.5, 125, 250,500 mg·L-1)培养H9c2细胞24 h,再加入600 μmol·L-1 H2O2作用1 h;b.加入不同浓度益气活血方肠吸收液(15.63, 31.25, 62.50,125 mg·L-1)培养H9c2细胞24 h。与正常对照组组相比**P<0.01,*P<0.05;与模型组相比##P<0.01,#P<0.05。
心肌细胞现大量皱缩现象,悬浮细胞增加。
3.4.2 益气活血方对H9c2细胞形态学影响 H9c2细胞经过益气活血方(15.63, 31.25, 62.50, 125 mg·L-1)和H2O2(600 μmol·L-1)处理1 h后,与H2O2模型组相对比,可观察到随着益气活血方浓度的增加细胞收缩减轻,形状不规则、悬浮细胞等异常细胞的比例逐渐减少(图3)。
3.5 益气活血方对氧化损伤心肌细胞SOD,MDA活性影响
H2O2诱导的氧化应激反应可使心肌细胞产生一系列病理变化,可通过检测细胞内MDA,T-SOD的变化来确定益气活血方是否影响与氧化应激反应相关的氧化酶与抗氧化酶的活性。与正常组比较,模型组细胞中MDA水平显著升高(P<0.01);与模型组相比较,各给药组(31.25,62.50,125 mg·L-1)细胞中MDA水平显著降低(P<0.05)(图4)。与正常组比较,模型组细胞中T-SOD活性显著降低(P<0.01);与模型组相比较,各给药组(15.63,31.25,62.50,125 mg·L-1)细胞中T-SOD活性水平显著升高(P<0.05或P<0.01)(图4)。以上结果表明,药物组随药物浓度增加,T-SOD酶活力增强,而MDA水平降低,通过上调T-SOD,下调MDA 途径来抑制H2O2诱导的氧化应激对心肌细胞的损伤;在药物质量浓度为125 mg·L-1时,细胞内MDA,T-SOD水平与TMZ组较接近,这也说明益气活血方在心肌细胞抗氧化能力方面与TMZ相似。
4 讨论
氧化应激是指由于机体氧自由基过量或清除自由基能力减弱,导致氧自由基的增多,进而对机体造成多种毒性作用的病理状态[10]。因H2O2是一种重要且又易于获得的活性氧,具有相对稳定的性质。现代研究表明,高浓度(>1 mmol·L-1)H2O2易使细胞膜脂质过氧化,造成细胞坏死,而低浓度H2O2可通过诱导凋亡基因表达,诱发细胞凋亡[11],故在实验中需对H2O2浓度进行摸索,确定H2O2诱导细胞凋亡的最佳作用浓度。研究发现,氧化应激损伤在心肌缺血再灌注损伤及心力衰竭等疾病中有着重要作用[12-14]。在心血管疾病从分子细胞水平进行有效药物筛选及发病机制研究中,H9c2心肌细胞体外培养研究模型已成为主要方法之一[15]。
益气活血方为临床经验方,主要治疗气虚血瘀型心脏病,临床疗效确切,方中药物药理作用在现代有较多研究,人参Panax ginseng C. A. Mey. 在中医诊疗中广泛应用,其主要活性物质是人参皂苷,主要包括Rb1,Rb2,Rc,Rg1等,研究发现人参皂苷Rb1可有效抑制H2O2引起的细胞内钙离子的升高[16],降低LDH漏出量,改善细胞活力,抑制线粒体膜电位降低,降低细胞凋亡水平[17];人参皂苷Re在急性心肌缺血再灌注诱导的心肌细胞凋亡中具有一定保护作用[18];人参皂苷Rg1在缺氧-复氧损伤心肌细胞中可有效提高细胞活力[19-20];人参皂苷Rg2在体外低氧损伤心肌细胞中具有抑制细胞凋亡,提高抗氧化酶活力及清除自由基的作用[21]。黄芪中含有多种活性物质,黄芪甲苷是其主要药理活性物质之一,研究发现黄芪甲苷对缺氧-复氧诱导H9c2心肌细胞损伤具有一定保护作用,可有效降低MDA含量,提高SOD含量,进而发挥抗氧化作用[22];黄芪皂苷Ⅳ通过PI3K/Akt信号通路抗H2O2诱导H9c2细胞氧化损伤,显著提高细胞存活率,减轻细胞凋亡[23]。丹参中丹参酮ⅡA可有效抑制H2O2诱导心肌细胞损伤,显著降低心肌细胞乳酸脱氢酶(LDH)活性及MDA含量,并可增加总抗氧化能力(T-AOC)、SOD活力,进而对心肌细胞起到保护作用[24-25]。川芎中川芎内酯A在体外缺氧-复氧诱导乳鼠心肌细胞中,可减少LDH漏出率,降低MDA含量,提高SOD活性,对心肌细胞产生保护作用[26]。
本研究通过培养H9c2心肌细胞,以外源性H2O2诱导建立细胞凋亡模型,首先对H2O2诱导的细胞凋亡模型作用条件及益气活血方作用浓度进行摸索研究,确定作用条件为H2O2浓度600 μmol·L-1,作用时间1 h,确定益气活血方作用质量浓度为15.6,31.3,62.5,125 mg·L-1。因活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臢,而死细胞无此功能[27],而MDA具有细胞毒性作用,可与蛋白质分子内和分子间交联, 诱发细胞凋亡,在金属离子存在下SOD活性下降可引发脂质过氧化物催化裂解产生MDA[28]。故本实验通过检测心肌细胞存活率、细胞形态学变化、细胞内MDA水平及T-SOD活性来评价心肌细胞氧化损伤状态,并以此评定益气活血方对细胞的保护作用。
结果显示,与正常组比较,模型组心肌细胞存活率明显降低(P<0.01),细胞形态明显改变,MDA水平显著增加(P<0.01),而T-SOD活力显著减弱(P<0.01),而在加入各浓度益气活血方预处理后,与模型组相比细胞存活率、T-SOD活力呈浓度依赖性显著升高(P<0.05或P<0.01),细胞形态学方面得到改善,细胞内MDA水平呈浓度依赖性变化减弱(P<0.05或P<0.01),说明益气活血方对氧化应激介导的心肌细胞凋亡具有显著的保护作用,且有一定的增加心肌细胞抗氧化的能力。在作用机制方面,益气活血方可能通过提高细胞SOD活性,进而增强机体自身清除氧自由基的能力,减少MDA的产生,减轻细胞膜脂质过氧化反应,提高H9c2心肌细胞存活率,从而发挥对缺血损伤心肌细胞的保护作用。在相关机制方面,诸多研究表明,ERK1/2及PI3K信号通路在H2O2诱导的细胞氧化损伤过程中发挥重要作用[29-30],而益气活血方是否与此通路相关还有待验证;益气活血方是否通过其他机制对心肌细胞产生保护作用,及其具体作用机制方面还需进一步实验探究。
[参考文献]
[1]孔春明,邱丽芬,张红梅,等.益气活血方对冠心病心气虚大鼠模型心肌细胞凋亡的影响[J].山西中医学院学报,2015,16(4):10.
[2]Kajstura J,Cheng W,Reiss K,et al.Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats[J].Lab Invest,1996,74(1):86.
[3]褚启龙,杨克敌,王爱国,等.氧化应激与细胞凋亡关系的研究进展[J].卫生研究,2003,32(3):276.
[4]Diestel A,Drescher C,Miera O,et al.Hypothermia protects H9c2 cardiomyocytes from H2O2 induced apoptosis[J].Cryobiology,2011,62(1):53.
[5]肖卫民,蒋碧梅,石永忠,等.过氧化氢通过线粒体通路和死亡受体通路诱导心肌细胞凋亡[J].中国动脉硬化杂志,2003,11(3):185.
[6]何杏安,文家旸.心肌细胞保护剂——曲美他嗪[J].中华中医学杂志,2004(2):132.
[7]李晓宇,周尔君,顾圣莹,等.荷叶碱大鼠肠道吸收特性研究[J].中国药学杂志,2011,46(18):1417.
[8]黄斌,李耿,郭宇飞,等.脑心通胶囊中4个成分肠吸收研究[J].中国中药杂志,2013,38(6):889.
[9]李月婷,刘影,王静娴,等.过氧化氢对原代心肌细胞及H9c2细胞的损伤作用[J].贵阳医学院学报,2012,37(3):225.
[10]Hirooka Y,Sagara Y, Kishi T,et al.Oxidative stress and central cardiovascular regulation [J].Circ J,2010, 74(5):827.
[11]冯星,孙磊,郭彩霞,等. 过氧化氢致H9c2大鼠心肌细胞DNA损伤作用[J].中国公共卫生,2009,25(3):296.
[12]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069.
[13]赵洪涛.氧化应激对心肌细胞的影响[J].心血管病学进展,2004,25(1):70.
[14]廖新学,杨春涛,杨战利,等.硫化氢对抗化学性缺氧的心肌细胞损伤及机制[J].中国药理学通报,2009,25(8):1012.
[15]李晓宇,赵焕新,王晓棵,等.H9c2细胞株在心肌缺氧复氧实验中的应用[J].中国心血管病研究,2009,7(5):374.
[16]许浩,葛亚坤,邓同乐,等.人参皂苷Rb1对H2O2诱导新生大鼠心肌细胞凋亡的保护作用[J].中国药理学通报,2005,21(7):803.
[17]文飞,张帆,冷沁.人参皂苷Rb1对过氧化氢诱导的心肌细胞凋亡的保护作用[J].湖北中医杂志,2010,32(7):5.
[18]曾和松,刘正湘.人参皂甙Re对急性缺血再灌注心肌细胞凋亡及fas基因表达的影响[J].华中科技大学学报:医学版,2004,33(3):286.
[19]廖景光,李敏妍,谢兆丰,等.人参皂苷Rg1配伍丹参酮ⅡA对缺氧-复氧H9c2细胞的保护作用及机制研究[J].中国现代医学杂志,2014,24(22):13.
[20]马永洁,朱丹,钟芝茵,等.人参皂苷Rg1和丹参酮ⅡA配伍对缺氧-复氧损伤心肌细胞的保护作用[J].军事医学科学院院刊,2010,34(3):243.
[21]周春丽,王其新.人参皂苷Rg2对体外培养低氧心肌细胞的保护作用[J].青岛大学医学院学报,2008,44(5):411.
[22]王时光,徐雁,陈晓虎.黄芪甲苷对缺氧/复氧损伤H9c2心肌细胞的影响[J].中药药理与临床,2014,30(3):45.
[23]张琦,彭洋,宋君秋,等.黄芪苷Ⅳ通过PI3K/Akt信号通路抗H2O2诱导的H9c2细胞氧化损伤[J].中草药,2010,41(6):955.
[24]刘畅,王庸晋,曹文君.丹参酮ⅡA对大鼠心肌细胞H9c2氧化损伤的保护作用[J].国际心血管病杂志,2015,42(4):261.
[25]杨萍,李杰,周凤华,等.丹参酮ⅡA对过氧化氢损伤心肌细胞的保护作用及机制研究[J].时珍国医国药,2010,21(1):3.
[26]梁日欣,高伟,肖永庆,等.川芎内酯A预处理对体外培养乳鼠心肌细胞缺氧/复氧损伤的保护作用[J].中药药理与临床,2006,22(1):26.
[27]万文婷,李宁,刘静,等.CCK-8法与MTT法检测人前列腺癌PC3细胞活性的比较研究[J].时珍国医国药,2010,21(12):3046.
[28]张敏,朱颖,胡波,等.α-actinin-4与多柔比星肾病大鼠氧化应激状态的关系[J].实用儿科临床杂志,2009,24(5):358.
[29]Jae J J,Yu M H,Yong C J,et al.Rutin from Lonicera japonica inhibits myocardial ischemia reperfusion-induced apoptosis in vivo and protects H9c2 cells against hydrogen peroxide-mediated injury via ERK1/2 and PI3K/Akt signals in vitro[J].Food Chem Toxicol,2009,47(7):1569.
[30]王媛媛,彭洋,张琦,等.ERK1/2信号通路对黄芪苷Ⅳ抗H2O2诱导H9c2细胞氧化损伤的作用[J].中国应用生理学杂志,2011,27(3):363.
[责任编辑 马超一]

