百草枯对人肝HepG2细胞的致突变性
唐超智 张玉玲 王文晟
摘要:采用微核(MN)试验和姊妹染色单体交换(SCE)试验评价了百草枯(Paraquat,PQ)对人肝HepG2细胞的致突变性。结果显示,7.21 mg/L的PQ处理即可导致HepG2细胞的MN率和SCE频率均明显升高,且MN率和SCE频率升高趋势均与PQ处理浓度呈正相关,至34.57 mg/L的PQ处理组,HepG2细胞的MN率和SCE频率分别升高为正常组的5.29和6.07倍,表明PQ对人肝HepG2细胞具有明显的致突变性。
关键词: 百草枯; HepG2细胞; 微核; 姊妹染色单体交换; 致突变性
中图分类号:Q813.5 文献标识码:A 文章编号:0439-8114(2016)04-0896-05
DOI:10.14088/j.cnki.issn0439-8114.2016.04.020
The Mutagenicity of Paraquat on HepG2 Cell
TANG Chao-zhi, ZHANG Yu-ling, WANG Wen-sheng
(College of Life Science,Henan Normal University,Xinxiang 453007,Henan,China)
Abstract: The mutagenecity of paraquat (PQ) on human liver HepG2 cells by micronucleus (MN) and sister chromatid exchange (SCE) assay were evaluated. The experimental results showed that MN ratio and SCE frequency of HepG2 cells increased after the treatment of 7.21 mg/L PQ. And there was a positive correlation between the dose of PQ and the change of MN ratio and SCE frequency. When it came to the treatment group of 34.57 mg/L PQ, MN ratio and SCE frequency of HepG2 cells rised respectively up to 5.29 and 6.07 times of the normal group. The results indicated that PQ had evident mutagenicity on human liver HepG2 cells.
Key words: paraquat; HepG2 cell; micronucleus; sister chromatid exchange; mutagenicity1
百草枯(Paraquat,PQ)是世界上使用量最大的除草剂之一,因其易于被土壤吸附、在环境中残留量低和具有良好的除草效果,PQ一直深受农牧业区人民的欢迎[1]。但PQ自使用以来,已经引起了严重的公共健康问题,由PQ导致的自杀、谋杀、误服以及生产和使用接触的死亡事件屡见不鲜[2-4]。PQ的毒性研究已在肺[5-8]、肾[9,10]和神经组织[11,12]被广泛探讨,但PQ的毒性机制仍未完全阐明,部分学者认为PQ可能首先使细胞发生氧化损伤[5,11,13],进而引起细胞凋亡[13-15],最终导致炎症暴发[8,11,16]、组织坏死。目前人们对PQ中毒仍无良好的治疗策略和高效的解毒剂。近年来,Shukla等[17]发现PQ会引发果蝇基因突变导致的毒性效应,该研究拉开了PQ中毒基因疗法的序幕,为PQ中毒的治疗提供了一个新的突破口,但同时也引起了人们对PQ遗传毒性的关注。之前关于PQ遗传毒性的试验主要集中于啮齿类,至今尚无PQ对人细胞遗传毒性的报道。为此,本研究采用微核(Micronucleus,MN)试验和姊妹染色单体交换(Sister chromatid exchange,SCE)试验评价了PQ对人肝HepG2细胞的致突变性。
1 材料与方法
1.1 材料
所用人肝HepG2细胞株由郑州大学第五附属医院提供,源自中国科学院上海细胞库(目录号为TCHu 72)。分析纯PQ购自上海谱振生物科技有限公司(1910-42-5),带回实验室以去离子水(Deionized water,DW)溶解备用。胎牛血清(Fetal bovine serum,FBS)购自杭州四季青公司(2104)、DMEM(dulbecco′s modified eagle medium)培养液购自美国Hyclone公司(30022.01B)、常规培养细胞以90% DMEM+10% FBS作为完全培养液、0.25%胰酶购自美国Life Technologies公司(1427015)、Giemsas染料购自上海科兴商贸有限公司(S0006)。在实验室准备66 mL甘油,先将Giemsas染料放入研钵中加入少量甘油研磨至无颗粒,然后倒入其余甘油,56 ℃孵育2 h,再加入66 mL甲醇,即成Giemsas染液母液。Giemsas染液母液保存于棕色瓶内,临用时以pH 6.8的PBS稀释10倍即为Giemsas染液工作液。BrdU购自武汉博士德生物工程有限公司(ED1100)。秋水仙素溶液购自北京天恩泽生物技术有限公司(100301-1)。20×SSC缓冲液配方为:以DW溶解3 mol/L NaCl、0.3 mol/L柠檬酸钠后,浓HCl调节pH至7.0。其他常规化学试剂均由河南师范大学生命科学学院实验办公室提供,分析纯以上等级。
1.2 方法
1.2.1 HepG2细胞的培养和传代 人肝HepG2细胞用无菌PBS洗涤3次(3 mL/次, 下同),加入新鲜的DMEM完全培养液6 mL,置于5% CO2、37 ℃培养箱内培养,箱底层存300 mL无菌DW保持箱内湿度。6 h后进行细胞传代,其操作如下。
①从CO2培养箱内取出培养板,PBS洗3次。②2 mL胰酶37 ℃消化5 min,以4 mL PBS终止。③将细胞悬液移入离心管,1 000 r/min离心5 min。④弃上清,加4 mL新鲜的DMEM完全培养液悬浮细胞。⑤将每1 mL细胞悬液移入1个单孔培养板中,各加入5 mL新鲜的DMEM完全培养液。⑥轻轻晃动培养板数次,Leica DMIL LED fluo倒置,显微镜下观察HepG2细胞均匀铺布培养板底面,作好标记后,置于CO2培养箱内培养。
1.2.2 PQ对HepG2细胞MN比率的影响 MN试验操作如下。
①常规胰酶消化、收集经0、7.21、10.67、15.78、23.36和34.57 mg/L的PQ处理24 h的HepG2细胞,加入5 mL 0.075 mol/L KCl溶液,37 ℃水浴10 min低渗处理。②离心弃上清,加入甲醇/冰醋酸(Glacial acetic acid,GAA)(3∶1,下同)混合液5 mL轻轻混匀,25 ℃静置10 min。③离心收集细胞,加入甲醇/GAA混合液0.5 mL轻轻混匀悬浮细胞,吸取细胞悬液涂于载玻片上,铺开、晾干。④滴加Giemsas染液工作液2~3 滴覆盖细胞,静置1 min,补滴pH 6.8的PBS 4~6滴,静置10 min,去离子水轻轻漂洗、吸水纸吸干。⑤Zeiss Axioskop 40数码正置显微镜观察和统计各试验组HepG2细胞的MN率(每个试验组设3个重复,每个重复3张片子,每张片子选取细胞集中区域计数3个视野的MN比率,取平均值),20×物镜下照相(目镜10×)。
1.2.3 PQ对HepG2细胞SCE频率的影响 SCE试验具体操作如下。
①常规培养的HepG2细胞以0、7.21、10.67、15.78、23.36和34.57 mg/L的PQ处理24 h,更换不含PQ、添加BrdU(终浓度为100 μg/mL)的新鲜培养液,避光培养44 h,加秋水仙素(使其含量为0.2 μg/mL),混匀继续培养4 h。②胰酶消化、收集细胞,加入5 mL 0.075 mol/L KCl溶液,37 ℃水浴10 min低渗处理。③加1 mL甲醇/GAA混合液,用微量移液器轻轻吹吸混匀,1 000 r/min离心10 min。④弃上清,加5 mL甲醇/GAA混合液,轻轻吹吸混匀,室温静置15 min,1 000 r/min离心10 min。重复本步骤1次。⑤弃上清,加0.3 mL甲醇/GAA混合液,轻轻吹成细胞悬液。⑥取细胞悬液1滴,高位(40 cm)滴于-20 ℃预冷的冰浴载玻片上,立即置于酒精灯火焰上左右移动载玻片使其上的悬液受热烤干(不宜剧烈烘烤)、贴紧,37 ℃恒温箱内静置48 h。⑦将上步的载玻片置于大号培养皿内,正面朝上,片上覆盖1层擦镜纸,从片外镜头纸边沿加2×SSC缓冲液使全擦镜纸浸湿。将培养皿移入60 ℃水浴锅内,紫外线灯距离5 cm,照射30 min(SSC液易干,应注意补加)。取出样品片,DW漂洗,晾干。⑧同“1.2.2”中④染色。⑨Zeiss Axioskop 40数码正置显微镜下观察和统计各试验组HepG2细胞的SCE率(每个试验组设3个重复,每个重复3张片子,每张片子选取30个阻断在中期的细胞分裂相记录SCE总次数,每个末端交换记作1次SCE,每个中部交换记作2个SCE,最终计算出各组中该30个细胞的平均SCE频率),100倍物镜(油镜)下照相(目镜10×)。
1.3 数据分析
应用SPSS 17.0软件,以t检验比较各PQ处理组与正常组之间数据差异的显著性,Excel 2007作图。
2 结果与分析
2.1 PQ对HepG2细胞MN比率的影响
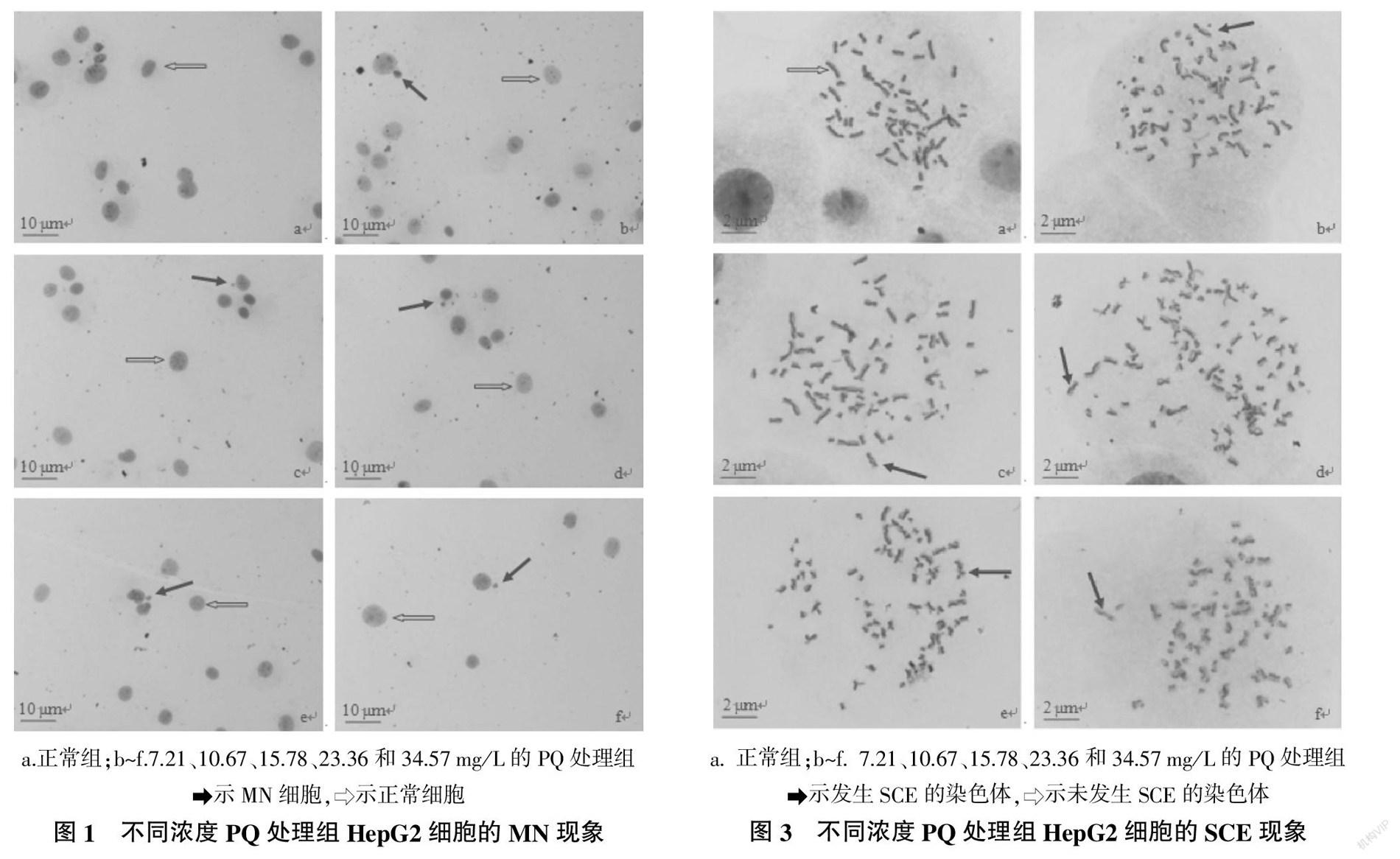
各试验组HepG2细胞的MN现象如图1所示。由图1可以看出,经低渗处理后再进行Giemsas染色,所获得的HepG2细胞的胞膜边界不甚清晰,胞质几乎不着色,但胞核较大、边界清晰、着色十分明显,且核旁边的MN着色非常明显,与胞质底色的差异度较高,该方法提高了MN的辨识准确率和统计速度。
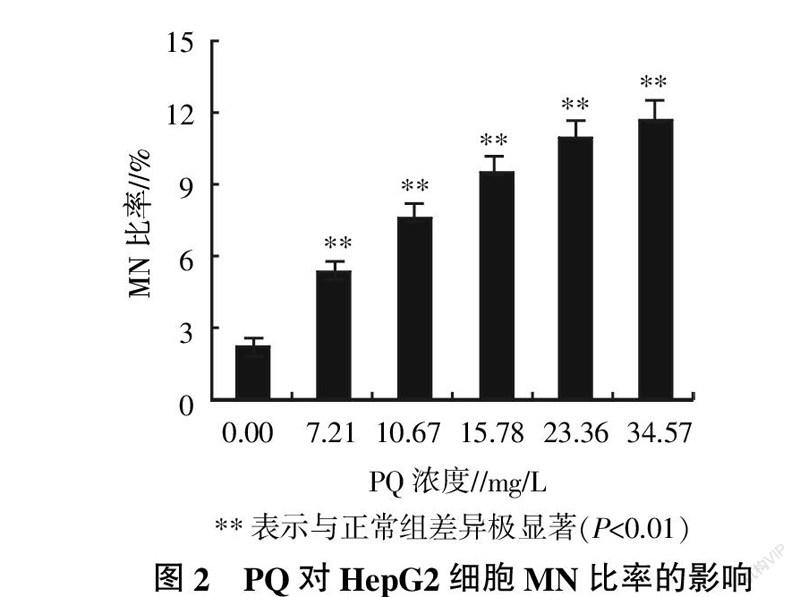
统计各试验组HepG2细胞的MN比率,并分析数据的差异性记录见图2。由图2可知,PQ处理组的MN比率均明显高于正常组,且MN比率升高趋势与PQ处理浓度呈正相关,34.57 mg/L的PQ处理组的MN比率为正常组的5.29倍。
2.2 PQ对HepG2细胞SCE频率的影响
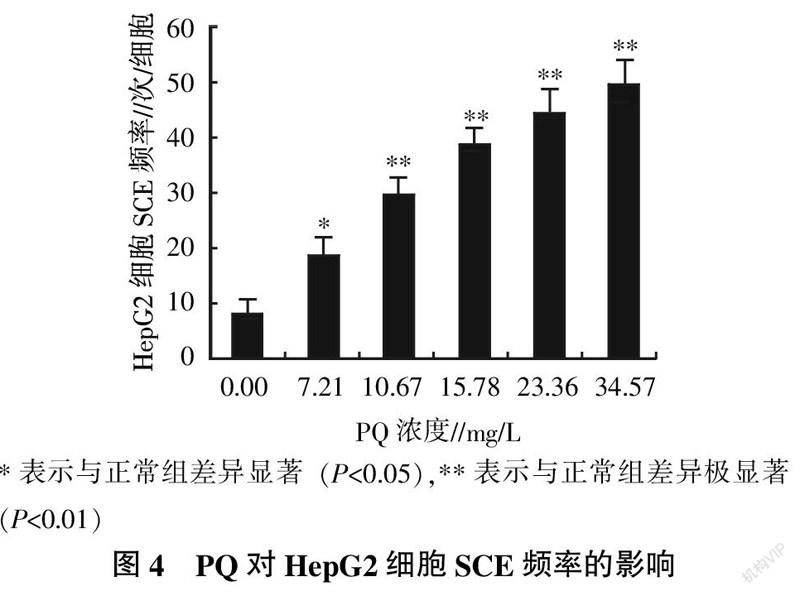
各试验组HepG2细胞的SCE现象如图3所示。由图3可以看出,随着PQ处理浓度增大,HepG2细胞染色体的形态越不规律。统计各试验组HepG2细胞的SCE频率,并分析数据的差异性记录见图4。由图4可知,PQ处理组的SCE频率均明显高于正常组,且SCE频率升高趋势与PQ处理浓度呈正相关,34.57 mg/L的PQ处理组的MN比率为正常组的6.07倍。
3 小结与讨论
众所周知,有毒物质的致突变性研究最常用的是MN试验[18-20],一般MN试验统计的细胞主要是体内的血细胞,关于离体细胞MN试验发展较晚,其操作方法与经典的血细胞染色和统计方法基本一样,对于较小的核需要1 000×放大(油镜)方可勉强识别,统计工作比较费力。本研究在MN试验操作中染色前对细胞进行了低渗处理和固定,结果于200×镜下对较小的核也可以十分清晰地观察到,这就使MN的识别工作简单化,统计准确率和速度得以大大提高,其对显微镜的洁净保持和使用寿命也具有重要意义,因此低渗处理是开展MN试验的一个良好的改进,值得同行借鉴。在应用MN试验调查PQ的致突变性之前,从事G蛋白偶联受体基因Methuselah(mth)研究的加利福尼亚大学的Lin等[21]发表了PQ长期处理引起果蝇mth突变的观点,认为mth的突变是果蝇适应饥饿、高温、PQ等外界氧化损伤压力的一种适应性反应。印度学者Shukla等[17]为了阐明mth在帕金森病(Parkinsons disease, PD)等人类衰老疾病中的作用,深入探讨了果蝇mth突变对PQ导致的PD表征的调节作用。尽管两个研究组均证实了PQ具有基因诱变作用,但其仅检测了mth基因,未针对PQ的致突变作用作普遍性调查。采用MN法评估PQ致突变性的报道僅见于Muangphra等[22]对蚯蚓的个体试验,该研究组检测到4和0.4倍LC50 浓度的PQ处理48 h可分别导致蚯蚓体腔细胞的MN率提高至正常组的5.86和4.14倍。本研究首次选用了人细胞,以MN试验分析PQ的致突变性,测知最高浓度34.57 mg/L(0.67倍的LC50)的PQ处理24 h会导致HepG2细胞的MN率增至正常组的5.29倍,证明PQ对HepG2细胞也有致突变性。
致突变性的另一个检测方法是SCE试验,SCE试验的原理与MN试验不同,它是基于染色体重组层面的研究,相对于MN更为微观[23-25]。此外,SCE的操作更为复杂,需要对试验材料的活体作Brdu预处理,但SCE对突变的分析有其独特的重要意义,SCE试验调查了染色体的片段交换率,直接反映了染色体重组率,而MN的出现是DNA断裂导致遗传信息变化的反映[26-28]。因此,对DNA断裂或重组导致的突变应该分别采用MN和SCE双重检测才能更全面地给予定论[29-31]。Nicotera等[32]应用SCE作为检测指标探讨PQ致突变性,称中国仓鼠成纤维母细胞的SCE与PQ处理浓度呈正相关。2年之后,台湾中央研究院的Wang等[33]以原代的大鼠气管上皮(Rat tracheal epithelial,RTE)细胞和中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞为材料调查了PQ对SCE的影响,结果表明低于LC50的PQ剂量仅导致RTE细胞的SCE上升,未明显导致CHO细胞的SCE上升。此外,Tanaka等[34]以离体培养的中国仓鼠肺(Chinese hamster lung,CHL)细胞为材料探讨了PQ的致突变性,发现PQ处理浓度越大,CHL细胞的SCE频率越高;Tanaka[35]然后尝试以己酮可可碱(Pentoxifyline,POF)来防治PQ引起的SCE频率升高,结果表明POF及其甲基黄嘌呤衍生物预处理CHL细胞均可抑制超氧阴离子产生,进而减少PQ导致的高频SCE,同时发现POF并不能完全抑制白细胞产生超氧阴离子,但可清除氧自由基的活性。Ribas等[36]以离体培养的人白细胞为材料作了一些验证性试验,检测数据证实PQ对白细胞SCE频率有轻微增高作用。Tanaka[37]发现山竹果的提取物山酮素可以有效地降低PQ导致的CHL细胞高频SCE现象。PQ对肺致突变性的这些研究是基于早期大量的PQ肺损伤动物试验之上的,由于PQ的肝毒性研究相对较少、起步较晚,目前仍未见PQ对肝细胞SCE频率的检测。本研究检测PQ对HepG2细胞SCE频率影响的数据显示,7.21 mg/L的PQ处理即对HepG2细胞有明显的SCE频率增高效应,至34.57 mg/L的PQ处理组,HepG2细胞的SCE频率可达正常组的6倍以上,表明PQ对HepG2细胞有明显的致突变性。
综上所述,PQ对人肝HepG2细胞具有较强的致突变性。正如多年以来公共环境健康研究领域的学者和专家所预测的那样,PQ的长期使用和积累可能已为人类生命健康埋下危险的种子[2-4,16],深入探讨PQ对人细胞的毒性机理、积极寻求良好的治疗方法或高效的解毒剂已刻不容缓。
参考文献:
[1] SZIGETI Z,RACZ I,L?魣SZTITY D. Paraquat resistance of weeds—the case of Conyza canadensis(L.) Cronq[J]. Z Naturforsch C,2001,56(5-6):319-328.
[2] ZHOU Q,KAN B T,JIAN X D,et al. Paraquat poisoning by skin absorption: Two case reports and a literature review[J].Exp Ther Med,2013,6(6):1504-1506.
[3] JONES B C,HUANG X M,MAILMAN R B,et al. The perplexing paradox of paraquat: The case for host-based susceptibility and postulated neurodegenerative effects[J]. J Biochem Mol Toxicol,2014,28(5):191-197.
[4] SPANGENBERG T,GRAHN H,SCHALK H VAN DER,et al. Paraquat poisoning: Case report and overview[J].Med Klin Intensivmed Notfmed,2012,107(4):270-274.
[5] TOYGAR M,AYDIN I,AGILLI M,et al. The relation between oxidative stress, inflammation, and neopterin in the paraquat-induced lung toxicity[J]. Hum Exp Toxicol,2015,34(2):198-204.
[6] HARA H,YONEYAMA H,TANABE J,et al. Observations of the fibrosing process in paraquat lung injury by chest X-ray and CT[J].Nihon Kyobu Shikkan Gakkai Zasshi,1991,29(5):638-643.
[7] KADO M. Paraquat lung[J]. Ryoikibetsu Shokogun Shirizu,1994,3:573-576.
[8] XIE H,WANG R,TANG X,et al. Paraquat-induced pulmonary fibrosis starts at an early stage of inflammation in rats[J].Immunotherapy,2012,4(12):1809-1815.
[9] WUNNAPUK K,LIU X,PEAKE P,et al. Renal biomarkers predict nephrotoxicity after paraquat[J]. Toxicol Lett,2013,222(3):280-288.
[10] PAVAN M. Acute kidney injury following paraquat poisoning in India[J].Iran J Kidney Dis,2013,7(1):64-66.
[11] MANGANO E N,LITTELJOHN D,SO R,et al. Interferon-γ plays a role in paraquat-induced neurodegeneration involving oxidative and proinflammatory pathways[J]. Neurobiol Aging,2012,33(7):1411-1426.
[12] RAPPOLD P M,CUI M,CHESSER A S,et al. Paraquat neurotoxicity is mediated by the dopamine transporter and organic cation transporter-3[J]. Proc Natl Acad Sci USA,2011,108(51):20766-20771.
[13] CHANG X,LU W,DOU T,et al. Paraquat inhibits cell viability via enhanced oxidative stress and apoptosis in human neural progenitor cells[J]. Chem Biol Interact,2013,206(2):248-255.
[14] YANG W,TIFFANY-CASTIGLIONI E,KOH H C,et al. Paraquat activates the IRE1/ASK1/JNK cascade associated with apoptosis in human neuroblastoma SH-SY5Y cells[J].Toxicol Lett,2009,191(2-3):203-210.
[15] SEO H J,CHOI S J,LEE J H. Paraquat induces apoptosis through cytochrome C release and ERK activation[J]. Biomol Ther(Seoul),2014,22(6):503-509.
[16] KANG C,KIM S C,LEE S H,et al. Absolute lymphocyte count as a predictor of mortality in emergency department patients with paraquat poisoning[J]. PLos One,2013,8(10):e78160.
[17] SHUKLA A K,PRAGYA P,CHAOUHAN H S,et al. Mutation in Drosophila methuselah resists paraquat induced Parkinson-like phenotypes[J].Neurobiol Aging,2014,35(10):2419e 1-16.
[18] STOCKERT J C,BL?魣ZQUEZ-CASTRO A,CA?譙ETE M,et al. MTT assay for cell viability: Intracellular localization of the formazan product is in lipid droplets[J]. Acta Histochem,2012,114(8):785-796.
[19] KANG S H,KWON J Y,LEE J K,et al. Recent advances in in vivo genotoxicity testing: Prediction of carcinogenic potential using comet and micronucleus assay in animal models[J].J Cancer Prev,2013,18(4):277-288.
[20] ■LEZAK M,SKALNIAK A,GROSZEK B,et al. The effect of acute carbon monoxide poisoning on micronuclei frequency and proliferation in human peripheral blood lymphocytes (case-control study)[J]. Przegl Lek,2014,71(9):463-468.
[21] LIN Y J,SEROUDE L,BENZER S. Extended life-span and stress resistance in the Drosophila mutant methuselah[J].Science,1998,282(5390):943-946.
[22] MUANGPHRA P,KWANKUA W,GOONERATNE R. Genotoxic effects of glyphosate or paraquat on earthworm coelomocytes[J].Environ Toxicol,2014,29(6):612-620.
[23] WOJCIK A,BRUCKMANN E,OBE G. Insights into the mechanisms of sister chromatid exchange formation[J]. Cytogenet Genome Res,2004,104(1-4):304-339.
[24] WILSON D M,THOMPSON L H. Molecular mechanisms of sister-chromatid exchange[J]. Mutat Res,2007,616(1-2):11-23.
[25] WULF H C. Monitoring of genotoxic exposure of humans by the sister chromatid exchange test: Methodology and confounding factors[J].Dan Med Bull,1990,37(2):132-143.
[26] SAMANTA S,DEY P. Micronucleus and its applications[J].Diagn Cytopathol,2012,40(1):84-90.
[27] FENECH M,KIRSCH-VOLDERS M,NATARAJAN A T,et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells[J].Mutagenesis,2011,26(1):125-132.
[28] IARMARCOVAI G,BONASSI S,BOTTA A,et al. Genetic polymorphisms and micronucleus formation: A review of the literature[J].Mutat Res,2008,658(3):215-233.
[29] ?覶ELIK A,EKINCI S Y,G?譈LER G,et al. In vitro genotoxicity of fipronil sister chromatid exchange, cytokinesis block micronucleus test, and comet assay[J]. DNA Cell Biol,2014, 33(3):148-154.
[30] WITCZAK M,KOCISZEWSKA I,WILCZY■SKI J,et al. Evaluation of chromosome aberrations, sister chromatid exchange and micronuclei in cultured cord-blood lymphocytes of newborns of women treated for epilepsy during pregnancy[J].Mutat Res,2010,701(2):111-117.
[31] BHATTACHARYA S K,SARASWATHY R,SIVAKUMAR E. Genotoxic assessment in peripheral blood lymphocytes of post-polio individuals using sister chromatid exchange analysis and micronucleus assay[J]. Hum Exp Toxicol,2011,30(7):636-648.
[32] NICOTERA T M,BLOCK A W,GIBAS Z,et al. Induction of superoxide dismutase, chromosomal aberrations and sister-chromatid exchanges by paraquat in Chinese hamster fibroblasts[J].Mutat Res,1985,151(2): 263-268.
[33] WANG T C,LEE T C,LIN M F,et al. Induction of sister-chromatid exchanges by pesticides in primary rat tracheal epithelial cells and Chinese hamster ovary cells[J]. Mutat Res,1987,188(4):311-321.
[34] TANAKA R,AMANO Y. Genotoxic effects of paraquat and diquat evaluated by sister-chromatid exchange, chromosomal aberration and cell-cycle rate[J].Toxicol In Vitro,1989,3(1):53-57.
[35] TANAKA R. Effects of pentoxifylline on active oxygen-induced sister-chromatid exchange[J]. J Toxicol Sci, 1995,20(4):401-406.
[36] RIBAS G,SURRALL?魪S J,CARBONELL E,et al. Genotoxic evaluation of the herbicide paraquat in cultured human lymphocytes[J].Teratog Carcinog Mutagen,1998,17(6):339-347.
[37] TANAKA R. Inhibitory effects of xanthone on paraquat- and NaNO(2)-induced genotoxicity in cultured cells[J]. J Toxicol Sci,2007,32(5):571-574.

