小麦愈伤组织的诱导和再生体系的建立
陆玉建+王书平+王宁宁+刘俊华+高春明

摘要:以普通小麦的成熟胚为试验材料,研究不同激素组合对小麦愈伤组织诱导和植株再生的影响。结果表明,小麦愈伤组织诱导效果最好的培养基为W5[MS+0.5 g/L 水解络蛋白(CH)+2.0 mg/L 2,4-D+0.15 g/L天冬酰胺(Asn)],在此培养基中,成熟胚产生的愈伤组织质量最好,诱导率最高。对于不定芽诱导,最适培养基为WF8(MS+0.5 g/L CH+4.0 mg/L KT+0.3 mg/L NAA+1.0 mg/L 6-BA),在此培养基中,愈伤组织分化产生的不定芽数量最多,速度最快,分化率最高。比较适宜诱导生根的培养基为WR4(1/2MS+0.5 g/L CH+0.5 mg/L NAA),在此培养基中,不定芽生根速度最快,数量最多,并且较为粗壮。本试验旨在探索小麦组织培养的最适条件,为今后通过基因工程手段改良小麦的品质奠定基础。
关键词:小麦;成熟胚;愈伤组织;不定芽;再生体系
中图分类号: S512.104.3 文献标志码: A
文章编号:1002-1302(2016)09-0067-04
小麦为禾本科小麦属植物,是世界上最早栽培的重要农作物之一[1]。小麦品质的改良是提高小麦产量的主要措施,而稳定的组织培养体系的建立则是小麦育种的重要基础和保证[2]。目前,有关小麦愈伤组织的诱导、分化和再生已有不少的报道,但小麦植株再生率低,建立稳定的再生体系比较困难[2-6]。影响小麦再生的因素有很多,包括外植体来源、基因型、生理状态和培养条件等[3,5-8]。建立高效的植株再生体系需要良好的外植体来源。小麦幼胚是公认的最好的外植体源,其愈伤组织诱导效果好,植株再生能力强,且以幼胚为转化受体,已成功获得转基因植株[2,6,9]。虽然小麦幼胚再生能力强,但取材受时间和空间限制,适宜转化的生理状态难以掌握,转化周期也比较长;而成熟胚取材方便、生理状态一致、不受生长季节限制,是组织培养和遗传转化理想的外植体[7,10-12]。
现阶段,虽然有关小麦成熟胚离体培养方面的研究较多,但稳定的高频率植株再生体系仍未建立,因此本试验以黄河流域广泛种植的普通小麦豫宝1号成熟胚为外植体,研究不同激素组合对小麦愈伤组织诱导和不定芽分化的影响,进而获得比较适合成熟胚高效再生的培养基类型。通过探索小麦组织培养的最适条件,为今后小麦遗传转化体系的建立和品质的改良奠定基础。
1 材料与方法
1.1 植物材料
供试材料为普通小麦种子(豫保1号),由滨州学院生命科学系基因工程实验室提供。
1.2 方法
1.2.1 MS基本培养基的制备 在小麦组织培养过程中,采用MS或1/2MS作为基本培养基,培养基中均添加3%蔗糖、0.8%琼脂,pH值为5.8。
1.2.2 愈伤组织诱导培养基的配制 以MS为基本培养基,添加一定浓度的水解酪蛋白(CH)、2,4-D、NAA、天冬酰胺(Asn)或谷氨酰胺(Gln),配制小麦愈伤组织诱导培养基(表1)。
1.2.3 分化培养基的配制 在基本培养基的基础上,配制诱导小麦分化的培养基(表2)。
1.2.4 生根培养基的配制 以1/2MS为基本培养基,配制诱导小麦生根培养基(表3)。
1.2.5 小麦种子的消毒及成熟胚的剥离 挑取籽粒饱满的小麦种子,用水浸泡,26 ℃处理24 h左右,70%乙醇消毒5 min,HgCl2处理15 min,无菌水冲洗5~6次,剥胚,然后接种到愈伤组织诱导培养基中,26 ℃暗培养15 d。
1.2.6 愈伤组织的增殖培养 选取生长良好的愈伤组织,除胚,将愈伤组织接种到增殖培养基中,26 ℃暗培养2周;选择生长效果较好的愈伤组织继续进行增殖培养,培养基的类型和培养条件不变。
1.2.7 不定芽的诱导 选取增殖效果比较好的愈伤组织,接种到不定芽诱导培养基中,放入光照培养箱中培养30 d左右。
1.2.8 生根诱导 当不定芽的长度5~6 cm时,切取生长较为健壮的不定芽,接种到生根培养基中,诱导不定芽生根。
1.3 结果观测与统计
成熟胚接种到愈伤组织诱导培养基中,15 d后进行第1次继代培养,统计愈伤组织诱导率;愈伤组织经过2次继代培养,然后进行不定芽诱导,分别于接种后15、30 d统计不定芽分化率;不定芽接种到生根培养基中30 d后统计生根率。有关计算公式如下:出愈率=产生愈伤组织的外植体数/接种的外植体数×100%;
分化率=产生不定芽的外植体数/接种的外植体数×100%;
生根率=产生不定根的外植体数/接种的外植体数×100%。
1.4 数据处理
数据采用Excel、SPSS 17.0软件进行方差分析及Duncans多重比较分析。
2 结果与分析
2.1 愈伤组织的诱导
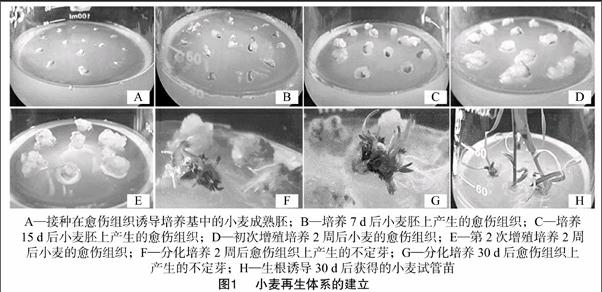
根据前期预试验的结果,选取12种培养基进行小麦愈伤组织的诱导。采用微损法将消毒后的小麦剥胚,接种到愈伤组织诱导培养基中(图1-A),26 ℃暗培养约1周,可以观察到胚上已有明显的白色透明的愈伤组织产生(图1-B);继续培养15 d,愈伤组织体积明显增大,形成蓬松的球形(图1-C),统计愈伤组织诱导率并进行继代增殖。图2表明,在W1~W12这12种愈伤组织诱导培养基中,W5的诱导效果最好,愈伤组织诱导率超过90%,差异极显著(P<0.01)。通过分析愈伤组织的诱导情况,初步获得比较适合愈伤组织诱导的培养基类型。
2.2 愈伤组织的继代增殖
挑取生长良好的小麦愈伤组织,接种到增殖培养基(W5)中,26 ℃暗培养2周后观察愈伤组织的生长情况(图1-D),由此可以看到愈伤组织细胞分裂旺盛,体积明显增大,但结构还不够致密;将愈伤组织再次继代培养2周,愈伤组织的团块继续增大,细胞排列更加紧密,适合不定芽的诱导培养(图1-E)。
2.3 不定芽的形成
将继代培养后的小麦愈伤组织接种到分化培养基中进行不定芽诱导,于26 ℃下光照培养。愈伤组织接种2 d后,可以观察到部分愈伤组织的颜色开始变绿,出现少量的深绿色芽点;分化培养2周左右即可清楚地看到愈伤组织块上长出成簇的不定芽(图1-F)。继续培养30 d左右,产生不定芽的愈伤组织增多,不定芽生长旺盛(图1-G)。对统计数据分析后发现(图3),在愈伤组织分化诱导后15 d,不定芽分化率较低,最高在15%左右;当分化诱导30 d时,不定芽分化率迅速提高,最高达到60%。显著性分析表明,在WF1~WF8这8种不定芽诱导培养基中,WF5~WF8的诱导效果较好,和WF1~WF4之间存在极显著差异。在WF5~WF8这4种培养基中,WF8诱导愈伤组织分化的效果则最好。此外,通过观察愈伤组织的分化情况,发现愈伤组织在WF1~WF4这4种培养基中主要分化产生大量的不定根,而不定芽则极少。通过分析愈伤组织不定芽的诱导情况,初步获得比较适合愈伤组织分化的培养基类型。
2.4 生根诱导
切取生长健壮的不定芽,接种到生根诱导培养基WR1~WR6中进行生根诱导,诱导培养30 d后,即可获得试管苗(图1-H)。在这6种生根培养基中,不定芽均可诱导产生根,且在WR4中不定芽产生根的效果最好,生根率超过50%(图4)。显著性分析表明,WR4和其他5种生根培养基之间存在极显著差异。
3 结论与讨论
小麦在长期种植的过程中,由于受到诸多因素的影响,其产量及品质不断下降,利用基因工程技术是提高小麦产量和改良小麦品质的有效途径。虽然目前有关小麦遗传转化的研究较多,但效果不佳,其中限制因素之一就是小麦植株的再生频率低,建立稳定的再生体系比较困难。因此,如何建立起高效的小麦再生体系是提高小麦产量和品质面临的重要问题。本试验以小麦成熟胚为外植体,通过研究不同激素组合对小麦愈伤组织诱导、分化以及植株再生的影响,以此探索小麦组织培养的最适条件。与幼胚相比,成熟胚的取材方便容易,不受季节限制,因此逐渐成为小麦组织培养的首选材料。在小麦无性系建立的过程中,乙醇和HgCl2处理种子的时间要适度,70%乙醇消毒5 min,HgCl2处理15 min效果较好。时间太短,消毒不彻底,污染率较高;时间过长,影响胚的活性,愈伤组织的能力下降。成熟胚的剥离是一个重要环节,剥胚前,须事先将种子浸泡,再于26 ℃下处理24 h左右,为的是使种子膨胀疏松,从而利于剥胚,其中浸泡的时间不宜过长,否则造成种子腐烂,胚易破碎且活力下降,愈伤组织诱导率下降;浸泡的时间也不宜过短,否则种子比较坚硬,胚难剥离。CH营养丰富,是多种氨基酸混合物,对胚状体、不定芽的分化具有良好的促进作用。在小麦成熟胚培养过程中,培养基中添加0.5 g/L CH有利于愈伤组织诱导和不定芽分化。生长素的主要作用为诱导愈伤组织的形成和根的分化,促进根、茎、芽的生长。2,4-D可以促进细胞脱分化,产生愈伤组织,因此是愈伤组织诱导过程中比较常用的生长素类似物。通过比较小麦愈伤组织的诱导情况可以看出,2.0 mg/L 2,4-D对于小麦成熟胚愈伤组织的形成非常重要,而NAA的效果似乎并不明显。Asn或Gln是培养基中重要的有机氮源,在培养基中添加一定浓度的Asn或Gln有助于小麦愈伤组织的诱导。Asn和Gln相比,0.15 g/L Asn对小麦愈伤组织诱导的促进作用更明显。因此,在小麦成熟胚诱导过程中,可在添加2,4-D和CH的基础上,在培养基中附加一定含量的Asn或Gln,从而能够获得质量较高的愈伤组织,这对于随后进行的愈伤组织分化培养很有必要。如果直接将小麦的愈伤组织进行分化诱导,往往不能产生不定芽,可能是因为初期产生的愈伤组织结构疏松,主要为非胚性愈伤组织,但通过2次继代培养,可以使愈伤组织的结构变得更为致密,胚性愈伤组织的比例大大提高,从而有利于不定芽的诱导。在小麦愈伤组织的分化诱导过程中,WF8的效果最好,愈伤组织的分化率最高,不定芽产生的速度快、数量多,但不定根的产生则不明显。在前4种分化培养基中,愈伤组织产生不定芽的速度要慢得多,数量极少,并且有大量的不定根形成。对照各培养基的成分发现,在KT浓度为1.0~4.0 mg/L时,其含量的变化对不定芽的诱导率影响不大,但在培养基中加入NAA和6-BA后,不定芽的诱导率明显提高,说明NAA和6-BA对不定芽诱导影响较大,是愈伤组织分化过程中起关键作用的激素。而培养基中包含NAA和6-BA的前提下,KT浓度达到4.0 mg/L 时,不定芽的分化率显著提高,可见只有在合适种类和浓度激素的协同作用下,小麦愈伤组织的分化方可达到比较理想的效果。对于小麦生根诱导,应用1/2MS作为基本培养基,附加一定浓度NAA和IBA均可促进根的生成,但NAA的效果要优于IBA,其中比较适宜的NAA浓度为0.5 mg/L,在此浓度下,不定芽生根速度快,数量多,根系较为发达。
在小麦组织培养过程中,不同种类和含量的激素组合在愈伤组织诱导和再生植株的获得方面具有不同的效果。本研究通过探索小麦组织培养的最适条件,并初步建立起较为稳定的小麦再生体系,本试验结果对于今后小麦遗传转化体系的建立和品质的改良具有重要的理论和现实意义。
参考文献:
[1]Chin J C,Scott K J. Studies on the formation of roots and shoots in wheat callus cultures[J]. Ann Bot,1997,41:473-481.
[2]覃建兵,何光源.不同小麦基因型及其不同外植体离体培养研究初探[J]. 华中农业大学学报,2001,20(6):522-527.
[3]李 娜,焦 浈,谷运红,等. 小麦组织培养研究进展[J]. 河南农业科学,2005(8):11-15.
[4]Delporte F,Mostade O,Jacquemin J M. Plant regeneration through callus initiation from thin mature embryo fragments of wheat[J]. Plant Cell Tiss Org Cult,2001,67:73-80.
[5]李根英,黄承彦,隋新霞,等. 小麦不同外植体的组织培养效果研究[J]. 麦类作物学报,2006,26(1):21-25.
[6]何勇刚,林 刚,刘曼西,等. 小麦不同生理状态的幼穗和幼胚盾片与诱导分化能力关系的研究[J]. 武汉植物学研究,2001,19(5):363-368.
[7]李新玲,曲 敏,闫玉清,等. 影响小麦成熟胚培养及植株再生因素的研究[J]. 植物研究,2005,1 (1):49-52.
[8]Machii H,Mizuno H,Hirabayashi T,et al. Screening wheat geno-types for high callus induction and regeneration capability from anther and immature embryo cultures[J]. Plant Cell Tiss Org Cult,1998,53:67-74.
[9]He G Y,Rooke L,Cannell M,et al. Current status of transformation in bread and durum wheats and modifications of gluten quality[J]. Acta Agronomica Hungarica,1998,46(4):449-462.
[10]毕瑞明,王洪刚. 小麦成熟胚的组织培养[J]. 中国农学通报,2007,23(2):53-57.
[11]陶丽莉,殷桂香,叶兴国. 小麦成熟胚组织培养及遗传转化研究进展[J]. 麦类作物学报,2008,28(4):713-718.
[12]Patnaik D,Khurana P. Genetic transformation of Indian bread (T. aestivum) and pasta (T. durum) wheat by particle bombardment of mature embryo-derived calli [J]. BMC Plant Biology,2003,3(5):1-11.

