桃花中黄酮含量的测定及超声波辅助下提取工艺优化

摘要:为建立测定桃花中黄酮含量的紫外分光光度法和探索超声波辅助下黄酮最佳提取工艺条件,以槲皮素为标准品,用紫外可见分光光度计UV-2450进行黄酮含量测定,测定波长为372 nm;通过单因素试验和正交试验,优化超声波下提取桃花中黄酮的最佳工艺。结果表明,槲皮素的回归曲线方程为D=11.625C+0.028,在0.004~0.048 mg/mL 线性关系良好,相关系数为r=0.999 7,桃花中黄酮含量为5.24%;最佳工艺条件:超声功率为80 W,料液比为1 g ∶20 mL,乙醇体积分数为60%;超声波时间为75 min。由结果可知:以槲皮素为对照品,用紫外可见分光光度计测定桃花中黄酮含量操作简便,准确性好;用超声波辅助法提取桃花中黄酮工艺简单,提取率高。
关键词:桃花;紫外分光光度法;黄酮;含量测定;提取工艺
中图分类号: R284.2 文献标志码: A
文章编号:1002-1302(2016)09-0329-03
桃花是蔷薇科落叶乔木——桃树的花,无论是中医经典著作,还是在民间的实践经验方面,都认为桃花具有较好的药用和食疗价值,如最早的药学专著《神农本草经》里就提到桃花具有“令人好颜色”之功效;李时珍在《本草纲目》中记载:“桃花,性走泄下降,利大肠甚快,用以制气室入病水饮肿满,积滞、大小便闭塞者,则有功无害,若久服即耗人阴血,损元气”“桃花,性平无毒,活血利水;可轻身,令人好颜”;现代医学研究表明:桃花具有广泛的药理活性,能疏通经络,扩张末稍毛细血管、改善血液循环,促进皮肤营养和氧供给,滋润皮肤、防止色素在皮肤内慢性沉积,有效地清除体表中的黄褐斑、雀斑、黑斑等功效[1-2]。研究表明,桃花中含有山奈酚、多糖、黄酮等成分[3]。黄酮类化合物具有抗肿瘤、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抗辐射等多种药理作用[4-8]。本试验通过对桃花中黄酮含量测定方法和提取工艺进行探索,为进一步研究桃花的药理和开发桃花的药用价值提供参考。
1 材料与方法
1.1 材料与试剂
桃花(采于宁夏固原市原州区宁夏师范学院校园),将所采桃花样品用蒸馏水洗净,沥干,放入恒温箱中,在60 ℃烘干至恒质量,自然阴干、粉碎,作为供试样品。槲皮素标准(上海源叶生物科技有限公司提供,批号:20121113,质量分数98%)、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠,均为分析纯。
1.2 主要试验仪器
SK300LHC超声波清洗器(上海科导超声仪器有限公司);UV-2450型紫外可见分光光度计(日本岛津);FA2204B电子天平(上海精科天美科学仪器有限公司)。
1.3 方法
1.3.1 槲皮素标准曲线的建立
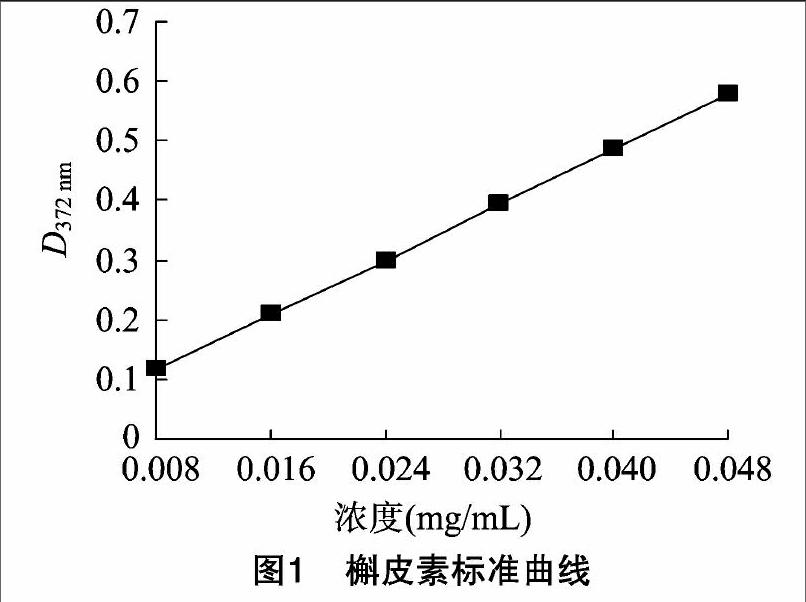
用电子天平准确称取120℃干燥至恒质量的槲皮素对照品5.0 mg,置于25 mL容量瓶中,加体积分数为60%的乙醇至刻度,摇匀,转移至棕色试剂瓶中,即得槲皮素储备液(0.2 mg/mL)。分别吸取槲皮素储备液0、1、2、3、4、5、6 mL移入25 mL容量瓶中,加体积分数为90%乙醇补至6 mL;分别加1 mL 5%亚硝酸钠混匀,放置6 min,加1 mL 10% 硝酸铝溶液摇匀,放置6 min,加10 mL 4%氢氧化钠溶液,再加体积分数为60%乙醇至刻度,摇匀,放置15 min。以试剂作空白参比液,在250~600 nm波长范围内进行光谱扫描,发现最大吸收波长为372 nm,在372 nm下测吸光度,以槲皮素浓度(C)为横坐标、吸光度(D)为纵坐标建立标准曲线(图1),得回归方程:D=11.625C+0.028,r=0.999 7,表明在0.008~0.048 mg/mL浓度内与吸光度具有良好的线性关系。
1.3.2 桃花中黄酮的提取
准确称取适量预处理过的桃花样品,按一定的乙醇体积分数、料液比浸润30 min,在一定的功率下,超声波处理数分钟,浸提过滤,将滤渣在同样条件下再浸提1次,合并2次所得滤液,将滤液转移到100 mL容量瓶中,用90%乙醇定容至刻度,作为供试液待测。
1.3.3 桃花中黄酮含量的测定
准确移取1 mL提取黄酮样品液置于25 mL容量瓶中,参照槲皮素对照品标准曲线溶液的方法配制样品溶液,并定容至25 mL,在372 nm下测样品的吸光度,相关公式:
黄酮的提取量(g/mL)=稀释倍数×10-3×黄酮浓度(mg/mL)×100 mL;
黄酮含量=黄酮的提取量×100 mL/桃花样品质量×100%。
1.3.4 精密度试验
准确称取1.00 g预处理的桃花样品,加入体积分数为60%的乙醇20 mL浸润30 min,在功率80 W下,超声处理60 min,精确吸取提取液1 mL,置于25 mL容量瓶中,参照槲皮素对照品标准曲线溶液的方法配制样品溶液,并定容至25 mL,以试剂作空白参比液,在372 nm下测其吸光度。连续测定6次,RSD=0.61%,表明该试验方法精密度较好。
1.3.5 稳定性试验
取“1.3.4”节所得黄酮提取液1 mL,以试剂作空白参比液,每隔30 min,在372 nm处测其吸光度,连续测定6次,RSD=0.46%,表明提取液在3 h内较稳定。
1.3.6 重复性试验
准确称取预处理的桃花样品1 g,按“1.3.4”节方法平行制备3份黄酮提取液,并按“1.3.5”节方法试验,RSD=0.28%,说明该方法重复性较好。
1.3.7 加样回收率试验
取6份已知黄酮含量(5.24%)的桃花样品0.2 g,分别精密加入低、中、高浓度的槲皮素对照品,用体积分数60%的乙醇,料液比1 g ∶20 mL浸润30 min,固定超声功率80 W,超声时间60 min,制备供试样品溶液。准确取供试溶液1 mL,置于5 mL容量瓶中,并按照槲皮素对照品标准曲线溶液的方法显色,在372 nm处测定吸光度,平均回收率为101.62%,RSD=1.63%。
1.3.8 桃花中黄酮提取工艺优化
利用单因素试验法分别考察溶剂体积分数、料液比、超声波功率和超声波时间4个因素对黄酮提取率的影响。同时为了综合考察多因素对提取过程中提取率的影响,采用4因素3水平正交试验对提取过程中溶剂体积分数(A)、料液比(B)、超声时间(C)和超声功率(D)进行研究。
2 结果与分析
2.1 单因素对桃花中黄酮提取率的影响
2.1.1 溶剂体积分数对黄酮提取率的影响 准确称取预处理过的桃花样品1.00 g,各4份,分别用体积分数为20%、40%、60%、80%乙醇,料液比为1 g ∶10 mL浸润30 min,然后在超声波功率80 W、超声波时间60 min条件下进行试验。黄酮的提取率分别为4.13%、4.24%、4.56%、4.29%。结果表明,试验开始随着乙醇体积分数的增大,桃花中黄酮的提取率也随之增大。原因可能是随着乙醇体积分数增加,黄酮类化合物的溶解度随之增大,当乙醇体积分数为60%时达到最大值;随后,随乙醇体积分数的升高,提取率开始逐渐降低,可能是较大体积分数的乙醇会使细胞内蛋白质凝固,黄酮类化合物难以溶出,综合结果,提取率又开始降低。综合结果,确定提取桃花中黄酮最佳的乙醇体积分数为60%。
2.1.2 料液比对黄酮提取率的影响 准确称取预处理过的桃花样品1.00 g,各4份,固定乙醇的体积分数为60%,按料液比为1 g ∶10 mL、1 g ∶15 mL、1 g ∶20 mL、1 g ∶25 mL浸润30 min,然后在超声波功率80 W、超声波时间为60 min条件下进行试验,黄酮的提取率依次为3.35%、3.52%、4.38%、4.02%。试验表明,桃花中黄酮的提取率开始随着料液比的增大而提高,但当料液比大于1 g ∶20 mL时,黄酮的提取率开始下降。这可能是因为料液比越大,溶剂与原料接触越充分,两者的传质作用增强,黄酮的提取率升高。但当料液比大于1 g ∶20 mL时,随着料液比的增大,提取物中杂质会增加,而这些杂质会吸附部分黄酮,造成黄酮损失,提取率下降。因此确定1 g ∶20 mL是桃花中黄酮提取最佳的料液比。
2.1.3 超声波时间对黄酮提取率的影响 准确称取桃花样品1.00 g,各4份,固定乙醇的体积分数为60%、料液比为1 g ∶20 mL 浸润30 min,超声波功率80 W,依次在超声波时间为30、45、60、75 min下进行试验,黄酮的提取率依次为4.29%、4.43%、4.62%、4.63%。试验结果表明,黄酮的提取率随着超声时间的增加而提高,这是由于随着超声时间的延长,黄酮被萃取的程度增大,当超声时间大于60 min时,随着超声时间的再增加,提取率增大的趋势明显趋于缓慢,为了节约时间,确定60 min是超声波的适宜时间。
2.1.4 超声功率对黄酮提取率的影响 准确称取桃花样品1.00 g,各4份,固定乙醇的体积分数为60%,料液比为1 g ∶20 mL 浸润30 min,超声时间60 min,依次在超声功率为40、60、80、100 W下进行试验,黄酮的提取率依次为4.14%、4.28%、4.72%、4.64%。试验结果表明,随着超声功率的升高,黄酮的提取率先升高后降低,在80W时黄酮的提取率达到最大值。这可能是随着超声功率的增大,对细胞壁的破碎作用加强,在加速黄酮溶解的同时杂质的溶解量也在增大,由于杂质对黄酮的吸附,黄酮的提取率没有提高反而下降。故确定提取桃花中黄酮适宜的超声功率为80 W。
2.2 多因素对桃花中黄酮提取率的影响
根据单因素试验结果确定各因素的合理水平见表1,本试验为3水平4因素的试验,故选用L9(34)正交表安排试验,试验方案及结果见表2。
表2直观分析表明,影响超声波辅助下桃花中黄酮提取的主要因素是乙醇的体积分数,影响因素大小依次为A>D>C>B,即乙醇体积分数>超声波功率>超声波时间>料液比,最佳工艺条件是A2B2C3D2。
方差分析结果表明,溶剂体积分数和超声功率是超声波提取桃花中黄酮主要的影响因素,而料液比和超声波时间对提取率影响不明显(表3)。因此,在提取过程中应该控制好乙醇的体积分数和超声波功率,而可以适当减少超声波时间,降低料液比。
2.3 验证性试验
称取适量预处理过的桃花样品,在正交试验所得优化提取工艺条件下进行验证试验,黄酮的得率为5.24%(n=3)。
3 结论
试验表明,以槲皮素为对照品,用紫外可见分光光度法测定桃花中黄酮的含量操作简便,加样平均回收率为101.62%,稳定性、重复性好、精密度和准确度高。
用超声波辅助法提取桃花中黄酮工艺简单,提取率高,根据直观分析和方差分析结果,综合考虑超声波辅助法提取桃花中黄酮的最佳工艺条件:乙醇的体积分数60%,料液比1 g ∶20 mL,超声时间60 min,超声功率80 W。
试验表明,桃花中黄酮含量较高,可以作为提取黄酮的原料之一。通过对桃花中黄酮提取工艺的探索,既为提取桃花中黄酮积累了经验,同时又为进一步开发桃花的药用价值和经济价值奠定了基础。
参考文献:
[1]马建中,张有成,徐小东,等. 桃花的药用价值研究[J]. 中药学报,2013,28(7):1020-1022.
[2]Kim Y H ,Yang H E,Park B K,et al. The extract of the flowers of Prunus persica,a new cosmetic ingredient,protects against solar ultraviolet-induced skin damage in vivo[J]. J Cosmet Sci,2002,53(1):27-34.[HJ1.65mm]
[3]Takagi S,Yamaki M,Masuda K,et al. Studies on the purgative clrugs.Ⅲ.On the constituents of the flowers of Prunus persica Batsch[J]. Yakugaku Zasshi,1977,97(1):109-110.
[4]黄河胜,马传庚,陈志武. 黄酮类化合物药理作用研究进展[J]. 中国中药杂志,2000,25(10):589-5921.
[5]董蒙蒙,喻 樊,刘 佳,等. 中华91、血草5种黄酮类化合物抗氧化和抗肿瘤活性的比较[J]. 江苏农业科学,2015,43(2):297-299.
[6]张 睿,徐雅琴,时 阳. 黄酮类化合物提取工艺研究[J]. 食品与机械,2003,19(1):21-22.
[7]伏劲松,王 博,蔡光华,等. 香柏总黄酮的提取工艺优化[J]. 食品科学,2011,27(2):3-5.
[8]梁 萱,赵建军,梁永锋. 金银花中黄酮提取工艺研究及野生与人工种植金银花中黄酮含量比较[J]. 中南药学,2013,11(3):173-175.

