基于OPG/RANK/RANKL系统比较研究前肢畸形WHBE兔骨代谢特征
吕建敏, 陈方明,陈诚
(浙江中医药大学动物实验研究中心,杭州 310053)
基于OPG/RANK/RANKL系统比较研究前肢畸形WHBE兔骨代谢特征
吕建敏, 陈方明,陈诚
(浙江中医药大学动物实验研究中心,杭州 310053)
目的 利用OPG (osteoprotegerin)/RANK (receptor activator of NF-κB)/RANKL (receptor activator of NF-κB ligand)系统比较研究前肢畸形WHBE兔骨代谢特征。方法 取WHBE兔、日本大耳白兔、前肢畸型WHBE兔各10只,分为3组,标记为HWR (healthy WHBE rabbit)、HJR (healthy Japanese rabbit)和FMWR (forelimb malformation WHBE rabbit)组。用X射线机所拍摄X-线片观察各组兔前肢尺桡部形状并测定平均灰度值;通过骨组织石蜡切片HE染色对前肢骨组织进行微观形态分析;采用荧光定量PCR法检测OPG、RANKL基因在肝脏中表达;采用酶联免疫法和免疫组化法分别测定OPG/RANK/RANKL蛋白在血清和骨组织中的表达。结果 与HWR和HJR组比较,FMWR组兔前肢尺桡部呈异常弯曲状,骨皮质明显变薄,X-线片所示灰度值显著低于HWR组(P<0.05)。FMWR组兔在肝脏RANKL基因表达水平和RANKL/OPG mRNA比值(P<0.01),血清RANK、RANKL蛋白含量及RANKL/OPG比值(P<0.05,P<0.01),骨组织RANKL蛋白表达阳性指数及RANKL/OPG比值(P<0.05,P<0.01)等指标上均显著高于HWR组和HJR组。与HJR组比较,HWR组兔肝脏OPG和RANKL基因表达水平显著提高(P<0.05,P<0.01)。结论 前肢畸形WHBE兔存在骨质量下降、骨组织受损现象,RANKL/OPG比值明显升高,骨代谢紊乱是其骨骼发生畸形的主要原因。与日本大耳白兔在RANKL基因表达水平上的品种差异可能是WHBE兔对前肢畸形易感的诱因。
WHBE兔;日本大耳白兔;前肢畸形;骨代谢;OPG/RANK/RANKL系统
白毛黑眼兔(WHBE rabbit)是浙江省的一种特色实验动物[1],在育种过程中,研究人员发现WHBE兔容易发生自发性前肢畸形疾病,且发生率要高于其他品种兔。已有研究表明,WHBE兔对骨骼畸形疾病敏感性可能与其血清中Ca和ALP水平较低有关[2],但具体原因尚不明确。另一方面,骨骼畸形是骨代谢异常的表现,osteoprotegerin (OPG)/receptor activator of NF-κB (RANK)/ receptor activator of NF-κB ligand (RANKL)系统是近年发现的调节骨代谢的重要通路[3],目前已作为主要的标志物广泛用于骨代谢的研究[4-8]。本研究首先从骨骼形状和骨组织微观形态观察上验证前肢畸形WHBE兔与 兔的差异性,再从OPG/RANK/RANKL系统入手,从基因和蛋白表达层面比较研究前肢畸形WHBE兔、 WHBE兔和 日本大耳白兔三者在OPG、RANK、RANKL表达特性上差异,为探讨前肢畸形WHBE兔致畸原因,揭示WHBE兔骨代谢特征提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
普通级前肢畸形WHBE兔10只,体重1.9~2.1 kg;普通级WHBE兔10只,体重2.5~2.4 kg;普通级日本大耳白兔10只,体重2.5~2.9 kg,均购自浙江省新昌县大市聚镇欣健兔场【SCXK(浙)2010-0042】。以上动物均为雄性,年龄在2.0~2.5 月龄。动物组织取材均在浙江中医药大学动物实验研究中心动物实验设施内进行【SYXK(浙)2013-0184】进行。并按实验动物使用的3R原则给予人道的关怀。
1.1.2 主要试剂
RNA提取试剂盒、cDNA反转录试剂和SYBR green 荧光定量PCR试剂盒均购自大连宝生物(TaKaRa)公司;OPG、RANKL及内参β-actin引物由生工生物工程(上海)有限公司合成。 封口膜和PCR板购自美国Bio-Rad公司。
兔护骨素(OPG)、兔核因子KB受体活化子(RANK)和兔核因子KB受体活化子配体因子(RANKL)ELISA 试剂盒(杭州诚维生物公司),批号分别为E2016050902、E2016050904、2016050903。
RANK兔多抗(博奥森公司),批号为AD062301;RANKL鼠单抗和OPG兔多抗(Adcam公司),批号分别为GR58773-1和GR81101-1。
1.1.3 主要仪器
PLX700B/B高频移动式C形臂X射线机(南京普爱射线影像设备有限公司),用于X线片拍摄。
组织均质机(法国Bertin公司); iQ5荧光定量PCR仪、水平电泳仪(美国Bio-Rad公司);Nanodrop2000蛋白核酸测定仪、冷冻高速离心机(美国Thermo公司);9700 PCR扩增仪(美国ABI公司),用于荧光定量PCR检测。Model 680型酶标仪(美国Bio-Rad公司),用于ELISA检测。Microm AP280组织包埋机、Microm HM 335E型轮转切片机(德国Microm公司);Leica染色机操作规程(瑞士Leica公司),NanoZoomer 2.0 RS数字切片扫描仪(日本滨松光电)用于免疫组化检测。
1.2 方法
1.2.1 动物分组
取2.0~2.5 月龄雄性前肢畸形WHBE兔、WHBE兔、日本大耳白兔各10只,分为3组:前肢畸形WHBE兔组(forelimb malformation WHBE rabbit group,简称FMWR组),WHBE兔组(healthy WHBE rabbit group,简称HWR组)和日本大耳白兔组(healthy Japanese rabbit group, 简称HJR组)。
1.2.2 样本采集
先将各组实验兔固定,取血,分离血清,置-20℃冰箱保存,用于血清OPG、RANK、RANKL蛋白含量的检测;再麻醉处死各组兔,X射线机下拍片后,取肝脏于冻存管中,-80℃冰箱保存,用于OPG、RANKL基因表达检测;取左侧前肢骨(尺桡部)于4%中性甲醛中固定,用于前肢骨组织学及免疫组化分析。
1.2.3 检测指标
(1)前肢骨形状X射线拍片观察及图像分析
分别将各组刚处死的实验兔置于PLX700B/B高频移动式C形臂X射线机下进行前肢骨(桡骨和尺骨)形状拍片。利用Image J图像分析软件分析前肢桡尺骨X线片,测定平均灰度值,以间接了解骨密度情况[9]。
(2)兔肝脏OPG、RANKL mRNA荧光定量PCR检测:1)肝脏总RNA提取和检测:采用TAKARA动物组织RNA提取试剂盒提取兔肝脏组织总RNA(具体操作步骤参照试剂盒说明书)。采用Nanodrop 2000蛋白核酸测定仪检测总RNA的纯度和浓度。所提取RNA样品于-80 ℃保存。2)cDNA合成: 每个样品取2 μg总RNA,按RT反转录试剂说明书方法合成cDNA,-20℃保存备用。3)qRT-PCR:根据Genbank中要检测基因的mRNA序列,用Oligo 6软件设计OPG、RANKL及内参β-actin引物(引物序列见表1)。荧光定量 PCR在伯乐iQ5荧光定量PCR仪上进行,反应体系按照TAKAR公司 SYBR Green 试剂盒推荐的方法进行配制,反应程序如下:95℃预变性10 s,然后95℃ 变性5 min,60℃ 复性30 s, 40个循环后进入融解曲线程序。每个样品PCR反应重复3次,根据溶解曲线判断产物特异性。差异基因表达水平参考文献[10]的方法计算(采用2-ΔΔCT计算)。
(3)兔血清OPG、RANK、RANKL蛋白含量
利用酶联免疫法,参照兔OPG、RANK、RANKL蛋白检测的ELISA 试剂盒说明书,测定以上3种蛋白在血清中的含量。
(4)兔前肢骨组织OPG、RANK、RANKL蛋白表达
兔前肢骨经固定、脱钙、石蜡包埋等程序制作成前肢桡骨组织石蜡包埋块,利用切片机对组织包埋块进行切片,每个标本取5 张切片,常规脱蜡后,分别用于HE染色和免疫组织化学染色。免疫组化操作按相关试剂盒说明书进行,制作好切片后用数字切片扫描仪对每张切片所要分析的部位进行扫描,利用图像分析软件(Carl Zeiss Imaging Systems:Carl Zeiss公司)进行图像分析,最终以阳性指数(总吸光度IOD/72049.356)来反映OPG、RANK和RANKL蛋白的表达强度。

表1 OPG、RANKL 及内参(β-actin)引物序列及
1.3 统计学方法
采用SAS 8.1 统计软件中的ANOVA过程进行单因素方差分析,试验数据用平均数±标准差表示,P>0.05为差异无显著性,P<0.05为差异有显著性,P<0.01为差异极显著,组间样本均数差异采用Duncan氏多重比较检验。
2 结果
2.1 各组兔前肢骨X射线拍片观察结果
三种实验兔前肢X光片见图1。与WHBE兔和日本大耳白兔相比,前肢畸形WHBE兔前肢尺桡部呈明显弯曲状。利用Image J 图像分析软件测得前肢畸形WHBE兔X-线片平均灰度值为(52.7±3.1),低于WHBE兔(55.9±1.3)和日本大耳白兔(55.4±3.5),且与WHBE差异存在显著性(P<0.05),说明前肢畸形WHBE兔的骨骼质量发生明显下降。
2.2 各组兔肝脏OPG、RANKL基因表达
兔肝脏OPG、RANKL 基因表达情况见表2和图2。WHBE兔的OPG和RANKL的基因表达水平均显著高于日本大耳白兔(P<0.05,P<0.01),说明这两种兔在骨代谢特征上存在差异,但两者在RANKL/OPG比值上差异无显著性(P>0.05)。与WHBE兔和日本大耳白兔相比,前肢畸形WHBE兔RANKL mRNA表达水平和RANKL/OPG mRNA比值均极显著升高(P<0.01)。
2.3 各组兔血清OPG、RANK、RANKL表达
兔血清ORG、RANK、RANKL蛋白含量见表3和图3。由表和图可见,3组兔在血清OPG蛋白含量上差异无显著性(P>0.05),且WHBE兔和日本大耳白兔之间在血清RANK和RANKL蛋白含量及RANKL/OPG比值上差异也无显著性(P>0.05)。与WHBE兔和日本大耳白兔比较,前肢畸形WHBE兔血清RANK和RANKL蛋白含量分别极显著(P<0.01)和显著升高(P<0.05);RANKL/OPG比值显著高于日本大耳白兔(P<0.01)和WHBE兔(P<0.05)。

注:A. WHBE兔;B. 日本大耳白兔;C. 前肢畸形WHBE兔。图1 兔前肢X线片Note: A. A healthy WHBE rabbit; B. A healthy Japanese rabbit; C. A forelimb malformation WHBE rabbit.Fig.1 X-ray film of forelimb in the rabbits
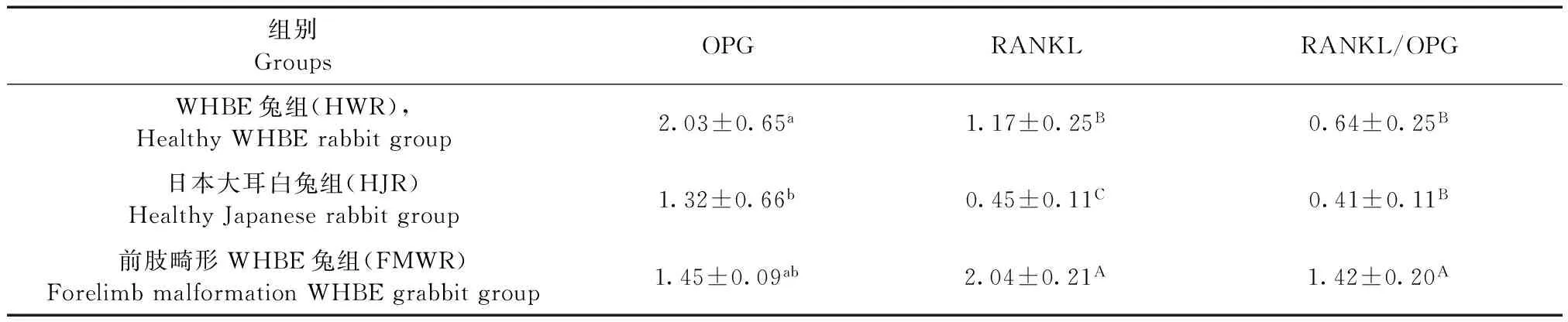
组别GroupsOPGRANKLRANKL/OPGWHBE兔组(HWR),HealthyWHBErabbitgroup2.03±0.65a1.17±0.25B0.64±0.25B日本大耳白兔组(HJR)HealthyJapaneserabbitgroup1.32±0.66b0.45±0.11C0.41±0.11B前肢畸形WHBE兔组(FMWR)ForelimbmalformationWHBEgrabbitgroup1.45±0.09ab2.04±0.21A1.42±0.20A
注:同列无字母或数据肩标存在相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05), 不同大写字母表示差异极显著(P<0.01)。下表同。
Note. In the same line, values with no letter or the same letter superscripts meanP>0.05, while values with different small letter superscripts meanP<0.05, and with different capital letter superscripts meanP<0.01. The same as in tab.3 and 4.

表3 各组兔血清OPG、RANK、RANKL蛋白含量及RANKL/ORG比值

注:同一指标柱形图上方无字母或数据肩标存在相同字母表示差异无显著性(P>0.05),不同小写字母表示差异有显著性(P<0.05), 不同大写字母表示差异极显著(P<0.01)。图3、6同。图2 肝脏 OPG/RANKL基因表达及RANKL/OPG比值Note. On the column figure of the same parameter, values with no letter or the same letter superscripts mean P>0.05, while values with different small letter superscripts mean P<0.05, and with different capital letter superscripts mean P<0.01. The same as in the Fig. 3 and Fig.6.Fig.2 OPG /RANKL gene expression and RANKL/OPG ratio in the rabbit livers
2.4 各组兔骨组织形态观察及骨组织OPG、RANK、RANKL蛋白表达
2.4.1 兔骨组织形态学观察
各组兔桡骨组织石蜡切片HE染色观察结果见图4, WHBE兔(A)和日本大耳白兔(B)的骨皮质部位均匀紧密;前肢畸形WHBE兔(C)骨皮质明显变薄,并存有大量编织骨,提示前肢畸形WHBE兔的骨组织发育不良,骨形态受损。
2.4.2 兔骨组织OPG、RANK、RANKL蛋白表达

注:(1): OPG蛋白表达;(2): RANK蛋白表达;(3): RANKL蛋白表达;(4): RANKL/OPG比值。图3 血清OPG/RANK/RANKL蛋白表达及RANKL/OPG比值Note. (1) OPG protein expression, (2) OPG protein expression, (3) OPG protein expression,(4)RANKL/OPG ratio.Fig.3 OPG/RANK/RANKL protein expression and of RANKL/OPG ratio in the rabbit serum
各组兔桡骨组织OPG/RANK/RANKL蛋白免疫组化染色图片见图5,蛋白表达的阳性指数见表4和图6。OPG/RANK/RANKL蛋白在骨细胞胞质和胞核中均有表达(图5)。且由表4和图6可知,各组兔在骨组织OPG和 RANK蛋白表达阳性指数上差异无显著性(P>0.05)。而前肢畸形WHBE兔的RANKL蛋白表达阳性指数和RANKL/OPG比值均高于其他两组兔,分别与日本大耳白兔和 WHBE兔具有极显著性(P<0.01)和差异有显著性 (P<0.05)。
3 讨论
OPG、RANK和RANKL是肿瘤坏死因子超家族的新成员,OPG属于分泌性糖蛋白,RANK和RANKL主要为跨膜蛋白[3]。OPG、RANK、RANKL基因可在多种组织中表达(如肝脏和骨组织)[3],其基因表达产物不仅存在于骨组织,而且也可在血清中测出,目前已有将血清OPG、RANK、RANKL蛋白检测结果用于骨代谢评估的报道[11-12]。OPG/RANK/RANKL对骨代谢的作用主要体现在对破骨细胞形成和活化的调控上[13],其具体机制为:在骨组织中,RANKL和OPG主要在成骨细胞(OB)中表达,RANK主要在破骨细胞(OC)表达,RANKL与RANK结合形成RANK-RANKL信号,可激活下游信号分子,促进破骨细胞分化、成熟和骨的吸收[14];而OPG作为受体拮抗剂,主要功能是与RANKL竞争性结合,抑制骨的吸收[13],在正常情况下,RANKL/OPG比值处于相对恒定状态,一旦异常升高或降低,将会使破骨细胞分化功能异常增强或减弱,导致骨代谢紊乱和相关疾病的发生。因此,RANKL/OPG比值被认为是调节破骨细胞分化的关键因子[15],可利用该比值判断骨破坏程度[16]。

注:A. WHBE兔;B. 日本大耳白兔;C. 前肢畸形WHBE兔。图4 兔桡骨石蜡切片HE 染色结果(×25)Note. A. A healthy WHBE rabbit, B. A healthy Japanese rabbit, C. A forelimb malformation WHBE rabbit. HE stainingFig.4 Comparison of the histology of the radius.

注:A. OPG蛋白表达; B. RANK蛋白表达;C. RANKL蛋白表达。图5 兔桡骨OPG、RANK、RANKL蛋白免疫组织化学染色(×100)Note. A. Expression of OPG, B. Expression of RANK, C. Expression of RANKL.Fig.5 Expression of OPG, RANK and RANKL in the rabbit radius tissues. Immunohistochemical staining.

组别Groups阳性指数Positiveindex(×103)OPGRANKRANKLRANKL/OPGWHBE兔组(HWR)HealthyWHBErabbitgroup13.68±1.8942.83±2.953.71±0.44ABb0.28±0.05ABb日本大耳白兔组(HJR)HealthyJapaneserabbitgroup13.60±1.4145.29±10.893.49±0.50Bb0.27±0.03Bb前肢畸形WHBE兔组(FMWR)ForelimbmalformationWHBEgrabbitgroup13.12±1.6247.91±2.234.44±0.33Aa0.34±0.03Aa

注:(1)OPG蛋白;(2)RANK蛋白;(3)RANKL蛋白;(4)RANKL/OPG比值。图6 骨组织OPG/RANK/RANKL蛋白表达阳性指数及RANKL/ORG比值Note. (1) OPG protein, (2) RANK protein, (3) RANKL protein,(4)RANKL/OPG ratio.Fig.6 Positive indexes of OPG /RANK/RANKL protein expression and RANK/OPG ratio in the rabbit bone tissues
本研究首先通过X摄片和骨组织石蜡切片HE染色观察验证了前肢畸形WHBE兔在骨形状、骨密度及骨组织微观形态上与 兔的差异性,确认了前肢畸形WHBE兔存在骨质量下降和骨组织形态受损的病症。继而从基因和蛋白表达层面探讨前肢畸形WHBE兔的致病原因,发现前肢畸形WHBE兔无论在基因还是蛋白表达水平上,其RANKL/OPG比值均显著高于WHEB兔及日本大耳白兔。而RANKL/OPG比值是判断骨破坏程度的重要因子[15],RANKL/OPG比值升高可使破骨细胞分化作用增强,骨的吸收和破坏程度加剧,导致骨代谢异常,这可能是导致前肢畸形WHBE兔发病的主要原因。此结果与前人报道较一致[16-19],他们在研究骨质疏松和类风湿关节炎等骨代谢疾病发病机制时,均发现上述疾病发生与RANKL/OPG比值升高相关。此外,本研究还发现 WHBE兔RANKL基因表达水平显著高于 日本大耳白兔,说明两者在RANKL基因表达上存在品种差异,这可能是WHBE兔易发生前肢畸形的诱因,但具体机制还有待进一步研究。
基于基因、血清蛋白、骨组织蛋白表达层面分析,可推测RANKL/OPG比值升高是造成前肢畸形WHBE兔骨骼发育异常的主要原因,而WHBE兔和日本大耳白兔在RANKL基因表达上的品种差异,可能是WHBE兔容易发生骨骼畸形的诱发因素之一。本研究发现不仅揭示了前肢畸形WHBE兔的发病原因,而且为自发性骨代谢疾病动物模型的开发提供了思路。
[1] 蔡月琴, 屠珏, 余佳, 等. RAPD 标记技术用于 WHBE 兔近交系培育中的遗传分析 [J]. 中国实验动物学报,2009,17( 5) : 326-329.
[2] 陈方明, 徐剑钦, 朱科燕, 等. 前肢畸形WHBE兔血清钙、磷、碱性磷酸酶含量检测及骨密度分析 [J]. 实验动物与比较医学, 2016, 36 (1): 19-23.
[3] Walsh MXC, Choi YW. Biology of the RANKL-RANK-OPG system in immunity, bone, and beyond [J]. Front Immunol, 2014: 5: 511-521.
[4] 吕建敏. OPG/RANK/RANKL系统在实验动物骨骼发育营养需要评估中的应用 [J]. 中国比较医学杂志, 2015, 25(11): 76-79.
[5] Song HM,Wei YC, Li N, et al. Effects of Wenyangbushen formula on the expression of VEGF, OPG, RANK and RANKL in rabbits with steroid-induced femoral head avascular necrosis [J]. Mol Med Reports, 2015, 12(6): 8155-8161.
[6] Bu SY, Kim MH, Choi MK. Effect of silicon supplementation on bone status in ovariectomized rats under calcium-replete condition[J]. Biol Trace Elemnt Res, 2016, 171(1): 138-144.
[7] Johnson DC, Weinhold N, Mitchell J. Genetic factors influencing the risk of multiple myeloma bone disease [J]. Leukemia, 2016, 30(4): 883-888.
[8] 刘康,吴风晴,吴连国,等. 强骨胶囊对骨质疏松大鼠OPG/RANKL/RANK系统的影响[J]. 中华中医药杂志(原中国医药学报), 2016, 31(3): 1071-1073.
[9] 吕红斌, 杨颖, 曾驰, 等. 低强度脉冲超声对新生骨成熟过程的影响 [J]. 中南大学学报(医学版), 2009, 34(10): 984-986.
[10] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time qμantitative PCR and the 2(-Delta Delta C(T)) Method [J]. Methods, 2001, 25(4): 402-408.
[11] Kanellakis S, Moschonis G, Tenta R, et al. Changes in parameters of bone metabolism in postmenopausal women following a 12-month intervention period using dairy products enriched with calcium, vitamin D, and phylloquinone (vitamin K1) or menaquinone-7 (vitamin K2 ): The Postmenopausal Health Study II [J]. Calcif Tissue Int, 2012, 90: 251-262.
[12] Wagner D, Fahrleitner-Pammer A. Levels of osteoprotegerin (OPG) and receptor activator for nuclear factor kappa B ligand (RANKL) in serum: Are they of any help? [J]. Wiener Medizinische Wochenschrift, 2010, 160(17): 452-457.
[13] Vega D, Maalouf NM, Sakhaee K. The role of receptor activator of nuclear factor-B(RANK)/RANK ligand/osteoprotegerin: clinical implications[J]. J Clin Endocrinol Metab, 2007, 92(12): 4514-4521.
[14] Boyce BF. Advances in the regulation of osteoclasts and osteoclast functions [J]. J Dent Res, 2013, 92(10): 860-867.
[15] Hofbauer LC, Sundeep Khosla S, Dunstan CR, et al. The roles of osteoprotegerin and osteoprotegerin ligand in the paracrine regulation of bone resorption [J]. J Bone Mineral Res, 2000, 15(1): 2-12.
[16] 朱再胜, 戴爽, 吴玲, 等. 高脂饮食诱导肥胖小鼠模型中氧化应激、炎症递质对骨代谢的影响及其可能机制 [J]. 温州医科大学学报, 2014, 44(9): 631-636.
[17] 冯建书, 付强, 闫世杰, 等. 仙灵骨葆对骨质疏松大鼠OPG/RANK/RANKL 表达的影响 [J]. 现代生物医学进展, 2012, 12(23): 4438-4441.
[18] Skoumal M, Kolarz G, Haberhauer G, et, al. Osteoprotegerin and the receptor activator of NF-kappa B ligand in the serum and synovial fluid. A comparison of patients with long tending rheumatoid arthritis and osteoarthritis [J]. Rheumatol Int, 2005, 26: 63-69.
[19] Eghbali-Fatourechi G,Khosla S,Sanyal A,et al. Role of RANK ligand in mediating increased bone resorption of in early postmenopausal women [J]. Clin Invest, 2003, 111( 8): 1120-1122.
Comparative study on the characteristics of bone metabolism in forelimb malformation WHBE rabbits via the OPG/RANK/RANKL system
LV Jian-min*, CHEN Fang-min, CHEN Cheng
(Laboratory Animal Research Center, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Objective To comparatively investigate the characteristics of bone metabolism in forelimb malformation WHBE rabbits based on the OPG/RANK/RANKL system. Methods Healthy male 2-2.5-month old WHBE rabbit (HWR), Healthy Japanese rabbit (HJR) and forelimb malformation WHBE rabbit (FMWR) were used in this study and divided into 3 groups, HWR, HJR and FMWR groups, with 10 rabbits in each group. The shape of forelimb and mean gray value observed from X-ray film were examined, and the bone tissue micro-morphology was analyzed using HE staining. Real-time fluorescence quantitative PCR was used to determine the expression of osteoprotegerin (OPG) and receptor activator of NF-KB ligand (RANKL) mRNA. The expressions of OPG, receptor activator of NF-KB (RANK) and RANKL protein in serum and bone tissue were assayed by enzyme-linked immunoassay (ELISA) and immunohistochemistry, respectively. Results Compared with the HWR and HJR groups, rabbits in the FMWR group appeared abnormal in toutuous forelimb and thinner bone cortex. The mean gray values of X-ray in the FMWR group were lower than that in the HWR group (P<0.05). There were significant differences between the FMWR and healthy rabbits (HWR and HJR) in the following parameters: RANKL mRNA expression and RANKL/OPG mRNA ratio in the liver(P<0.05,P<0.01), serum protein expression of RANK and RANKL and RANKL/OPG ratio (P<0.05,P<0.01), and positive index of expression of RANKL protein and RANKL/OPG ratio in the bone tissue(P<0.05,P<0.01). Furthermore, the gene expression levels of OPG and RANKL of HWR were significantly higher than that of HJR(P<0.05,P<0.01). Conclusions The FMWR show some abnormal symptoms in bone metabolism as well as decrease of bone quality and histological changes of bone micro-structure, due to the significant increase of RANKL/OPG ratio of FMWR. The breed differences between WHBE and Japanese rabbits in RANKL mRNA expression level may be one of factors inducing limb malformation in the WHBE rabbits.
WHBE rabbit; Japanese rabbit; Forelimb malformation; Bone metabolism; OPG/RANK/RANKL system
LV Jian-min, E-mail: ljm6666@163.com
浙江省科技厅资助项目基金(编号:2014C37008);浙江中医药大学比较医学创新团队基金(编号:XTD201301)。
吕建敏(1971-),女,研究员,博士,研究方向:实验动物与比较医学。E-mail: ljm6666@163.com。
研究报告
Q95-33
A
1005-4847(2016)05-0503-08
10.3969/j.issn.1005-4847.2016.05.012
2016-05-30

