2型猪链球菌SsU05-0474的表达纯化及单克隆抗体制备
杨宝玲,陈福广,谢 芳,刘思国,沈国顺,张跃灵
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨150001)
·研究论文·
2型猪链球菌SsU05-0474的表达纯化及单克隆抗体制备
杨宝玲1,陈福广2,谢 芳2,刘思国2,沈国顺1,张跃灵2
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨150001)
为了鉴定2型猪链球菌(Streptococcus suis serotype 2,Ss2)菌毛骨架蛋白SsU05-0474(本文中简称SsMps)在菌体中的位置和存在形式,本研究以2型猪链球菌05ZYH33菌株基因组作为模板,PCR扩增菌毛骨架蛋白基因SsU05-0474,将其克隆至表达载体pET22b,构建重组质粒pET22b/SsMps,转化至E.coli BL21(DE3)中,用IPTG诱导表达SsMps蛋白,并通过亲和层析纯化。纯化的SsMps蛋白免疫BALB/c雌鼠,利用细胞融合筛选制备该重组蛋白的单克隆抗体。结果显示,SsMps蛋白在大肠杆菌中以可溶形式表达,分子质量大小为45 kDa。每升大肠杆菌培养物可获得SsMps重组蛋白约30 mg,纯度大于95%。获得了1株该重组蛋白的单克隆抗体1D9,抗体亚型为IgG1/κ。通过单抗1D9与05ZYH33菌体蛋白组分Western blot,发现该抗体能够特异识别SsMps,并定位出SsMps大部分存在于细胞壁蛋白成分中,呈不同聚体存在。本研究制备的SsMps纯化蛋白及其单克隆抗体为研究SsMps蛋白的功能提供了工具。
2型猪链球菌;SsMps基因;蛋白表达;蛋白纯化;单克隆抗体
2 型猪链球菌(Streptococcus suis serotype 2,Ss2)是一种人畜共患传染病病原体,可引起猪的脑膜炎、关节炎、心内膜炎、急性败血症及死亡,而且可通过伤口和呼吸道传播给人,导致人的感染发病和死亡[1,2]。Ss2感染在全球范围发生,给养猪业造成巨大的经济损失,对相关从业人员的健康也构成严重威胁。1998年和2005年在我国江苏省和四川省分别爆发了大规模的Ss2感染人的公共卫生事件,共造成200余例感染,42人死亡,更是引起了国内外研究人员的广泛关注[3-5]。
目前已经发现多种Ss2毒力因子,包括荚膜多糖、溶菌酶释放蛋白、溶血素、胞外蛋白因子和表面LPXTG蛋白等,其中存在于菌体表面的LPXTG蛋白由于直接接触宿主细胞或蛋白,在致病性中往往发挥重要作用[6,7]。经基因组序列分析,我们找到了Ss2菌株05ZYH33的一种LPXTG蛋白,基因组编号为SsU05-0474。该基因编码蛋白与菌毛骨架蛋白具有较高同源性[8],因此在本文中简称SsMps蛋白。据报道菌毛骨架蛋白在与宿主的相互作用中扮演重要角色[9]。我们的初步研究发现SsMps具有结合宿主的一种重要免疫因子的能力,可能在Ss2致病性中起作用,但是SsMps在Ss2中的位置和存在形式还不确定。本文表达纯化了SsMps蛋白并制备了该蛋白的单克隆抗体,有效识别并定位了SsMps,并为深入研究SsMps的新功能及其在Ss2致病性中的作用提供了工具。
1 材料与方法
1.1 菌种、载体、细胞和实验动物 2型猪链球菌05ZYH33菌株由蔡雪辉研究员赠予;E.coli DH5α 和E.coli BL21(DE3)感受态细胞均购自天根生物科技有限公司;表达载体pET22b和SP2/0细胞为实验室保存;5 w BALB/c雌鼠购自北京维通利华有限公司。
1.2 主要试剂 Prime STAR Max DNA Polymerase购自宝生物工程(大连)有限公司;PCR产物纯化试剂盒、质粒小提试剂盒、DNA胶回收试剂盒购自Qiagen公司;限制性内切酶NdeI、XhoI和T4 DNA连接酶购自Fermentas公司;胎牛血清、RPMI1640培养基和双抗购自HyClone公司;HAT、HT、弗氏完全佐剂、弗氏不完全佐剂和PEG3350购自Sigma公司;TMB和DAB显色液购自天根生化科技(北京)有限公司。
1.3 SsMps基因的克隆 根据 Ss2菌株05ZYH33的SSU05_0474(GenBank登录号:145688934)基因序列,设计引物Nde I F:5'-GATCCATATGCAAA CTGTTGATAGCGGAA-3'(下划线处为 Nde Ι酶切位点)和XhoΙR:5'-GATCCTCGAGGACACC ACCCTTTTTATTGA-3'(下划线处为 Xho Ι酶切位点)。扩增的反应体系为50 μL:25 μL Prime STAR Max DNA Polymerase、1 μL引物NdeΙF(10 μmol/L)、1 μL引物XhoΙR(10 μmol/L)、1~2 ng 05ZYH33基因组DNA,23 μL ddH2O。反应条件:94℃预变性5 min,然后94℃变性30 s,52℃退火15 s,72℃延伸1 min,进行30个循环,最后72℃延伸10 min。PCR产物经PCR纯化试剂盒纯化后,用NdeΙ和XhoΙ的双酶切,然后用T4 DNA连接酶与经NdeΙ、XhoΙ双酶切的pET22b载体连接后,转化E.coli DH5α。转化菌株提取质粒进行双酶切鉴定,取含有正确大小插入片段的重组质粒pET22b/ SsMps,送华大基因公司进行测序鉴定。经测序正确的重组质粒进行下一步的SsMps蛋白的表达与纯化。
1.4 SsMps蛋白的表达和纯化 将测序正确的重组质粒pET22b/SsMps转化E.coli BL21(DE3),涂布于固体LB氨苄平板(含氨苄青霉素100 μg/mL),挑取单个菌落接种于LB氨苄液体培养基(含氨苄青霉素100 μg/mL)中,37℃、220 r/min过夜培养,然后以1:100的比例转接于1 L LB氨苄液体培养基中,于37℃、220 r/min培养至OD600为0.6~0.8,加入IPTG至终浓度0.8 μmol/L,22℃、220 r/min过夜诱导。4℃、4000×g离心10 min,收集菌液,用40 mL 20 mmol/L Tris-HCl、0.5 mol/L NaCl、5 mmol/ L咪唑、pH 7.9溶液重悬,超声破碎,18 000×g离心10 min。上清采用Ni-NTA亲和树脂纯化,用梯度咪(20、40、60、80、100、250 mmol/L)进行洗脱。将收集的蛋白进行SDS-PAGE电泳,根据结果合并含有纯化的SsMps蛋白的收集液,采用超滤柱(Millipore)进行浓缩。然后用PD-10脱盐柱(GE)将蛋白溶解缓冲液转换为50 mmol/L磷酸钠缓冲液,pH7.4,分装后于-70℃冻存。
1.5 SsMps单克隆抗体的制备
1.5.1 动物免疫 用纯化的SsMps蛋白为抗原,按照标准免疫程序进行免疫[10],将等体积的目的蛋白与佐剂均匀混合乳化后,背部多点皮下注射,每只小鼠注射100 μL含有100 μg重组蛋白的混合乳化液。第1次免疫用弗氏完全佐剂,第1次和第2次用弗氏不完全佐剂,间隔2周免疫1次。第3次免疫后d7尾静脉采血,分离血清,用ELISA检测抗体效价。当抗体效价达到1:2.56×105时,取小鼠脾细胞进行细胞融合。
1.5.2 杂交瘤细胞的筛选及单克隆抗体腹水的制备无菌条件下分离制备免疫小鼠的脾细胞,按照脾细胞:SP2/0细胞为10:1的比例,将细胞于50 mL离心管中混匀后离心,弃掉上清后加入700 μL 37℃预热的PEG3350,轻轻搅拌30 s后静置30 s,而后慢慢加入30 mL预热的RPMI 1640培养基终止融合,离心后将上清弃净,用加入饲养层细胞的HAT培养基重悬后,均匀铺布于96孔细胞培养板中,置于37℃、5 % CO2培养箱中培养。融合后d10换用HT培养基,并连续用ELISA进行阳性克隆的筛选与纯化,直至筛选到单一的阳性克隆。按照常规的试验方法制备腹水[11],利用辛酸-硫酸铵沉淀法纯化抗SsMps的单克隆抗体。
1.5.3 腹水单克隆抗体效价的测定及抗体亚型的鉴定效价测定 以SsMps重组蛋白作为检测抗原,用间接ELISA进行抗体效价测定。亚型鉴定参照Southern Biotech公司的抗体亚类试剂盒说明书。
1.6 05ZYH33菌株蛋白组分提取 挑取05ZYH33菌株的单菌落接种于2 mL Todd-Hewitt肉汤培养基(THB),37℃过夜静置培养后,按1:100接种量接种于80 mL新鲜THB培养基。37℃静置培养12 h后,3500×g离心10 min。上清液用超滤管超滤浓缩60倍,即为05ZYH33胞外蛋白组分。菌体沉淀用去离子水洗涤后悬浮于800 μL PBS-蔗糖(20%蔗糖于PBS)溶液,加入溶菌酶和链溶菌素(Sigma),37℃过夜轻摇孵育后,8000×g离心10 min,上清即为细胞壁蛋白组分。沉淀用PBS-蔗糖溶液洗涤1次,800 μL PBS重悬后,超声破碎。然后15 000×g离心3 h,上清为胞内蛋白组分,沉淀用缓冲液(800 μL 1 % Tween、50 mmol/L Hepes、200 mmol/L NaCl,pH 4.0)溶解,即膜蛋白组分。
1.7 Western blot 参照文献[12]的方法进行。将目的蛋白进行SDS-PAGE电泳,然后以15 V恒压,60 min半干转印到硝酸纤维素膜。转好的膜浸入封闭液(5%脱脂乳,PBST配制)中,4℃轻摇封闭过夜。封闭后,PBST洗膜3次,以制备的SsMps单克隆抗体为一抗,用PBST以1:300比例稀释,4℃轻摇孵育过夜。PBST洗膜3次,荧光二抗用PBST以1:5000稀释,37℃轻摇孵育1 h,PBST洗膜3次,最后用扫膜仪扫膜存图。
2 结果
2.1 SsMps基因的PCR扩增及重组质粒的双酶切鉴定以Ss2菌株05ZYH33的基因组DNA为模版,PCR扩增出目的片段,经琼脂凝胶电泳检测与SsMps基因(1443 bp)的大小一致(图1A)。获得的重组质粒pET22b/SsMps经NdeΙ和XhoΙ双酶切鉴定,插入片段与SsMps基因大小吻合(图1B),并经测序证实为正确的SsMps序列,证明重组质粒构建成功。
2.2 SsMps蛋白的表达与纯化 经IPTG诱导后,SDSPAGE分析发现,相比pET22b空载体转化菌株,pET22b-SsMps转化菌株在45 kDa处出现了1个蛋白条带,与纯化后的SsMps大小一致。超声破碎离心后,这个蛋白仍然存在于上清中,说明SsMps可溶表达。经Ni-NTA亲和树脂纯化后,获得了纯度高于95 %的SsMps蛋白(图2)。

图1 SsMps基因扩增(A)及重组质粒pET22b/SsMps的双酶切鉴定(B)Fig.1 PCR amplifi cation of SsMps gene (A) and identifi cation of pET22b/SsMps by double digestion (B)
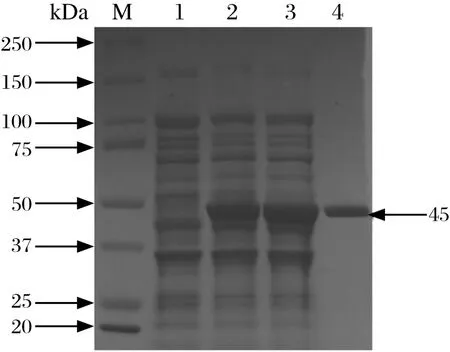
图2 重组SsMps蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinent SsMps protein
2.3 抗SsMps蛋白单抗制备、效价测定及亚型鉴定以SsMps蛋白为抗原,经动物免疫、细胞融合和筛选等过程,最终获得1株抗SsMps蛋白的单克隆抗体1D9,用辛酸-硫酸铵沉淀法纯化出高纯度抗体(图3A)。以纯化的SsMps重组蛋白为检测原(5 μg/mL),采用间接ELISA的方法测定单抗的效价,结果达到了1:2.56×105。采用亚型鉴定试剂盒鉴定出抗体亚型重链为IgG1,轻链为κ链,结果见图3B。
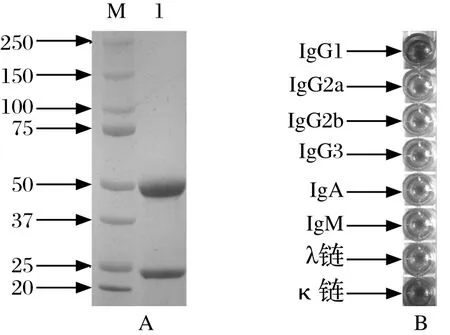
图3 抗SsMps单克隆抗体的SDS-PAGE分析(A)及亚型鉴定(B)Fig.3 SDS-PAGE analysis of purifi ed anti-SsMps monoclonal antibody (A) and subtype identifi cation of the antibody (B)
2.4 单克隆抗的特异性检测 为了检测获得的ID9对SsMps的特异性,我们制备了05ZYH33菌株的不同菌体组分,包括细胞壁蛋白(胞壁)、膜蛋白(胞膜)、胞内蛋白(胞内)和分泌蛋白(胞外)(图4A)。通过单克隆抗体ID9与各菌体蛋白组分进行Western blot,结果显示胞壁蛋白组分中出现了多个条带,大小约呈倍数,最小条带分子量约55 kDa。胞外蛋白组分中只出现了微弱的最小分子量的条带,胞膜和胞内蛋白组分中没有出现任何条带(图4B)。这与链球菌中菌毛骨架蛋白呈不同聚体形式存在相符,并与相关研究中的结果类似[8,13]。除了这些大小呈倍数的蛋白条带,没有扩增出其他条带,说明制备的的单克隆抗体特异性良好。需要指出的是,检测出的SsMps单体蛋白分子量约55 kDa,较预测的分子量(45 kDa)略大。
3 讨论
Ss2是一种重要的人兽共患传染病病原体,其致病因子和致病机制是目前研究的热点。Ss2菌株05ZYH33的SsMps组装于菌体表面,与宿主环境直接接触,可能在Ss2致病中起重要作用。我们研究发现它具有结合宿主免疫因子的能力,但是对其具体功能的深入研究,需要纯化的SsMps蛋白和单克隆抗体。

图4 05ZYH33菌体组分提取(A)和抗SsMps单克隆抗体对05ZYH33菌体组分的Western blot分析(B)Fig.4 05ZYH33 cell fraction isolation and Western blot analysis of anti-SsMps monoclonal antibody against cell protein fractions of 05ZYH33 (B)
本研究成功构建了pET22b/SsMps表达载体,对目的蛋白进行表达,经过大量表达纯化获得了高纯度的SsMps蛋白。以此蛋白为免疫原免疫小鼠获得了稳定分泌抗SsMps蛋白的单克隆抗体的杂交瘤细胞系。Western blot结果显示,本研究获得的单克隆抗体1D9能够特异识别SsMps,并检测出SsMps主要存在于Ss2的胞壁上,呈不同聚体状态存在,这与SsMps是LPXTG蛋白及菌毛骨架蛋白的特性相符。同时本研究检测出SsMps蛋白分子量约55 kDa,较预测的分子量略大。我们推测在SsMps作为菌毛骨架,天然状态下可能共价连接有小分子量的寡糖或肽,但这还有待进一步证实。
本实验获得的SsMps蛋白和抗SsMps的单克隆抗体1D9,为深入研究SsMps的功能以及SsMps在Ss2致病性中的作用提供了工具。
[1] Feng Y, Zhang H, Wu Z, et al.Streptococcus suis infection: An emerging/reemerging challenge of bacterial infectious diseases? [J].Virulence, 2014, 5(4): 477-497.
[2] Lun Z R, Wang Q P, Chen X G, et al.Streptococcus suis: an emerging zoonotic pathogen[J].Lancet Infect Dis, 2007, 7(3): 201-209.
[3] Segura M.Streptococcus suis: an emerging human threat [J].J Infect Dis, 2009, 199(1): 4-6.
[4] Poggenborg R, Gaini S, Kjaeldgaard P, et al.Streptococcus suis: meningitis, spondylodiscitis and bacteraemia with a serotype 14 strain [J].Scand J Infect Dis, 2008, 40(4): 346-349.
[5] Gottschalk M, Segura M, Xu J.Streptococcus suis infections in humans: the Chinese experience and the situation in North America [J].Anim Health Res Rev, 2007, 8(1): 29-45.
[6] 王长军.高致病性2型猪链球菌分子致病机理研究[D].南京: 南京医科大学, 2009.
[7] Zhang A D, Chen B, Yuan Z Z, et al.HP0197 Contributes to CPS synthesis and the virulence of Streptococcus suis via CcpA[J].PLos One, 2012, 7(11): e50987.
[8] Garibaldi M, Rodriguez-Ortega M J, Mandanici F, et al.Immunoprotective activities of a Streptococcus suis pilus subunit in murine models of infection [J].Vaccine, 2010, 28(20): 3609-3616.
[9] Turroni F, Serafini F, Foroni E, et al.Role of sortasedependent pili of Bifidobacterium bifidum PRL2010 in modulating bacterium-host interactions[J].Proc Natl Acad Sci U S A, 2013, 110(27): 11151-11156.
[10] Benjamini E, Leskowitz S.Immunology: A short course [M].2nd ed.New York: Wiley-Liss, Inc, 1991.
[11] 沈关心, 周汝麟.现代免疫学实验技术[M].2版.湖北科学技术出版社, 2002: 154-163.
[12] 萨姆布鲁克 J, 拉塞尔 D W.分子克隆实验指南[M].3版.黄培堂, 王嘉玺, 朱厚础, 等, 译.北京: 科学出版社, 2002: 1713-1722.
[13] Fittipaldi N, Takamatsu D, Dominguez-Punaro M D, et al.Mutations in the gene encoding the ancillary pilin subunit of the Streptococcus suis srtF cluster result in pili formed by the major subunit only[J].PLoS One, 2010, 5(1): e8426.
EXPRESSION AND PURIFICATION OF SsU05-0474 OF STREPTOCOCCUS SUIS 05ZYH33 AND PREPARATION OF SPECIFIC MONOCLONAL ANTIBODY
YANG Bao-ling1, CHEN Fu-guang2, XIE Fang2, LIU Si-guo2, SHEN Guo-shun1, ZHANG Yue-ling2
(1.College of Animal Science and Veterinary Medicine, Shenyang Agricultural University, Shengyang 110866, China; 2.State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, CAAS, Harbin 150001, China)
To determine the location and formation of the major pilus subunit SsU05-0474 (SsMps) in Streptococcus suis serotype 2 (Ss2), the gene coding for SsMps was amplifi ed in PCR from the genome of Streptococcus suis serotype 2 strain 05ZYH33 and cloned into pET22b to construct the expression plasmid pET22b/SsMps, which was then transformed into E.coli BL21(DE3).The recombinant SsMps was expressed with induction of IPTG and purified in affinity chromatography.BALB/c mice were immunized with purified SsMps.The anti-SsMps monoclonal antibody was prepared via cell fusion and subsequent screening.The results showed that the recombinant SsMps protein, with a molecular mass of about 45 kDa, was expressed as soluble form.About 30 mg of SsMps with purity above 95% could be obtained from 1 L of E.coli culture.One monoclonal antibody 1D9 was obtained and determined to be subtype of IgG1 with κ chain.As demonstrated in Western blot, the monoclonal antibody ID9 specifi cally reacted with natural SsMps in cellularwall fraction of 05ZYH33 and SsMps was presentas polymers with different lengths.The availability of purified SsMps protein and monoclonal antibody laid solid foundation for further research on its functions.
Streptococcus suis serotype 2; SsMps gene; protein expression; protein purifi cation; monoclonal antibody
S852.61
A
1674-6422(2016)02-0025-06
2016-01-06
杨宝玲,女,硕士研究生,预防兽医学专业
沈国顺,E-mail:shengguoshun2000@126.com;张跃灵,E-mail:zhangyueling@caas.cn

