微乳液毛细管电动色谱法测定大鼠滑膜细胞中雷公藤甲素的含量
林诗瑶 丛日琳 李 琦 孙照霞 徐 伟 沙 玫 余丽双
(福建中医药大学药学院,福州 350122)
微乳液毛细管电动色谱法测定大鼠滑膜细胞中雷公藤甲素的含量
林诗瑶 丛日琳 李 琦 孙照霞 徐 伟 沙 玫 余丽双*
(福建中医药大学药学院,福州 350122)
建立微乳液毛细管电动色谱法快速测定大鼠滑膜细胞内外液中雷公藤甲素含量的方法。在雷公藤甲素不同给药时间孵育条件下,将滑膜细胞分为空白对照组和给药组,测定滑膜细胞内外液中雷公藤甲素含量,并比较了细胞外液中雷公藤甲素在不同给药时间的含量变化。毛细管电泳运行缓冲液组成:1%(w/V)SDS,3%(V/V)正丁醇,1%(V/V)乙酸乙酯,96%(V/V)5 mmol/L硼砂-10 mmol/L磷酸盐溶液, pH 9.0; 运行电压:25 kV; 压力进样:0.5 psi×6 s;电泳操作温度:25℃;检测波长:214 nm。结果表明,细胞内外液中的雷公藤甲素所呈现的线性关系良好,相关系数分别为0.9995和 0.9991。当给药24 h时,细胞内外液中的雷公藤甲素浓度分别为0.736和20.745 μg/mL。本方法简单准确、灵敏度高、精密度好,可用于滑膜细胞内外液中雷公藤甲素浓度的动态变化规律研究,为进一步研究中药有效成分对滑膜细胞功能和活性的影响提供方法学基础。
微乳液毛细管电动色谱;滑膜细胞;雷公藤甲素
1 引 言
类风湿性关节炎(Rheumatoid arthritis, RA)是一种以关节滑膜炎为特征的慢性全身性自身免疫性疾病,以多关节炎症、滑膜增生和骨侵蚀为基本特征在我国的患病率高,是造成人群丧失劳动力和致残的主要疾病之一[1]。滑膜炎是发生在关节内滑膜组织的一种炎性病变,滑膜炎伴大量血管翳形成是导致RA骨侵蚀、关节破坏的主要原因[2]。
现代临床上治疗类风湿性关节炎主要采用非甾体抗炎药、慢作用抗风湿药、肾上腺皮质激素类药等。已有文献报道,卫矛科植物雷公藤(TripterygiumwilfordiiHook.f.)对治疗免疫性炎症反应性疾病具有一定疗效[3]。雷公藤甲素(Triptolide,TP,化学结构式见图1)是从雷公藤中分离出来的活性最高的环氧化二萜内酯化合物,是雷公藤治疗RA的主要有效成分之一,其具有抗炎免疫功效。目前,以雷公藤甲素为主要活性成分的多种雷公藤提取物在临床治疗类风湿性关节炎疗效确切,已得到广泛认可[4]。对TP在RA治疗研究主要集中在其作用机理上,而文献报道中,大多是在中药材[5]、动物血液和尿液等体液中对TP的检测,尚未见细胞液中TP含量测定的报道。细胞内、外液中TP的含量直观反映了其在生物体内的代谢情况,为药代动力学的研究提供更为有利的依据,因此对雷公藤甲素在生物细胞中的含量测定具有重要的实际应用价值。
1991年,Watarai首次应用微乳液作为毛细管电泳的分离介质,从而形成了一种新的毛细管电泳技术-微乳液毛细管电动色谱法(Microemulsion eletrokinetic chromatography,MEEKC)[6~8]。MEEKC是在电渗流的驱动下,对阴离子、阳离子和中性物质同时进行分离的一种CE模式[9],多用于药物分析[10,11]、生物样品或代谢产物分析[12]等方面。相比于HPLC,MEEKC具有分析速度快、试剂消耗少、分析成本低等优势。
目前,MEEKC在滑膜细胞液中药物含量测定未见报道,因此本研究以大鼠滑膜细胞为研究对象,利用微乳液毛细管电动色谱法,测定大鼠滑膜细胞内、外液中雷公藤甲素的含量,为雷公藤甲素在临床治疗类风湿性关节炎研究提供一种快速可行的含量检测新方法,亦进一步拓宽MEEKC的应用范围,为细胞中药物代谢研究提供新方法。
2 实验部分
2.1 仪器与试药
P/ACETM MDQ型毛细管电泳仪,配备DAD检测器和32 Karat 5.0工作站(美国Beckman公司);弹性石英毛细管(内径75 μm,总长60.5 cm,有效长度50 cm);Starter 3C型酸度计(上海奥豪斯仪器有限公司);XS105电子分析天平(METTLER TOLEDO); KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司); QL-861型涡旋仪(江苏海门其林贝尔有限公司)。
RPM DMEM(Dulbecco′s Modified Eagle′s Medium,美国Gibco公司); 0.25% 胰蛋白酶-0.02% EDTA消化液(HyClone公司); 雷公藤甲素标准品(批号:111567-200502,中国药品生物制品检定所); PBS液均按标准配制(pH 7.4); 二甲基亚砜(DMSO,Sigma公司); 十二烷基硫酸钠(SDS,合肥新恩源生物科技有限公司); 乙酸乙酯、正丁醇为色谱纯试剂,硼砂、NaH2PO4(国药集团化学试剂有限公司)。实验用水为Milli-Q系统(Millipore公司)处理的超纯水。
2.2 对照品溶液配制
称取雷公藤甲素对照品适量,用甲醇溶解并制成1 mg/mL的样品储备液。
称定雷公藤甲素对照品适量,用含有0.5% DMSO的培养基溶解并制成浓度为1 mg/mL 的溶液,细胞给药时可用培养基稀释。
2.3 细胞的复苏与培养 从液氮中取出冻存的大鼠滑膜细胞,将冻存管立即投入37℃水浴锅中,迅速摇动,待冻存液完全溶解后(约1.5 min),用酒精擦拭冻存管外壁,放于超净工作台。吸取细胞悬液至装有5倍体积培养基的离心管中,低速(800 r/min) 离心5 min。弃掉上清液,加1 mL培养基,轻轻将细胞吹打混匀,传代至25 cm2的培养瓶中。标记后,放到37℃、5% CO2饱和浓度的培养箱中孵育,待细胞贴壁后换新鲜培养基。每3天换一次培养基,至细胞生长状态极佳融合时开始实验。
2.4 雷公藤甲素对滑膜细胞的处理
在滑膜细胞生长状态极佳融合时,弃去旧培养液,以PBS液冲洗细胞2次,用0.25%胰酶于室温条件下消化细胞,3 min后,加入2倍体积的培养基终止消化。轻轻吹打细胞,使细胞脱离培养瓶内壁,吸取出细胞悬液至离心管中,低速(800 r/min) 离心5 min。弃上清液,加入2 mL培养基吹打混匀,并进行细胞计数。以PBS液将细胞调整为终密度1×105cell/mL的细胞悬液,接种于24孔板中,置培养箱孵育24 h,使细胞贴壁。
实验分为空白对照组与给药处理组。待细胞完全贴壁后弃掉旧培养基,给药处理组分为4组,分别用含25 μg/mL雷公藤甲素的培养液处理0, 6, 10和24 h。空白对照组加入相同浓度配药所用的DMSO和培养基。然后各实验组均于37℃、5% CO2浓度培养孵育。
2.5 样品的处理方法
2.5.1 细胞外液中雷公藤甲素的处理 取各实验组对数生长期细胞的培养液,以1∶2的体积比加入甲醇涡旋混匀后,离心10 min (14000 r/min ) 以除去蛋白,待上清液氮气吹干后,用50%的甲醇涡旋1 min复溶,离心10 min (14000 r/min ),取上清液进行分析。
2.5.2 细胞内液中雷公藤甲素的处理 吸掉培养液后,每孔加入300 μL裂解液,冰浴裂解1 h,取各实验组裂解后的细胞液,参照“2.5.1项”中细胞外液的处理方法进行操作,然后分析。
3 结果与讨论
3.1 MEEKC分离及工作条件
未涂层毛细管: 60.5 cm×75 μm (有效长度为50 cm);电泳运行缓冲液组成: 1%(w/V)SDS,3%(V/V)正丁醇,1%(V/V)乙酸乙酯,96%(V/V)5 mmol/L硼砂-10 mmol/L磷酸盐溶液, pH 9.0, 超声30 min得到的透明、稳定的微乳液(使用前需过0.22 μm微孔滤膜);运行电压:25 kV;电泳实验操作温度:25℃;检测波长:214 nm,压力进样0.5 psi× 6 s。新的毛细管使用前需要活化,即分别用水、0.1 mol/L HCl、水、0.1 mol/L NaOH、水各冲洗20 min;每次进样前,需用分离缓冲溶液冲洗2 min,每次更换样品时需同时更换新鲜分离缓冲溶液,以保证迁移时间和峰面积的重现性。
在上述条件下,雷公藤甲素标准品的电泳色谱图如图1所示。
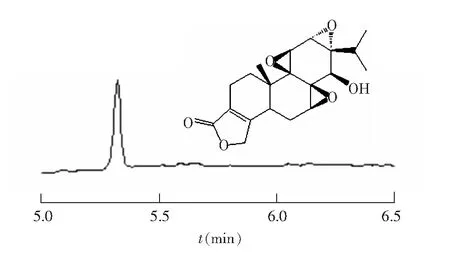
图1 雷公藤甲素结构及其对照品的电泳谱图Fig.1 Structure and electropherogram of standard triptolide
3.2 MEEKC方法特性
3.2.1 线性关系实验 取适量雷公藤甲素对照品溶液用超纯水依次稀释成25, 20, 15, 10, 5和1 μg/mL 的雷公藤甲素标准溶液。按“3.1项”电泳工作条件进行MEEKC分析,以雷公藤甲素浓度为横坐标(x),雷公藤甲素的峰面积为纵坐标(Y),进行线性回归。细胞内液在1.0~15.0 μg/mL范围内线性关系良好,其标准曲线为y=420.95x-156.14(r=0.9995);细胞外液在5.0~25.0 μg/mL范围内线性关系良好,其标准曲线为y=282.83x+261.5(r=0.9991)。
3.2.2 专属性试验 取给药处理组的细胞内液和外液,分别加入适量浓度的雷公藤甲素对照品溶液,按照“2.5项”的样品处理方法操作,并进行MEEKC分析,并与空白对照组样品和给药处理组样品进行比较,结果如图2和图3所示。实验表明,细胞内、外液中内源性物质不干扰目标成分的测定,专属性良好。
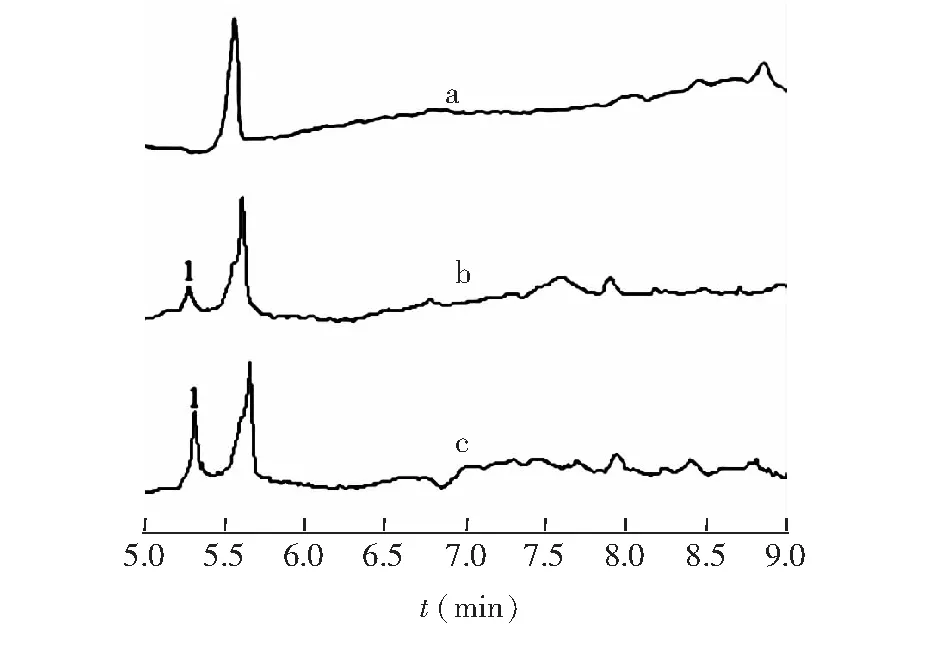
图2 细胞内液样品的电泳谱图(1为雷公藤甲素峰)Fig.2 Electropherogram of intracellular samples (Peak 1 was assigned as triptolide)a: 细胞内液空白样品; b: 细胞内液样品; c: 细胞内液加标样品。a: Control sample; b. Intracellular sample; c. Sample spiked with standard solution.

图3 细胞外液样品的电泳谱图(1为雷公藤甲素峰)Fig.3 Electropherogram of extracellular samples (Peak 1 was assigned as triptolide)d. 细胞外液空白样品;e. 细胞内液样品;f. 细胞内液加标样品。d. Control sample, e. Intracellular sample, f. Sample spiked with standard solutions
3.2.3 精密度实验 取一定浓度的雷公藤甲素标准品溶液,连续进样测定5次,记录峰面积和迁移时间。结果表明,雷公藤甲素峰面积的RSD为3.4%,迁移时间的RSD为1.0%,RSD均小于5%,说明方法的精密度良好。
3.3 细胞内/外液中雷公藤甲素含量的测定
采用MEEKC法分别测定空白对照组和给药处理0, 6, 10和24 h细胞内液、外液样品,以标准加入法定性,其谱图(给药处理24 h)如图2和3所示,细胞内液、外液样品中的雷公藤甲素均可进行定性分析。通过外标法测定细胞内液、外液样品中雷公藤甲素的含量,不同给药时间的细胞外液中雷公藤甲素的含量如表1所示,其浓度与给药时间的关系如图4所示;给药处理24 h细胞内外液样品中雷公藤甲素的含量见表2。
3.4 回收率实验
准确吸取一定浓度的给药处理24 h细胞内、外液样品,分别加入适量的雷公藤甲素标准品溶液,利用已建立的MEEKC方法测定细胞内、外液中雷公藤甲素的峰面积,平行测定3次,根据当天所建立的标准曲线,计算平均回收率,结果如表2所示。
表1 不同给药时间的细胞外液中雷公藤甲素对应的峰面积和含量
Table 1 Peak area and concentration of triptolide of various delivery time in extracellular samples
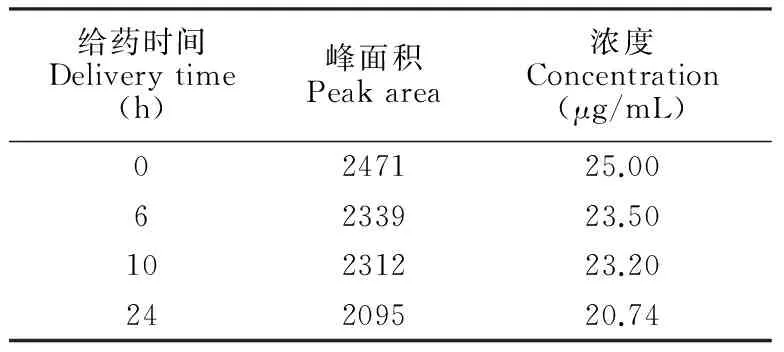
给药时间Deliverytime(h)峰面积Peakarea浓度Concentration(μg/mL)0247125.006233923.5010231223.2024209520.74
表2 细胞内外液样品中雷公藤甲素含量的测定结果
Table 2 Results of triptolide determination in synoviocyte samples

样品Samples(24h)峰面积Peakarea浓度Concentration(μg/mL)回收率Recovery(%,n=3)细胞内液Intracellularsamples3080.736119.0细胞外液Extracellularsamples209520.74103.8
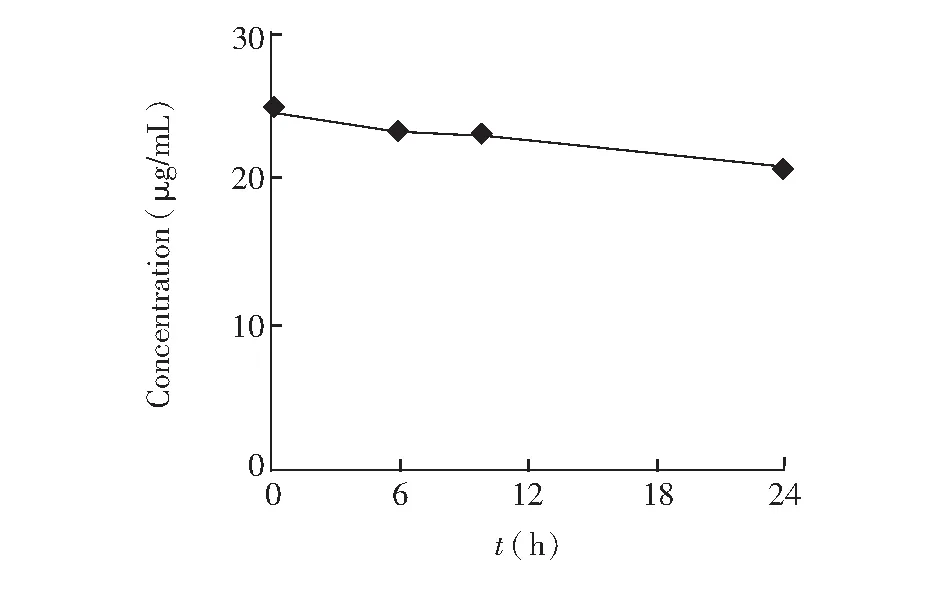
图4 细胞外液中雷公藤甲素浓度与给药时间的关系Fig.4 Relationship of triptolide concentration and delivery time inextracellular samples
3.5 甲醇用量对雷公藤甲素分离的影响讨论
实验发现,复溶雷公藤甲素的甲醇含量直接影响毛细管电泳的检测效果。甲醇百分比含量过高,易造成电泳进样时堵管,基线不稳定,影响测定;甲醇含量太低,则易造成复溶时雷公藤甲素无法全部溶到甲醇溶液中,导致检测成分丧失,影响检测结果。综合上述因素及检测效果,本实验选择50%甲醇溶液复溶雷公藤甲素。
4 结 论
利用微乳液毛细管电动色谱法对大鼠滑膜细胞内外液中的雷公藤甲素进行了定性定量分析。在所建立的分离检测条件下,雷公藤甲素在6 min内出峰,并且出峰稳定。方法学考察表明,本方法重现性好,精密度高,能快速有效地实现目标成分的分离,避免了其它内源性物质的干扰,样品含量测定和回收率结果令人满意,可用于滑膜细胞中雷公藤甲素的药物浓度测定。本方法为测定滑膜细胞中药物代谢过程的残留含量提供方法学基础,其可与其它药理研究方法相互补充,为雷公藤甲素在临床上治疗滑膜炎奠定相关理论基础。
1 ZHANG Qian-De, SHI Yan-Biao, TAN Wen-Feng, WANG Fang.ACTAUniversitatisMedicinalisNanjing(NaturalScience), 2008, 28(7): 902-905
张前德, 时彦标, 谈文峰, 王 芳. 南京医科大学学报(自然科学版), 2008, 28(7): 902-905
2 HE Guan, DENG Xiu-Qin, JIANG Qing.MedicalAestheticsandCosmetology, 2013, (9): 111-113
何 冠, 邓秀琴, 江 庆. 医学美学美容(中旬刊), 2013, (9): 111-113
3 ZHAO Tai-Ping, XU Yu-Dong, ZHU Yong-Jie.GuideofChinaMedicine, 2012, 10(10): 476-477
赵太平, 徐玉东, 朱勇杰. 中国医药指南, 2012, 10(10): 476-477
4 LI Guang-Tao.JournalofChinaTraditionalChineseMedicineInfornation, 2010, 2(35): 69, 94
李广涛. 中国中医药咨讯, 2010, 2(35): 69, 94
5 JIANG Yin-Yan, GUO Li-Juan, CUI Xiao-Ying, WANG Cui-Qiong, HU Xiao-Jian, LI Jian-Ming.JournalofInstrumentalAnalysis, 2015, 34(2): 189-193
蒋银燕, 郭丽娟, 崔小莹, 王翠琼, 胡小建, 李建明. 分析测试学报, 2015, 34(2): 189-193
6 CHEN Jian-Hong, XIA Pei-Yuan, WANG Zhang-Yang, WU Nan, DAI Qing, SUN Feng-Jun, YANG Bo, XIANG Rong-Feng.Chin.Hosp.Pharm.J., 2010, 30(5): 353-356
陈剑鸿, 夏培元, 王章阳, 吴 南, 戴 青, 孙凤军, 杨 波, 向荣凤. 中国医院药学杂志, 2010, 30(5): 353-356
7 ZHANG Ting.ChemicalEngineer, 2011, (11): 25-27
张 婷. 化学工程师, 2011, (11): 25-27
8 LIU Wei-Lin, ZHANG Lin-Jing.ChineseJournalofEthnomedicineandEthnopharmacy, 2012, 21(3): 11-14
刘伟林, 张琳婧. 中国民族民间医药, 2012, 21(3): 11-14
9 Yu L S, Chu K D, Ye H Z, Liu X X, Yu L S, Xu X Q, Chen G N.TRACTrendsAnaly.Chem., 2012, 34: 140-151
10 Suonan Yuzhen.Tibet′sScience&Technology, 2009, (5): 45-49
索南玉珍. 西藏科技, 2009, (5): 45-49
11 Yu L S, Xu X Q, Huang L, Lin J M, Chen G N.J.Chromatogr.A, 2008, 1198-1199: 220-225
12 ZHANG Yu, LI Qin, LU Ming-Hua, ZHANG Lan, CHEN Guo-Nan, CAI Zong-Wei.ChineseJournalofChromatography, 2011, (8): 791-797
张 雨, 李 琴, 卢明华, 张 兰, 陈国南, 蔡宗苇. 色谱, 2011, (8): 791-797
(Received 13 June 2015; accepted 12 September 2015)
This work was supported by the National Natural Science Foundation of China (No.81202913)
Determination of Triptolide in Rat Synoviocytes by Microemulsion Electrokinetic Chromatography
LIN Shi-Yao, CONG Ri-Lin, LI Qi, SUN Zhao-Xia, XU Wei, SHA Mei, YU Li-Shuang*
(CollegeofPharmacy,FujianUniversityofTraditionalChineseMedicine,Fuzhou350122,China)
A method was established for the determination of triptolide in rat synoviocytes by microemulsion electrokinetic chromatography (MEEKC). Synoviocytes were divided into control groups and treatment groups by the different administration time of triptolide, and the concentrations of triptolide in intercellular and extracellular fluid were determined. The determination of triptolide by MEEKC was performed at 25℃ under the conditions including running buffer of 5 mmol/L borate-10 mmol/L phosphate (96%,V/V, pH 9.0) with 1% SDS (w/V), 3% 1-butanol (V/V) and 1% ethyl acetate (V/V), 25 kV of running voltage, 3.45 kPa×6 s of inject pressure and 214 nm of test wavelength. The results showed that triptolide was baseline separation, and there was a good linearity for triptolide in intercellular and extracellular of synoviocytes and the correlation coefficients were 0.9995 and 0.9991, respectively. The concentrations of triptolide in intercellular and extracellular of synoviocytes were 0.736 μg/mL and 20.745 μg/mL, respectively. The present method is simple, accurate, sensitive and precise, and can be used to study dynamic change of the triptolide concentration in rat synoviocytes and provide methodology basis for further study the influence of effective compounds of TCM on synoviocytes' function and activity.
Microemulsion electrokinetic chromatography; Synoviocytes; Triptolide
10.11895/j.issn.0253-3820.150393
本文系由国家自然科学基金项目(No.81202913);福建省科技厅社会发展重点项目(No.2013Y0057)、福建省卫生系统中青年骨干人才培养项目(No.2014-ZQN-JC-27)、福建中医药大学校管科研课题-重点学科专项(No.X2014133-学科)资助
2015-06-13收稿; 2015-09-12接受
* E-mail: sly2018@126.com

