纳豆激酶检测体系的建立及其跨膜转运途径初探*
李敏惠,陈 瑜,蒋玉亮,李 艳,余 赟,毛明星,林定彪,杨亚琼,杨 平△
1.成都医学院 科研实验中心(成都,610083);2.成都医学院 生物医学系(成都,610083);3.成都医学院 基础医学院(成都,610083)
·论 著·
纳豆激酶检测体系的建立及其跨膜转运途径初探*
李敏惠1,陈 瑜2,蒋玉亮2,李 艳2,余 赟3,毛明星2,林定彪2,杨亚琼3,杨 平3△
1.成都医学院 科研实验中心(成都,610083);2.成都医学院 生物医学系(成都,610083);3.成都医学院 基础医学院(成都,610083)
目的 建立纳豆激酶(nattokinase,NK)酶联检测体系,探讨其跨膜转运机制。方法 采用杂交瘤技术筛选抗NK的单克隆抗体,竞争抑制法鉴定单抗识别的抗原表位,Western Blot测定单抗特异性,双抗夹心ELISA法进行单抗灵敏度测定,Caco-2细胞模型探讨NK跨膜转运机制,生物信息学预测NK穿膜相关序列。结果 筛选得到稳定分泌抗体且特异性识别NK的杂交瘤细胞6株,其中3株单抗识别相近的抗原表位,其余单抗识别不同的抗原表位;6株单抗检测NK的最小灵敏度分布为0.78~20.00 ng/mL;Caco-2细胞模型显示,胞吞作用不是NK跨膜转运的主要途径;生物信息学提示,NK中含有3段穿膜相关序列。结论 基于NK单抗建立的酶联检测体系,可有效监控NK跨膜转运过程,NK可能是依据蛋白转导结构域直接介导而实现其肠道吸收转运。
纳豆激酶;单克隆抗体;跨膜转运;蛋白转导结构域
药物在体内的生物利用度与药物胃肠粘膜通透性相关联,蛋白质、肽类等大分子药物因其膜透过性不甚理想,影响其生物利用度,限制了该类药物的应用[1]。此外,很多具有应用前景的药物受到人体内各种天然屏障(如血脑屏障)的限制也难以到达靶器官或靶细胞发挥药效,可见药物的跨膜转运是药理学研究中一个不可忽视的重点[2]。
纳豆激酶(nattokinase,NK)是具有纤溶活性的丝氨酸蛋白酶,对交联纤维蛋白具有高效、特异的水解活性。更为重要的是,NK在胃肠道内稳定,可保留活性经肠道粘膜上皮细胞吸收入血,具有穿越肠绒毛膜屏障的特性[3-4]。作为潜在的溶栓药,NK可降低血栓患者出血风险,口服生物利用度高,具有很好的应用前景[5]。然而,尽管既往研究已明确NK可以经肠道吸收入血,却未对NK穿越肠壁屏障的分子机制进行研究。本研究拟基于NK的单克隆抗体建立检测体系,利用Caco-2细胞模型探讨NK跨膜转运途径,为NK临床药用奠定基础。
1 材料与方法
1.1 实验材料
雌性6~8 w龄BALB/c小鼠及新西兰兔购自四川达硕公司;小鼠骨髓瘤细胞Sp2/0-Ag14、人Caco-2细胞为成都医学院科研实验中心传代保存;弗氏佐剂、胸腺嘧啶核苷(T)、次黄嘌呤(H)、氨基蝶呤(A)、聚乙二醇4000(PEG4000)购自Sigma公司。RPMI 1640及胎牛血清购自GIBCO公司;HRP标记试剂盒(EZ-Link®Plus Activated Peroxidase,31489),抗体亚型鉴定试剂盒(Rapid Isotyping Kit,37503)购自Pierce公司;HRP化学发光底物购自Millipore公司;HRP-Goat anti Mouse IgG抗体购自CST公司;Protein A/G 亲和柱、β-巯基嘧啶亲和柱购自GE公司;NK由成都地奥九泓制药厂提供。
1.2 抗NK鼠杂交瘤细胞的筛选
以2 mL完全弗氏佐剂乳化等体积的NK(NK溶解于PBS,浓度为0.5 mg/mL)作为抗原,以50 μL/只腹腔注射免疫BALB/c小鼠;2 w后,用不完全弗氏佐剂乳化抗原加强免疫;颌下静脉取血,间接ELISA法检测血清免疫效价,当血清效价>1∶105时,抗原直接免疫,3 d后取免疫鼠脾细胞与SP2/0-Ag14细胞在PEG4000介导下融合;融合细胞用间接ELISA法及有限稀释克隆法筛选HAT抗性的阳性杂交瘤细胞。秋水仙素法对杂交瘤细胞进行染色体分析:秋水仙素(0.4 μg/mL)特异破坏纺锤丝而获得中期分裂相细胞;再用0.075 mol/L KCl 溶液等低渗处理,使细胞膨胀,体积增大,染色体松散;经甲醇-冰醋酸溶液固定,即可观察。
1.3 NK兔多抗的制备、纯化及鉴定
以2 mL完全弗氏佐剂乳化等体积的NK(NK溶解于PBS,浓度为0.5 mg/mL)作为抗原,以500 μL/只皮下多点免疫新西兰兔;2 w后加强免疫(不完全弗氏佐剂乳化抗原);耳静脉取血,间接ELISA法检测血清效价;当血清效价>1∶105时,收集血清,Protein A亲和柱纯化IgG抗体;HRP标记试剂盒用于HRP与抗体的偶联,标记兔多抗。
1.4 单克隆抗体的鉴定
1.4.1 抗体亚型鉴定及抗体纯化 杂交瘤细胞扩大培养,培养上清用于抗体鉴定。亚型鉴定试剂盒检测抗体亚型:将抗体稀释液以50 μL/孔加入已包被的酶联板,再加入HRP标记的Goat Anti-Mouse IgG/IgA/IgM,室温1 h,TMB显色,450 nm测定吸光度,判定抗体重链及轻链类型。根据抗体亚型选择纯化体系纯化抗体:IgG用Protein A亲和柱,IgM用β-巯基嘧啶亲和柱纯化。抗体纯化效果以SDS-PAGE电泳检测,检测还原样品时加二硫苏糖醇(DTT)还原。
1.4.2 Western blot检测抗体特异性 以抗原NK做SDS-PAGE电泳,分离胶浓度为15%,转印于PVDF膜,封闭后与检测单抗4 ℃孵育过夜,再加入HRP标记的兔抗鼠二抗,37 ℃孵育2 h,HRP化学发光底物显色、成像。
1.4.3 NK酶联检测体系的建立及单抗检测灵敏度测定 NK双抗夹心酶联体系建立:以表位单抗为包被抗体,加入NK或检测样品,PBS为空白对照,以检测样品Buffer为阴性对照,HRP-兔抗NK的多抗为检测抗体。测定单抗灵敏度时,用表位抗体包被过夜,洗涤、加入倍比稀释的NK,37 ℃孵育2 h,以HRP-兔抗NK的IgG为检测抗体,TMB显色,450 nm测定吸光度。以测定值与对照值之比[(OD样品-OD阴性)/OD阴性]≥2.1时的最大稀释度为NK最小检测灵敏度。
1.4.4 抗体HRP标记及单克隆抗体识别位点的比较 HRP标记试剂盒用于HRP和单抗的偶联,竞争抑制法测定抗体识别位点。NK包被过夜,洗涤,抗体(倍比稀释)与酶标抗体等体积混合,37 ℃孵育,洗涤,TMB显色,测定450 nm的OD值。竞争抑制率=(1-加入竞争抗体孔/对照)×100%。以抗体自身竞争抑制率50%对应的未标记抗体浓度为标准,比较未标记抗体与该酶标抗体竞争时50%抑制率对应的浓度,二者水平越接近说明两者的识别位点越相似甚至相同。
1.5 Caco-2细胞模型构建及鉴定
成熟的Caco-2细胞即可形成与肠上皮细胞相同的细胞极性和致密的单细胞层组织,是研究药物吸收转运机制、预测体内吸收的一个较理想的体外模型,本研究选用Caco-2细胞模型研究NK的转运过程[6]。
1.5.1 建立Caco-2细胞模型 以2×105/mL的密度接种Caco-2细胞于Transwell小室内,加入1 640完全培养基培养。采用激光共聚焦显微镜观察细胞微绒毛结构及细胞间紧密连接情况,确定是否建立Caco-2单细胞层;跨膜电阻(trans-epithelial electrical resistance,TEER)值验证单细胞层的完整性(满足TEER为300~500 Ω/cm2)。
1.5.2 AKP检测Caco-2细胞模型的通透性 碱性磷酸酶AKP是肠上皮细胞的标志性酶,测定刷状缘(apical side,AP)侧和基底(basolateral side,BL)侧的AKP酶活性并加以比较,可作为衡量单细胞层极化程度的指标。分别从Transwell小室的AP侧和BL侧吸取培养液,按照试剂盒(凯基生物KGT043)检测流程,在492 nm处检测并计算出相应的AKP活性,当AP侧的酶活性远大于BL侧时,表明细胞生长已经形成了极性,具有通透性,Caco-2细胞模型可用于药物吸收实验。
1.6 NK转运途径初探
经典理论认为,大分子蛋白保留活性进入细胞,胞吞是主要的途径[7]。我们利用低温条件下,细胞胞吞功能被阻断的特性,在Caco-2细胞模型中,观察NK在4 ℃和37 ℃条件下透过细胞膜的情况,并用酶联检测细胞模型中AP侧和BL侧NK的含量,探讨NK跨膜转移机制。
2 结果
2.1 抗NK单克隆抗体制备及鉴定
BALB/c小鼠经NK免疫后,通过细胞融合及筛选得到稳定分泌抗体的细胞株6株(命名为:C3/G11/F4/A7/H2/E5)。
2.1.1 杂交瘤细胞的染色体分析 6株细胞的染色体数目均在100~120之间,接近脾细胞与骨髓瘤细胞染色体数的总和;细胞大多数为端着丝粒染色体,偶可见中部着丝粒染色体,符合杂交瘤细胞株的特点(图1)。
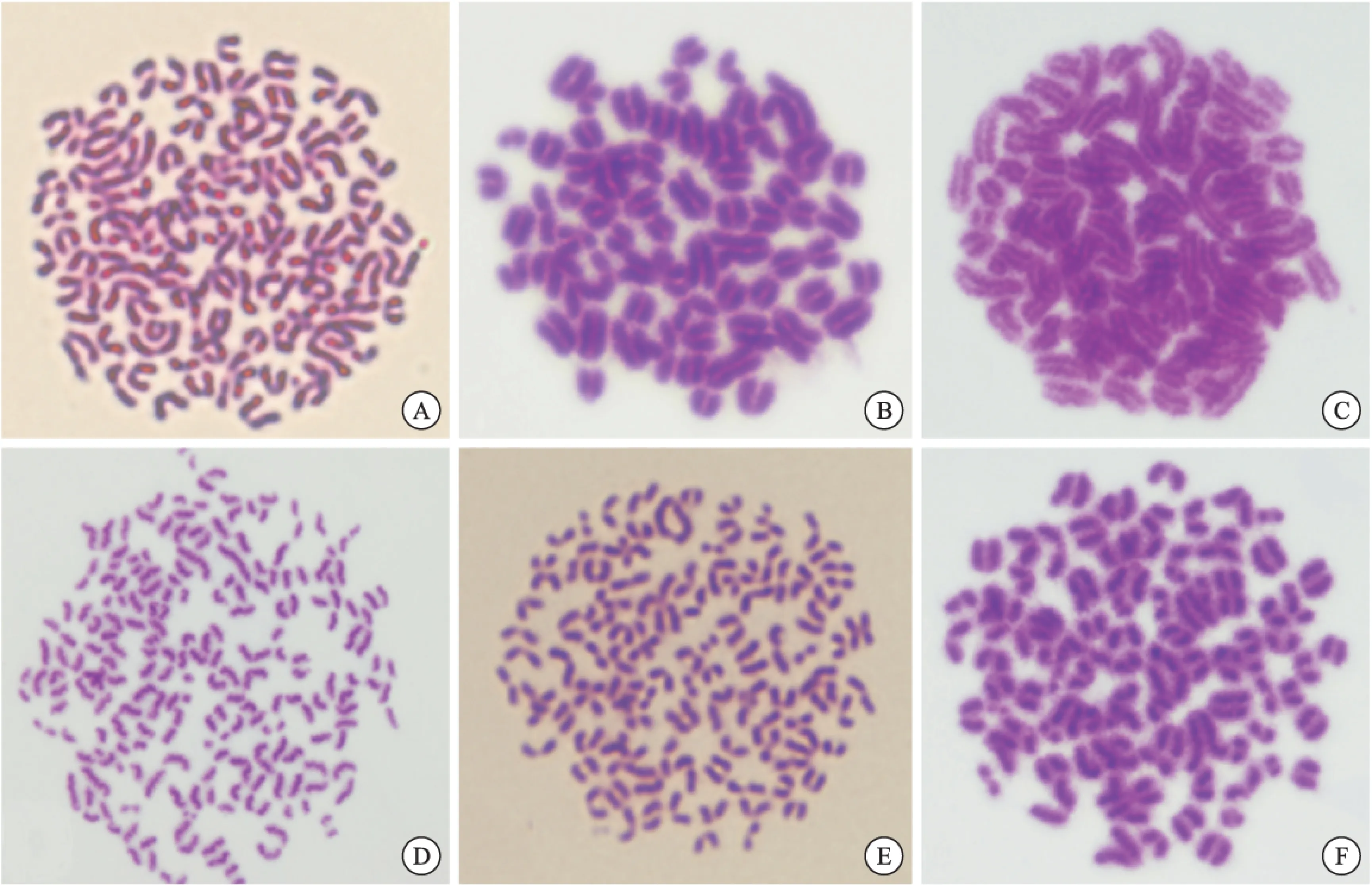
图1 杂交瘤细胞染色体分析
注:A:C3;B:G11;C:F4;D:A7;E:H2;F:E5
2.1.2 单克隆抗体的抗体类型鉴定及抗体纯化 5株单抗的重链是IgG1,1株重链是IgM,轻链均为κ型(表1);根据抗体亚型选择纯化体系纯化抗体,纯化结果如图2所示。
2.1.3 抗体识别表位鉴定 当竞争抑制率为50%时,H2/A7/E5浓度接近,即它们识别的位点相似或相同,而H2/G11/C3/F4在竞争抑制率为50%时的浓度差异均大于400倍,说明它们识别表位不同(图3)。

表1 单克隆抗体亚型鉴定
图2 NK单抗纯度检测
注:A.未还原;B.还原;M: Marker;1:C3;2:G11;3:F4;4:A7;5:H2;6:E5
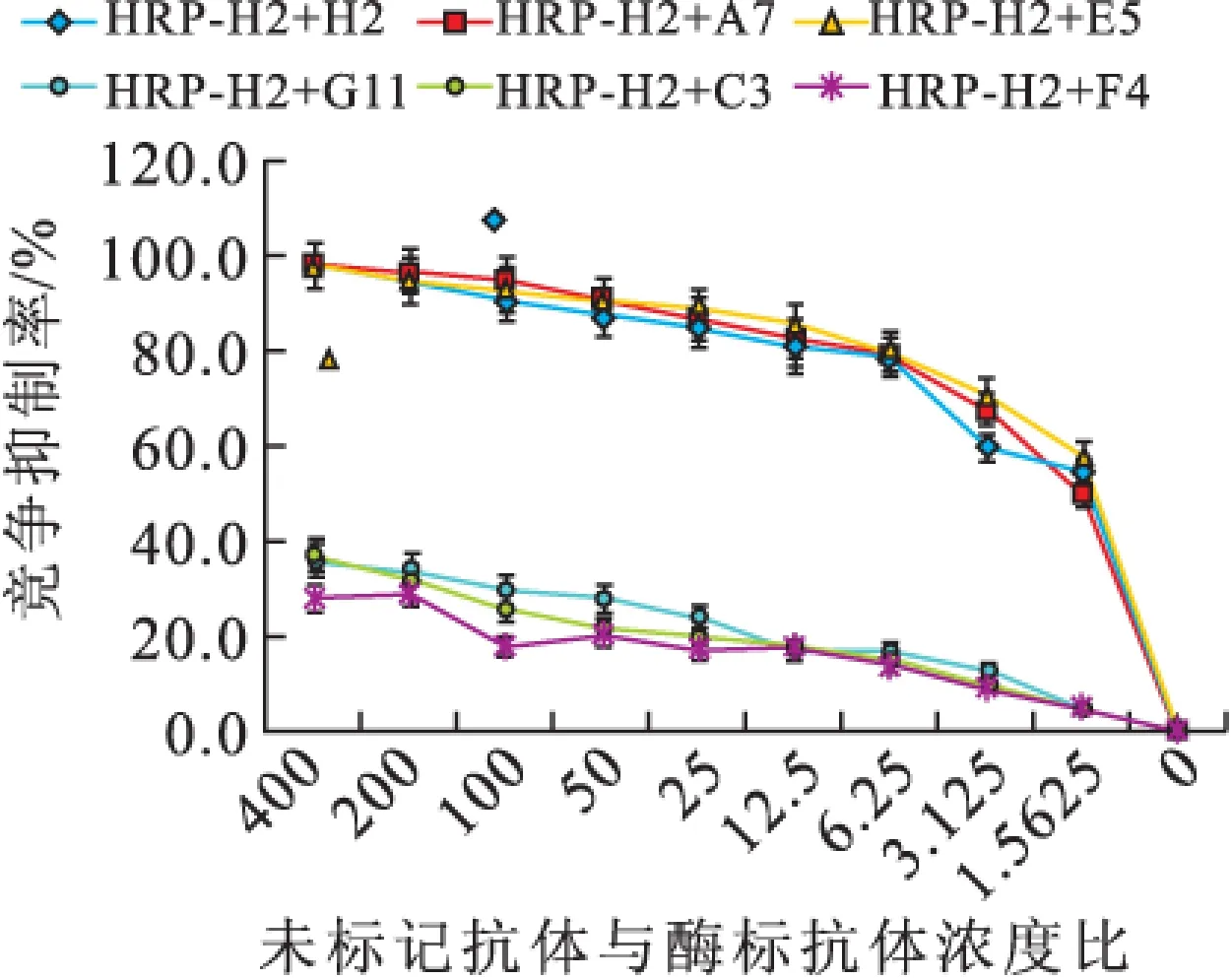
图3-1 未标记单抗对HRP-H2结合NK的竞争抑制(n=3)
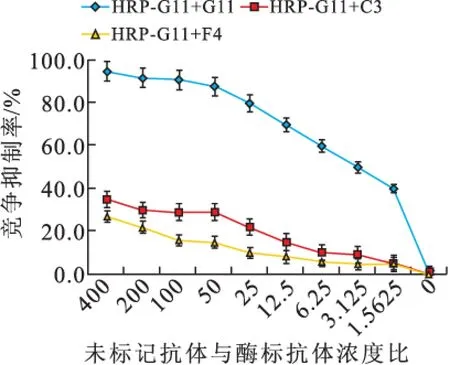
图3-2 未标记单抗对HRP-G11结合NK的竞争抑制(n=3)
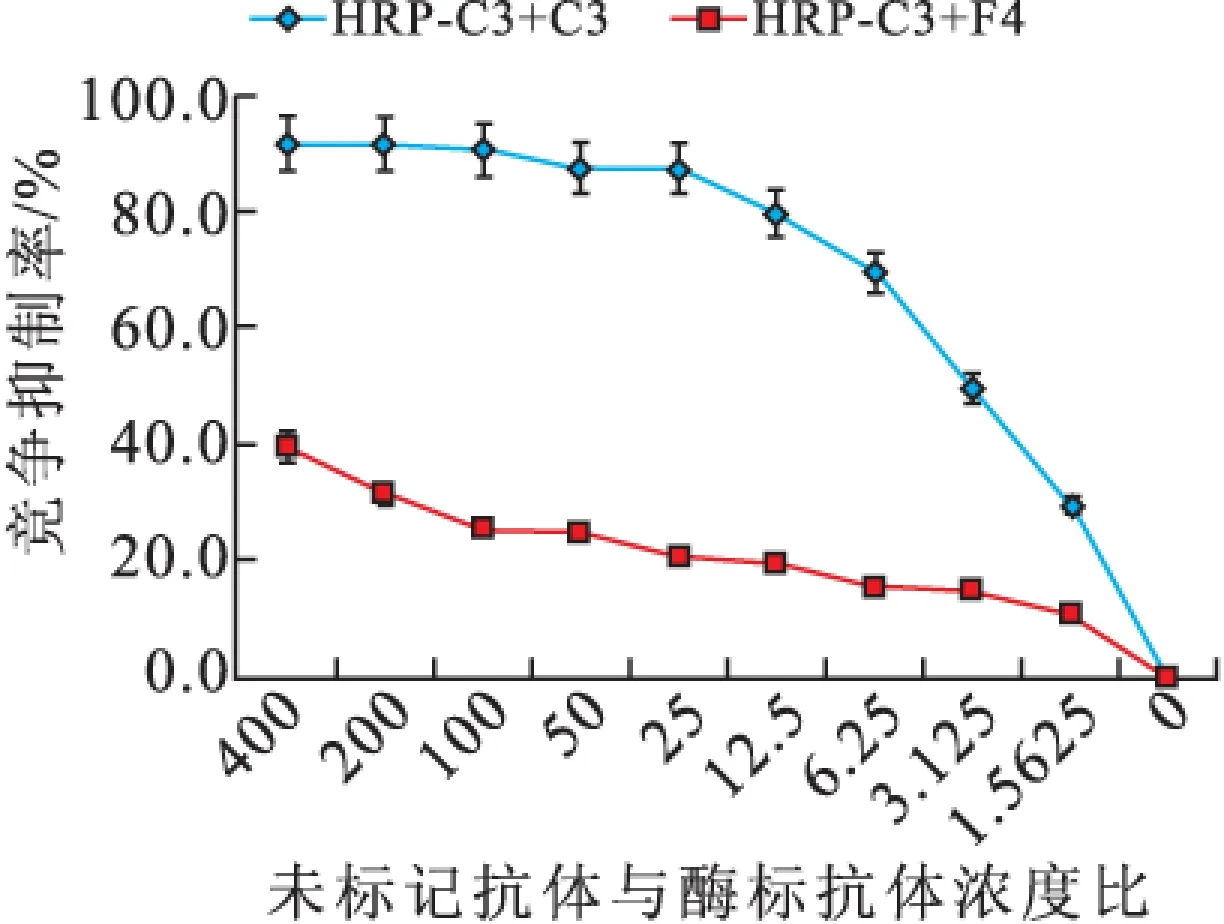
图3-3 未标记单抗对HRP-C3结合NK的竞争抑制(n=3)
2.1.4 Western Blot检测抗体特异性 6株单抗在27.5 KD处都有特异性条带,说明得到的抗体是抗NK的特异性抗体(图4)。
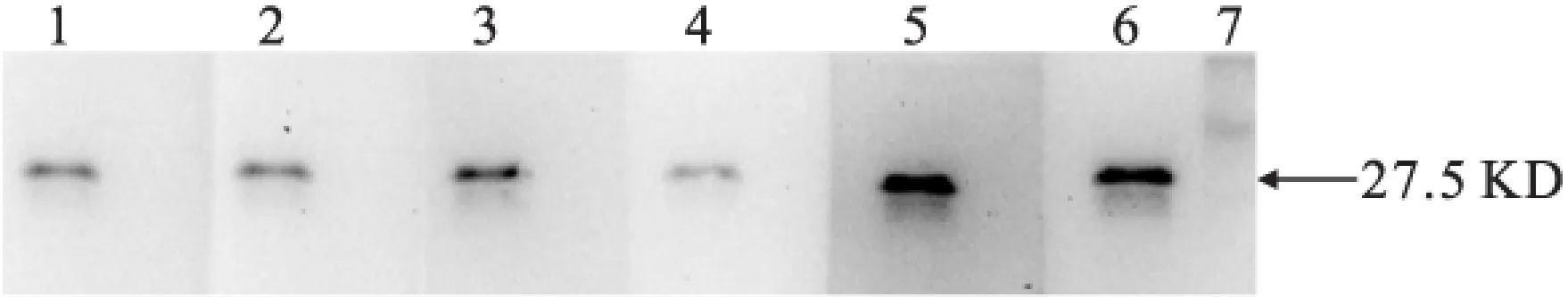
图4 单抗特异性检测
注:泳道1:C3;泳道2:G11;泳道3:F4;泳道4:A7;泳道5:H2;泳道6:E5;泳道7:Marker
2.2 NK酶联检测体系的建立及单抗检测灵敏度测定
6株单抗检测NK的最小灵敏度不同,分布在0.781~20 ng/mL之间,表明建立的酶联体系可以有效检测NK,并监控其跨膜转运过程。
2.3 NK跨膜转运途径初探
Caco-2细胞模型建立后,激光共聚焦显微镜观察细胞微绒毛结构及细胞间紧密连接情况,结果显示,细胞呈“铺路石”状,规则,多边形,排列紧密,紧密连接清晰可见;且跨膜电阻TEER为360 Ω/cm2;提示已形成完整的细胞单层,且细胞膜完整性良好。AKP检测显示AP侧的酶活性远大于BL侧,表明细胞生长已形成极性,具有通透性,可用于模拟小肠粘膜上皮细胞的吸收实验。经典理论认为,大分子蛋白保留活性进入细胞,胞吞是主要的途径。而低温条件下,细胞胞吞功能将被阻断。酶联结果显示,在Caco-2细胞模型中,NK在4 ℃ 和37 ℃都能有效穿透细胞膜屏障;可见,NK肠道吸收过程中胞吞作用不是主要途径。我们推测,NK活性肽段很有可能是通过分子内的蛋白转导结构域(Protein transduction domain,PTD)直接介导而实现其肠道吸收转运。
2.4 NK蛋白转导结构域PTD预测
鉴于PTD在既往大分子蛋白质跨膜转运过程中所发挥的非经典胞吞介导作用[8],我们不禁产生这样的疑问:同样通过非经典胞吞作用实现跨膜转运的NK分子上是否也存在PTD结构域?NK经肠吸收的特性是否也与PTD结构域介导有关?为探究上述问题,课题组对NK分子的结构进行了生物信息学检索和建模工作,借助NCBI、SWISS MODEL、SOFTBERRY等软件对NK的三维构象、功能结构域进行预测,结果显示:NK至少含有3段穿膜相关序列(transmembrane segments),分别位于肽链的第72~94 Aas处、第142~156 Aas处和第225~238 Aas处,长度小于30 Aas,且富含疏水性氨基酸(Ala最多),空间构象多为α螺旋,与穿膜肽的特征相吻合(图5)[9]。
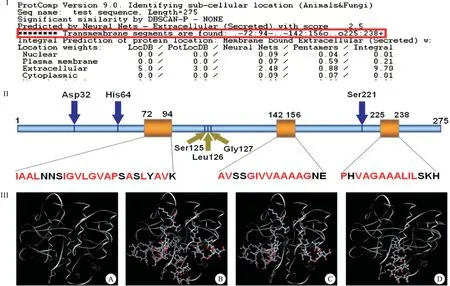
图5 NK穿膜肽段预测及三维结构图
注:I:SOFTBERRY预测结果,框内为穿膜肽段;II:NK结构域示意图,箭头表示催化位点及底物结合位点,框内表示可能的穿膜结构域;III-A:swiss model预测的NK三维预测图;III-B:3个穿膜域;III-C:第1个和第2个穿膜域,III-D:第3个穿膜域(从N端到C端)
3 讨论
细胞穿膜肽(cell-penetrating peptide,CPP)是近年来备受关注的蛋白转导肽,是一种具有跨膜转导功能的PTD,其长度小于30个氨基酸残基,可通过巨胞饮而非经典胞吞作用携带蛋白质、多肽、核酸等大分子物质,通过无受体介导、无耗能的方式,进入哺乳动物细胞,转导效率高且不会造成细胞损伤。利用穿膜肽作为靶向导入载体,将有利于增加蛋白质、肽类等大分子药物的膜透过性,在细胞生物学、基因治疗、药物体内转运、临床药效评价等研究领域,均具有诱人的应用前景[8,10]。
本研究以NK单抗为探针,建立其酶联检测体系,监控Caco-2细胞模型中NK的跨膜转运过程,进而探讨NK独特的跨小肠粘膜吸收机制。研究已证实,NK不以经典胞吞方式跨膜转运,课题组后续研究将着重筛选及证实候选NK分子中PTD 是否具有跨膜转运特性及其携带大分子蛋白进入细胞的能力,并明确NK 的PTD 定位及其穿膜机制,获得来自NK的CPP。
迄今为止,有关CPP成功应用于肽类口服药物载体改造的报道还不多,主要原因在于目前所发现的天然CPP种类和数量还很少,限制了它的选择和应用。追溯天然CPP的研发历程,不难发现,CPP大多是从具有跨膜转导功能的天然蛋白质的蛋白转导结构域PTD中鉴定出来的,如Tat和VP22等[8]。因此,阐明具有转导特性的天然蛋白NK的跨膜转运特性,筛选和鉴定介导蛋白跨膜运输的PTD就成为获得新型穿膜肽的有效手段,为研发以穿膜肽为基础的高性能药物运输新载体奠定基础。
[1]Fasinu P,Pillay V,Ndesendo V M,etal.Diverse approaches for the enhancement of oral drug bioavailability[J].Biopharm Drug Dispos,2011,32(4):185-209.
[2]张志荣,董尔丹,吴镭,等.生物大分子药物递送系统研究现状与前沿方向[J].中国基础科学,2014,16(5):3-8.
[3]Fujita M,Hong K,Ito Y,etal.Transport of nattokinase across the rat intestinal tract[J].Biol Pharm Bull,1995,18(9):1194-1196.
[4]Kamiya S,Hagimori M,Ogasawara M,etal.In vivo evaluation method of the effect of nattokinase on carrageenan-induced tail thrombosis in a rat model[J].Acta Haematol,2010,124(4):218-224.
[5]Dabbagh F,Negahdaripour M,Berenjian A,etal.Nattokinase: production and application[J].Appl Microbiol Biotechnol,2014,98(22):9199-9206.
[6]黄海智,陈健乐,程焕,等.Caco-2细胞模型预测活性物质吸收代谢的研究进展[J].中国食品学报,2015,15(1):164-172.
[7]杨帆,李淑丹.对胞吞和胞吐有关知识的再讨论[J].中学生物教学,2014(10):64.
[8]Kurrikoff K,Gestin M,Langel Ü.Recent in vivo advances in cell-penetrating peptide-assisted drug delivery[J].Expert Opin Drug Deliv,2016,13(3):373-387.
[9]曹赞霞,董川,赵立岭,等.细胞穿膜肽的穿膜活性与序列特征的关系[J].生物化学与生物物理进展,2016,43(1):75-82.
[10] 范博,金明姬,黄伟,等.细胞穿膜肽在药物递送系统中的研究进展[J].药学学报,2016,51(2):264-271.
A Study on the Detection System and Transmembrane Transport Mechanism of Nattokinase
Li Minhui1, Chen Yu2, Jiang Yuliang2, Li Yan2, Yu Yun3, Mao Mingxing2, Lin Dingbiao2, Yang Yaqiong3, Yang Ping3△.
1. Center for Scientific Research, Chengdu Medical College, Chengdu 610083, China; 2. School of Biomedical Sciences, Chengdu Medical College, Chengdu 610083, China;3. School of Basic Medical Sciences, Chengdu Medical College, Chengdu 610083, China
Objective To establish the detection system of nattokinase (NK) and explore its transmembrane transport mechanism. Methods The anti-NK monoclonal antibodies were screened by hybridoma technology. The monoclonal antibody epitopes were identified by competitive inhibition assay. The monoclonal specificity was tested by Western Blot. The monoclonal antibody sensitivities were evaluated by the Sandwich ELISA method. The transmembrane segments of NK were revealed by bioinformatics. Results Six hybridoma cell lines with stable secrete and anti-NK antibodies were obtained, among which three monoclonal antibodies recognize similar antigen epitopes and the others recognize the different antigen epitopes. The minimum detection sensitivity of NK ranged from 0.78 ng/mL to 20.00 ng/mL. Caco-2 cell model results indicated that endocytosis was not the main way of NK transmembrane transport. Bioinformatics showed that NK contained three transmembrane segments. Conclusion The ELISA system for NK based on the monoclonal antibodies could monitor the transmembrane transport process of NK effectively and NK may cause its intestinal absorption with the mediation of the protein transduction domain.
Nattokinase; Monoclonal antibodies; Transmembrane transport; Protein transduction domain
http://www.cnki.net/kcms/detail/51.1705.R.20160613.1051.012.html
10.3969/j.issn.1674-2257.2016.05.003
四川省教育厅项目(No:13ZB0220);四川省科技厅项目(No:2015JY0205);四川省卫生厅项目(No:130302,130298) ;成都医学院科研基金(No:CYZ11-005);国家级大学生创新项目(No:201313705007,201313705003,201413705005)
R977.3
A
△通信作者:杨平,E-mail:920192655@qq.com

