HSP70敲低对AD转基因果蝇的神经保护作用
顾凤鸣 李清华 刘开祥 郭丰宁 陈梅玲 曾爱源
摘要:目的:探讨HSP70敲低(HSP70RNAi)在阿尔茨海默病(AD)发病机制中的作用。方法:利用经典的GAL4/UAS系统,选用ninaE-GAL4启动子,将突变位点在R406W处的Tau蛋白在果蝇复眼内选择性表达,构建ninaE-GAL4/UAS系统AD转基因果蝇模型。然后观察在敲低和不敲低分子伴侣HSP70表达的情况下,HSP70在AD转基因果蝇模型中的作用。结果:HSP70RNAi明显抑制了AD转基因果蝇模型的复眼视网膜光感受神经元变性。结论:HsP70RNAi对AD转基因果蝇模型具有神经保护作用。
关键词:阿尔茨海默病;Tau;HSP70;果蝇
中图分类号:Q969.462.2 文献标志码:A 文章编号:1008—2409(2015)04—0001—04
AD是一种年龄相关的、不断进展的神经退行性突病,以记忆障碍和多重认知损害为特征。随着人类寿命的增长,AD可能成为人类健康的焦点,给个人及家庭带来了负担。AD患者大脑的组织病理学研究表明,突触丢失、线粒体异常和炎性反应是其特征性表现,除此之外还有分布在大脑学习和记忆区的细胞外的淀粉样(AB)蛋白及细胞内TAU蛋白过度磷酸化所致的神经纤维缠结(NFTs)。过度磷酸化的TAU蛋白在AD中更容易聚集,因此,降低这些TAU蛋白的水平成为治疗AD的有期望的途径。TAU蛋白的稳态通常是由分子伴侣来调控,如热休克蛋白70。因其调节TAU蛋白稳态方面潜在的治疗作用,HSP70引起了越来越多研究者的重视。细胞模型中,HSPT0的ATP酶活性抑制剂可以促进TAU蛋白的逆转和恢复它的稳定。第一代HSP70抑制剂,如亚甲蓝(MB),能提高TAU蛋白病小鼠模型的学习和记忆能力。本研究探讨HSP70RNAi对AD的作用,采用遗传干预使HSP70RNAi在ninaE-GAIA/UAS系统的AD转基因果蝇模型视网膜光感受神经元中表达,观察HSP70RNAi对AD转基因果蝇模型是否具有保护作用。
1材料与方法
1.1材料
果蝇品系:w1118、ninaE-GAL4购自美国Bloomington果蝇中心;模型UAS-hTauR406W购自美国哈佛大学;双平衡系果蝇sco/CyO;TM3/TM6由中南大学医学遗传学国家重点实验室惠赠;HSP70RNAi由清华大学惠赠。
1.2方法
1.2.1果蝇杂交
1.2.1.1构建w1118/+;ninaE-GALA/+的果蝇
将w1118的处女蝇与ninaE-GAIA的雄性果蝇杂交,收取F1代,即基因型为wlll8/+;ninaE-GAIA/+的目的果蝇。即正常对照果蝇。
1.2.1.2构建ninaE-GAIA/+;UAS-hTauR406W/+的果蝇将ninaE-GAIA处女蝇与UAS-hTauR406W雄性果蝇杂交即得到ninaE-GAIA/+;UAS-hTauR406W/+果蝇。
1.2.1.3构建HSP70RNAi对AD转基因模型干预的果蝇将ninaE-GAIA处女蝇与sco/CyO;TM3/TM6雄性果蝇杂交,构建基因型为ninaE-GAL4/sco;+/TM3的果蝇;同时将UAS-hTauR406W处女蝇与sco/CyO;TM3/TM6雄性果蝇杂交,构建基因型为+/CyO;UAS-hTauR406W/TM6的果蝇;再将ninaE-GAIA/sco;+/TM3的处女蝇与+/CyO;UAS-hTauR406W/TM6雄性果蝇杂交,筛选卷翅且短刚毛的子代,即基因型为ninaE-GAIA/CyO;UAS-hTauR406W/TM3的目的果蝇。再将HSP70RNAi的处女蝇与ninaE-GAIA/CyO;UAS-hTauR406W/TM3的雄性果蝇杂交,筛选基因型为ninaE-GAIA/+;UAS-hTauR406W/HSP70RNAi的目的果蝇。即ninaE-GAIA/+;UAS-hTauR406W/HSP70RNAi的果蝇。
1.2.2数据采集
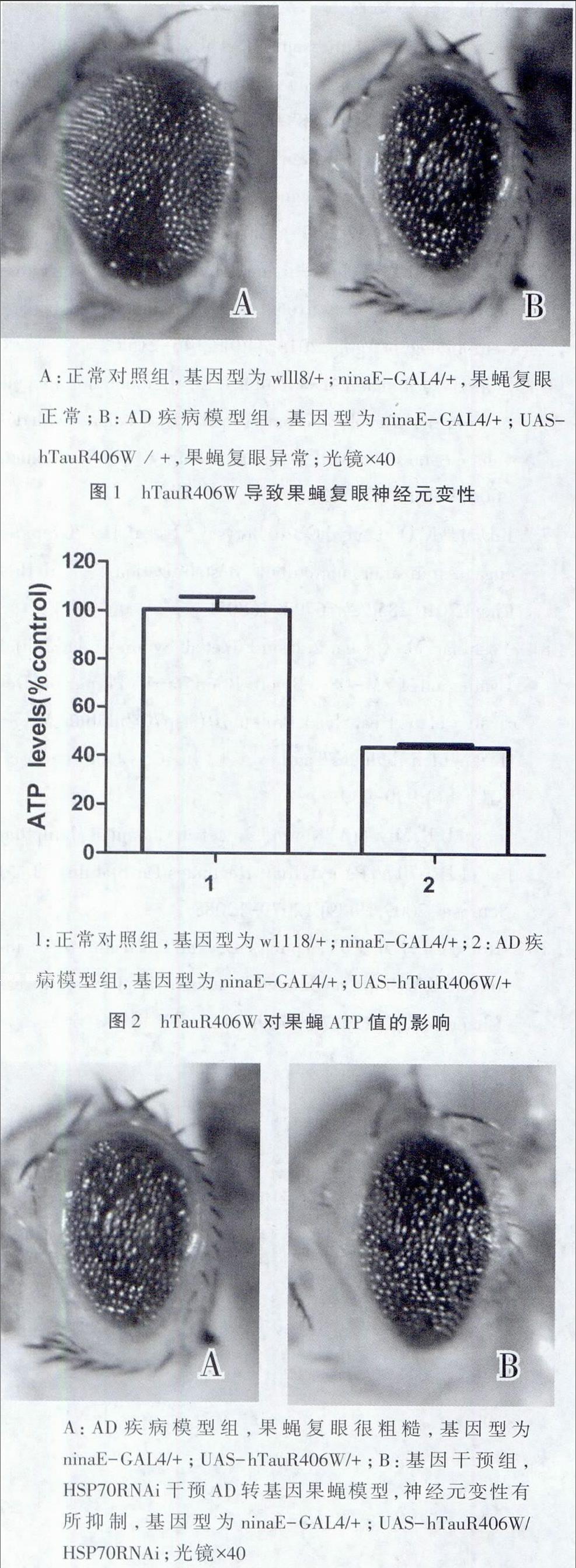
1.2.2.1观察果蝇复眼形态并拍照 用奥林巴斯体视显微镜观察第7天的雄性目的果蝇复眼结构。
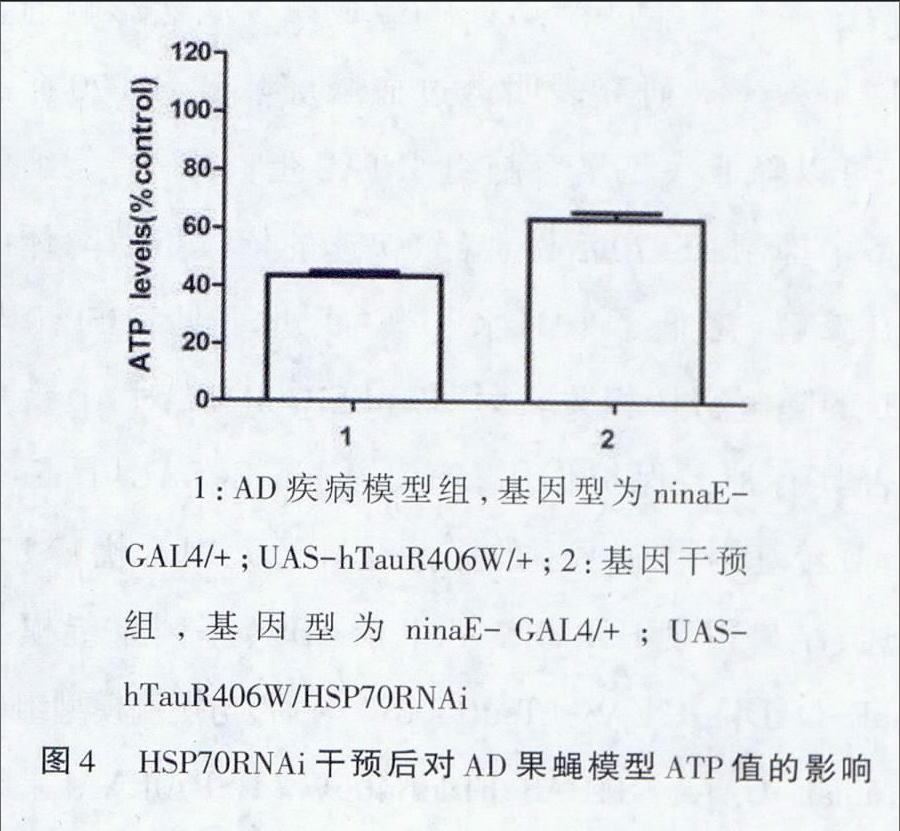
1.2.2.2应用试剂盒检测线粒体三磷酸腺苷(adenosine triphosphate,ATP)浓度取第7天的w1118/+;ninaE-GAL4/+果蝇(正常对照组),ninaE-GAL4/+;UAS-hTauR406W/+果蝇(疾病模组),ninaE-GAL4/+;UAS-hTauR406W/HSP70RNAi果蝇(基因干预组)各10只雄性果蝇,切取果蝇头部;分别将果蝇加入0.1 LATP反应液中进行研磨,充分反应后调离心机转速为10 000 r/min离心15 min,分别取出0.01 L上清液加入96孔板后,再分别加入0.09 LATP反应液;将标准品按一定的浓度梯度稀释,并加入96孔板;室温避光反应15 min后,酶标仪测定OD值;减去本底发光值,制作标准曲线;根据标准曲线计算ATP浓度,计算ATP浓度与正常对照组的百分比。
1.3统计学处理
采用SPSS 18.0统计软件进行分析,用t检验。
2结果
2.1 AD转基因果蝇模型
为鉴定AD转基因果蝇模型,本研究分别从果蝇表型、果蝇ATP分析比较正常对照组与AD转基因果蝇模型。结果显示。AD转基因果蝇模型复眼表面粗糙凹凸不平,面积较正常果蝇明显减小,色素沉着减少。详见图1。AD转基因果蝇模型与正常对照组相比较,其ATP明显降低,t=10.544 P<0.01。详见图2。
2.2 HSP70RNAi对AD转基因果蝇模型的影响
为了探讨HSP70RNAi对AD转基因果蝇模型是否有保护作用,本研究从果蝇表型、果蝇ATP分析HSP70RNAi对AD转基因果蝇模型的影响。结果显示HSP70RNAi对疾病模型干预后,果蝇复眼较疾病组呈现明显的好转,复眼表面光整,复眼面积稍增大,色素沉着加深。详见图3。ATP水平升高,t=-6.653,P<0.01。详见图4。
3讨论
神经元内异常的TAU蛋白在AD的神经变性进程中起到了重要的作用。TAU是微管相关蛋白,可帮助调节神经元微管的稳定性。当TAU蛋白被异常的过度磷酸化,微管与TAU结合减少使微管不稳定,影响轴突运输,导致NTFs聚集。一些研究表明减少TAU蛋白可能有益,而另一些研究表明TAU蛋白的完全丢失有毒性作用。TAU敲除的老鼠在特定的遗传背景下表现正常。但是人类的MAPT(micro-tubule associated protein))基因删除表现出严重的智力低下。这表明在不同的研究背景下,TAU蛋白的量不同,有可能造成截然不同的结果。人类TAU蛋白突变频率最高的位点是R406W,将人类的R406W突变位点转入果蝇,运用ninaE-GAL4启动子,使R406W在果蝇复眼特异性表达,建立了AD模型。
HSP70似乎能从本质上区分功能型TAU、与微管结合的TAU和异常的游离TAU。所有的HSP70变体可以识别游离TAU是因为它的结合位点位于微管结合域。因而当TAU和微管结合,它就和HSP70分离。同时,改变TAU和微管关系的磷酸化位点已被证明影响它与分子伴侣之间的相互作用。尸检AD患者大脑皮层发现HSP70蛋白水平增高,证明HSP70与大脑的患病区域关系密切。
研究显示,多种神经退行性疾病存在能量代谢障碍,在阿尔茨海默病和遗传性脊髓小脑型共济失调等神经退行性疾病中,均发现存在能量代谢障碍。蛋白降解是一个耗能过程,ATP的生成减少必然影响到蛋白降解效率。研究表明透过血脑屏障的HSP70抑制剂,可以降低人工培育脑组织TAU蛋白水平。细胞模型中抑制HSPT0活性,导致快速的依赖蛋白酶体的TAU降解,降低了TAU水平。由此可见,HSP70与TAU的降解密切相关。为明确HSP70RNAi对AD疾病是否具有神经保护作用,笔者在ninaE-GAIA/UAS系统AD转基因果蝇模型的光感受神经元中干扰HSP70表达,结果发现HSP70RNAi干预AD转基因果蝇模型ninaE-GAL4/+:UAS-hTauR406W/+后,与疾病模型组比较,ninaE-GALA/+;UAS-hTauR406W/HSP70RNAi果蝇复眼表面结构较光整,复眼面积稍增大,色素沉着加深,且ATP水平增高。
本研究表明HSP70RNAi可以抑制AD转基因果蝇神经变性,HSP70RNAi对AD转基因果蝇具有神经保护作用。但它的具体保护机制却仍未可知。近年来,关于分子伴侣HSPT0的研究越来越多,除AD外,HSP70还与SCA3/MJD的毒性蛋白ataxin-3有关联。这些研究表明HSP70在神经退行性疾病中起到举足轻重的作用。除作为分子伴侣外,HSP70是否还有其他功能?是杏会启动其他路径来进行蛋白降解?这些都需要进一步验证。总之,本研究发现了HSP70RNAi对AD的神经保护作用。这将为今后的基因及药物治疗提供一个很好的方向。

