姜黄素对软骨细胞氧化应激损伤的保护作用
宋永周 童九辉 马维 关健 苏瑞红 李飞 孙淑芹 王华军
·论著·
姜黄素对软骨细胞氧化应激损伤的保护作用
宋永周 童九辉 马维 关健 苏瑞红 李飞 孙淑芹 王华军
目的 通过建立H2O2诱导软骨细胞损伤模型,观察姜黄素对软骨细胞的保护作用。方法 体外培养SD大鼠关节软骨细胞,随机分为对照组、模型组(H2O2)、姜黄素低中高剂量剂量组(20、40、80 μmol/L)。姜黄素与软骨细胞培养48 h后,加入H2O2,24 h后收集细胞,MTT和流式细胞仪测定细胞增殖能力,测定细胞超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)含量,Real-Time PCR和Western blot法检测细胞Nrf2 mRNA及其蛋白表达水平。结果 与对照组比较,模型组软骨细胞存活率降低,具有分裂象的S期和G2/M期细胞明显减少;SOD、CAT含量降低,MDA含量增加,Nrf2 mRNA及其蛋白表达水平下调。经姜黄素预先处理,软骨细胞存活率升高,细胞增殖能力恢复,SOD、CAT含量升高,MDA含量降低,Nrf2 mRNA及其蛋白表达水平升高。随浓度升高变化更明显。结论 姜黄素对软骨细胞氧化应激损伤有保护作用,可通过增强Nrf2表达实现。
姜黄素;软骨细胞;氧化应激;Nrf2
骨关节炎是一种慢性关节病,以骨质增生、关节软骨破坏变性为特征[1]。研究表明,骨性关节炎的发生及发展与氧化应激关系密切[2]。氧化应激主要是活性氧(ROS)的产生和抗氧化酶降解ROS的能力失衡导致的[3]。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是调控细胞氧化应激的核心转录因子[4],Nrf2通过与胞浆蛋白Kelch样环氧氯丙烷相关蛋白-1(Keap1)以及抗氧化反应原件(ARE)相互作用,启动下游解毒酶和抗氧化酶的表达,从而发挥保护作用。姜黄素是一种来源于姜黄的植物多酚,可以抑制细胞炎性反应和氧化损伤[5,6]。同时Nrf2也是姜黄素作用的重要靶标,激活Nrf2是姜黄素药理作用的重要分子机制[7,8]。本研究利用H2O2诱导软骨细胞氧化应激,同时予以姜黄素干预,探讨姜黄素对软骨细胞氧化应激的保护作用,为姜黄素治疗骨关节炎提供实验依据。
1 材料与方法
1.1 实验材料 姜黄素、DMSO购自sigma公司;胰蛋白酶(Sigma公司),胶原酶NB4(德国Serva公司),DMEM培养基购自HyClone公司;过氧化氢酶(CAT)、丙二醛(MDA)、超氧化物歧化(SOD)测定试剂盒为南京建成生物工程研究所产品;胎牛血清(FBS)购自浙江四季青公司;Real-Time PCR试剂盒产自日本Takara公司;BCA试剂盒购自碧云天生物技术研究所;兔抗大鼠Nrf2单克隆抗体购自美国Abcam公司;FITC标记的山羊抗兔IgG抗体购自美国Jackson Immuno Research公司),Ⅱ型胶原单克隆抗体购自NeoMarker公司。
1.2 方法
1.2.1 软骨细胞的培养:参考此前的方法[9]:将新生1周SD大鼠脱颈处死,无菌条件下切取双侧髋膝关节软骨,放入培养皿,L-DMEM漂洗,用眼科剪将软骨组织剪碎至1 mm3小块,再次漂洗。胶原酶NB4(0.3 U/ml) 37℃消化4 h,1 000 r/min离心5 min,弃上清液,加入含10%胎牛血清、双抗(青霉素100 U/ml、链霉素100 U/ml)的L-DMEM培养基,以1×105/ml接种于培养瓶,置于CO2培养箱中培养(温度37℃,饱和湿度,5%CO2)。每2~3天换液1次。倒置显微镜下观察细胞生长情况。当倒置显微镜下观察软骨细胞汇合成片长满大部分培养瓶壁后,倾去培养液,加入0.25胰蛋白酶+0.02%乙二胺四乙酸进行传代培养。甲苯胺蓝染色及SABC法Ⅱ型胶原免疫组织化学染色证实培养细胞为软骨细胞。采用2~3代软骨细胞进行下一步实验。
1.2.2 H2O2及姜黄素处理:实验分为5组:对照组,H2O2模型组,姜黄素低、中、高剂量组(20、40、80 μmol/L)。细胞传代铺于培养瓶中,细胞贴壁后轻吸去培养液,对照组和模型组使用正常培养液,而低、中、高剂量组分别加入20、40、80 μmol/L的姜黄素培养液培养。48 h后吸去培养液,除对照组外均用0.1 mmol/L的H2O2进行处理,24 h后收集细胞进行检测。
1.3 观察指标
1.3.1 细胞MTT测定:将所培养的软骨细胞以1×107/L,100 μl接种于96孔板中。24 h后待细胞贴壁,吸去培养液,按上述方法进行处理后,每组加入50 μl MTT(5 mg/ml),5%CO2,37℃孵育4 h,吸去上清液,每孔加入DMSO 200 μl,振荡10 min后,于酶标仪上570 nm处测定每孔细胞吸光度(A)。细胞存活率按下列公式计算:细胞存活率=用药组A/正常对照组A×100%。
1.3.2 SOD、MDA、CAT测定:细胞经处理后,弃去培养液,PBS洗2次,胰蛋白酶消化,4℃、1 000 r/min离心,4℃超声波细胞粉碎机上破碎细胞,取裂解液4℃、1 000 r/min离心10 min后取上清检测。BCA试剂盒定量,按试剂盒说明书进行SOD、MDA和CAT含量测定。
1.3.3 测定Nrf2 mRNA及其蛋白表达水平:采用Real-time PCR法检测软骨细胞Nrf2的mRNA表达,目的基因的上游引物为上游5’-TTCCTCTGCTGCCATTAGTCAGTC-3’,下游引物为5'-GCTCTTCCATTTCCGAGTCACTG-3’,扩增产物大小为215 bp[10],β-actin作为内参基因。收集培养细胞,抽提总RNA,测定RNA 纯度,并逆转录合成cDNA第1链后进行PCR,用AB 7500型荧光定量PCR仪,扩增程序为:94℃变性3 min,94℃ 30 s,57℃ 30 s,72℃ 30 s,循环35次,最后一轮72℃延伸10 min。采用2-ΔΔCT法计算其表达量相对值,目的基因mRNA的相对表达量以同一反应体系中实验组的荧光定量指数与对照组的比值表示。
1.3.4 Nrf2的蛋白表达水平测定:采用Western blot法检测。处理过的软骨细胞以PBS清洗3次,加入预冷的裂解缓冲液,超声至组织完全碎裂,14 000 r/min,在4℃的冰冻环境下离心后收集上清液,BCA法测定蛋白浓度。蛋白变性后上样,经蛋白分离及膜。分别采用封闭一抗(兔抗大鼠Nrf2单克隆抗体)和荧光二抗(FITC标记的山羊抗兔IgG抗体),扫描记录各条带的积分光密度值(IOD)。以β-actin作为内参照。
1.3.5 流式细胞仪测定细胞周期和增殖指数测定:5组待测细胞以胰蛋白酶消化后,收集细胞,1 000 r/min离心5 min,后弃上清,以冷PBS清洗细胞3次,离心去上清。70%预冷乙醇固定,4℃过夜。离心,弃去乙醇上清,加入预冷的PBS洗涤,离心弃上清。1 ml冷PBS重悬细胞,RNase(10 μg/ml)37℃孵育30 min,加入碘化丙啶(PI,50 μg/ml)染色5 min后进行检测。增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
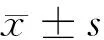
2 结果
2.1 细胞培养观察检测 倒置显微镜下观察,分离培养的原代软骨细胞呈圆球形,24~48 h大部分贴壁伸展,72 h大部分贴壁,分裂增殖加快。培养的软骨细胞胞浆丰富,胞核清晰,有1~2个核仁,约7 d左右汇合成单层铺满整个培养皿底面。经甲苯胺蓝染色后,细胞质染成浅蓝色,细胞核染成深蓝色,清晰可见1~2个核仁。Ⅱ型胶原免疫组织化学染色,胞浆被染成棕黄色,细胞相互接触少的地方棕色较淡,细胞密集生长的地方棕色较深,并且细胞外也可见到棕色。说明在培养的软骨细胞和细胞外基质中有Ⅱ型胶原表达说明培养的细胞具有软骨细胞的特征[9]。见图1。


第二代软骨细胞形态(倒置显微镜×100)甲苯胺蓝染色×200Ⅱ型胶原免疫组化染色阳性×200
图1 软骨细胞培养观察
2.2 姜黄素对H2O2损伤的软骨细胞存活率的影响 模型组与对照组比较,软骨细胞存活率明显降低(P<0.01),经用姜黄素中、高剂量预先处理后,与模型组比较,明显提高了软骨细胞的存活率(P<0.05或P<0.01)。见表1。
2.3 姜黄素对H2O2损伤的软骨细胞SOD、MDA、CAT的影响 H2O2模型组与对照组比较,SOD、CAT活性降低,MDA含量增加(P<0.01),而姜黄素中、高剂量组与模型组比较,SOD、CAT活性增强,MDA含量降低(P<0.05或P<0.01),提示该药可减少H2O2造成的氧化应激损伤。见表1。
表1 姜黄素对H2O2损伤的软骨细胞存活率及SOD、MDA、CAT的影响


组别浓度(μmol/L)存活率(%)SOD(U·mg-1·prot-1)MDA(μmol·g-1·prot-1)CAT(U·mg-1·prot-1)对照组-101.08±7.2532.12±3.499.95±1.4125.40±2.73模型组-52.74±7.31*19.46±2.58*19.48±1.05*8.62±1.88*姜黄素2060.40±2.9018.35±1.2718.30±0.928.42±2.084075.76±3.24#23.59±2.38#16.82±1.12#12.80±1.82#8087.07±2.51△23.90±1.37△13.82±1.15△17.88±2.04△
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01
2.4 Nrf2 mRNA及其蛋白表达水平 H2O2模型组与对照组比较,Nrf2 mRNA及其蛋白表达水平均明显降低(P<0.01),姜黄素中、高剂量与模型组比较,Nrf2 mRNA及其蛋白表达水平均明显升高(P<0.05或P<0.01),提示姜黄素可以促进Nrf2的表达。见图2,表2。

图2 姜黄素对H2O2损伤的软骨细胞的Nrf2蛋白表达的影响
注:1.对照组;2.H2O2模型组;3.姜黄素20 μmol/L组;4.姜黄素40 μmol/L组;5.姜黄素80 μmol/L组
2.5 流式细胞仪检测结果 对照组为正常培养软骨细胞,增殖能力旺盛,细胞PI达18%;模型组为经过H2O2处理的软骨细胞,PI明显低于正常细胞,仅为8%,具有分裂象的S期和G2/M期细胞明显减少;姜黄素低、中、高剂量与模型组比较,S期和G2/M期细胞明显增多,PI明显高于模型组,细胞增殖能力恢复,呈剂量依赖趋势。见表3。
3 讨论
在骨关节炎发病机制中,氧化应激及氧自由基成为近年来的研究热点,可能对骨关节炎的发病起重要作用[2]。在正常情况下,人体内有过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化物酶等抗氧化酶系统,可以清除自由基,保证其清除与生成处于动态平衡。当细胞内自由基生成增加,超出机体的清除能力,导致氧化系统和抗氧化系统失衡,可致细胞氧化损伤甚至凋亡坏死。H2O2是ROS的主要成分,具有稳定、可自由弥散、无电荷等特点,能自由穿过细胞膜,与铁离子反应产生羟自由基,进而引起一系列损伤。因此H2O2常被作为体外诱导细胞氧化应激模型的阳性对照[11]。MDA是细胞生物膜上的不饱和脂质被氧化后形成的代谢产物,所以培养液中MDA的水平可以间接反映软骨细胞氧化应激损伤的程度[12-14]。内源性抗氧化物酶SOD、CAT等构成机体抗氧化防御系统的第一道防线,这些抗氧化酶可以通过清除机体内过量的ROS,使机体维持平衡状态。这些内源性抗氧化酶活力的高低反映机体清除氧自由基的能力。本实验结果显示:通过向培养的软骨细胞培养液中加入H2O2,造成氧化应激模型,软骨细胞存活率明显下降,SOD、CAT活性降低,MDA含量增加,流式细胞仪检测结果表明具有分裂象的S期和G2/M期细胞明显减少,表明细胞受到了氧化应激损伤。经姜黄素预先处理后,SOD、CAT活性增强,MDA含量降低,S期和G2/M期细胞明显增多,细胞增殖能力恢复,提示姜黄素可能通过清除ROS,保持软骨细胞膜的完整性,对H2O2损伤的软骨细胞有保护作用。
表2 姜黄素对H2O2损伤的Nrf2 mRNA及蛋白表达的影响


组别浓度(μmol/L)Nrf2mRNANrf2蛋白表达水平对照组-1.98±0.351.65±0.14模型组-0.46±0.11*0.23±0.11*姜黄素201.01±0.190.52±0.10401.25±0.21#1.01±0.16#801.62±0.09△1.30±0.12△
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01
表3 姜黄素对H2O2损伤的软骨细胞周期分布及增殖指数的影响


组别浓度(μmol/L)G0/G1SG2/MPI对照组-83±2.9112.4±0.345.9±0.430.18±0.01*模型组-88±4.743.8±0.673.9±0.190.08±0.01姜黄素2091±2.404.6±0.625.7±0.970.10±0.01*4088±2.157.1±0.927.1±0.640.14±0.11*8088±0.9438.7±0.578.8±0.440.17±0.01*
注:与模型组比较,*P<0.01
Nrf2是核转录因子,在细胞抗氧化应激反应中起着重要作用[4]。生理状态下,Nrf2位于细胞质中与Kelch样环氧氯丙烷相关蛋白-1(Keapl)处于结合态;当细胞遭受氧化应激损伤时,Nrf2与Keapl解离,进而转移入核,与抗氧化反应元件结合,启动下游抗氧化酶的表达[15]。
从姜黄属植物姜黄、莪术、菖蒲等根茎中提取的橙黄色酸性酚类物质为姜黄素,有多种生物活性,包括痛经止痛,散风活血等。研究表明,姜黄素具有抗动脉粥样硬化及降血脂及抗氧化、抗肿瘤等作用,而且其毒性低,具有良好的临床应用潜力。最近研究表明,Nrf2是姜黄素作用的重要靶标[16],可以诱导Nrf2 与Keap1 的解离并转移入核,激活下游抗氧化酶的合成,从而降低细胞内氧化应激水平[17]。姜黄素可以抑制多种炎性因子的分泌,保护软骨细胞,延缓软骨退变[18-20]。通过检测Nrf2-ARE信号通路下游产物MDA、CAT、SOD的变化,以及Nrf2mRNA及蛋白表达,可提示姜黄素保护软骨细胞减轻氧化应激损伤过程中是否有Nrf2-ARE信号通路参与。在本实验中发现,经姜黄素预先处理的软骨细胞,存活率提高,增殖指数升高,Nrf2mRNA及蛋白表达增高,MDA含量减少,SOD、CAT活性升高,说明Nrf2-ARE信号通路参与了此过程。
本实验通过分离大鼠的关节软骨,通过胶原酶消化法可获得足量软骨细胞,且具有高纯度、高活性特点。培养的细胞经甲苯胺类染色和Ⅱ型胶原免疫组织化学染色证实是纯化的软骨细胞。胶原酶消化法培养的细胞具有生长速度快、研究周期短的特点,完全满足实验的要求。
综上所述,姜黄素可能通过激活Nrf2转运入核,启动下游抗氧化酶的表达,进而抑制H2O2等氧自由基引起的氧化应激损伤,对软骨细胞具有保护作用。
1 Valdes AM,Spector TD.The genetic epidemiology of osteoarthritis.Curr Opin Rheumatol,2010,22:139-143.
2 Afonso V,Champy R,Mitrovic D,et al.Reactive oxygen species and superoxide dismutases:role in joint deseases.Joint Bone Spine,2007,74:324-329.
3 Lee JW,Davis JM.Future applications of antioxidants in premature infants.Curt Opin ediatr,2011,23:161-166.
4 Que LL,Wang HX,Cao BS,et al.The regulation and functions of transcription factor Nrf2 in cancer chemoprevention and chemoresistance.J Chin Pharm Sci,2011,20:5-19.
5 Phillips J,Moore-Medlin T,Sonavane K,et al.Curcumininhibits UV radiation-induced skin cancer in SKH-1 mice.Otolaryngol Head Neck Surg,2013,148:797-803.
6 孙宗建,何琨,张东,等.姜黄素预先给药对兔呼吸机相关性肺损伤时Nrf2蛋白表达的影响.中华麻醉学杂志,2014,34:237-240.
7 Shishodia S,Singh T,Chaturvedi MM.Modulation oftranscriptionfactors bycurcumin.Adv Exp Med Biol,2007,595:127-148.
8 梁莉,阙琳玲,曹宝山,等.Nrf2在姜黄素保护UVB所致细胞氧化损伤中的作用.中华放射医学与防护杂志,2014,34:583-587.
9 宋永周,崔慧先,吕哲,等.大鼠关节软骨细胞的培养.河北医科大学学报,2008,29:534-536.
10 郑海燕,洪远,陈高.Nrf2-ARE在大鼠创伤性脑损伤模型中的表达及意义.中华神经外科杂志,2013,29:80-84.
11 Shim JH,Kim KH,Cho YS,et al.Protective effect of oxidative stress in HaCaT keratinocytes expressing E7 oncogene.Amino Acids,2008,34:135-141.
12 Tetik S,Ahmad S,Alturfan AA,et al.Determination of oxidant stress in plasma of rheumatoid arthritis and primary osteoarthritis patients.Indian J Biochem Biophys,2012,47:353-358.
13 Scott JL,Gabrielides C,Davidson RK,et al.Superoxide dismutase downregulation in osteoarthritis progression and end-stage disease.Ann Rheum Dis,2010,69:1502-1510.
14 Olszewska-Sonina DM,Matewski D,Drewa G,et al.Oxidative equilibriuminthe prophylaxis of degenerativejoint changes: an analy-sis of pre-and postoperative activity of antioxidant enzymes in patients with hip and knee osteoarthritls.Med Sci Monit,2010,16:CR238-245.
15 McMahon M,Thomas N,Hoh K,et al.Dimerization of substrate adaptors can facilitate cullin-mediated ubiquitylation of proteins by a “tethering” mechanism:a two-site interaction model for the Nrf2-Keapl complex.J Biol Chem,2006,281:24756-24768.
16 Johnson JA,Johnson DA,Kraft AD,et al.The Nrf2-ARE pathway:an indicator and modulator of oxidative stress in neurodegeneration.Ann N Y Acad Sci,2008,1147:61-69.
17 Rahman I.Antioxidant therapeutic advances in COPD.Ther Adv Respir Dis,2008,2:351-374.
18 Jagetia GC,Aggarwal BB.“Spicing up”of the immune system by curcumin.J Clin Immuno,2007,27:19.
19 Epstein J,Sanderson IR,MacDonald TT.Curcumin as a thempeutic agent:the evidence from in vitro,animal and human studies.Br J Nutr,2010,103:1545-1557.
20 陈琼,赵明才,陈摇,等.姜黄素对骨关节炎软骨细胞增殖及分泌MMP-13,IL-6的影响.现代中西医结合杂志,2013,22:271-275.
Protective effects of curcumin on oxidative stress injury of chondrocytes of rats in vitro
SONGYongzhou,TONGJiuhui,MAWei,etal.
DepartmentofOsteology,TheSecongHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
Objective To observe the protective effects of curcumin on chondrocytes through setting up the models of chondrocytes injury of rats in vitro induced by H2O2.Methods The articular chondrocytes of SD rats were prepared and cultured in vitro,which were randomly divided into five groups:control group, model group (H2O2), low-dose curcumin group (20μmol/L),median-dose curcumin group (40μmol/L) and high-dose curcumin group (80μmol/L). On 48 hours after the articular chondrocytes were cultured in culture medium with curcumin, H2O2was added into the culture medium and co-cultured for 24 hous,then the articular chondrocytes were collected. The cell proliferation ability and the contents of superoxide dismutase (SOD),malondialdehyde (MDA),catalase (CAT) were detected by MTT assay and flow cytometry,respectively. The expression levels of Nrf2 mRNA and protein were detected by Real-time PCR and Western Blot,respectively.Results As compared with those in control group,the survival rates of chondrocytes in model group were decreased,and the numbers of chondrocytes with mitotic figure in stage S and G2/M were obviously decreased.The contents of SOD and CAT were decreased,however,the levels of MDA were increased. The expression levels of Nrf2 mRNA and protein were down-regulated.After the chondrocytes were pretreated by curcumin, the survival rates of chondrocytes were increased,the cell proliferation ability was improved,and the contents of SOD and CAT were increased,however,the levels of MDA were decreased. The expression levels of Nrf2 mRNA and protein were increased with the increase of concentration of curcumin.Conclusion The curcumin has protective effects on oxidative stress injury of chondrocytes by increasing the expression levels of Nrf2.
curcumin; chondrocytes; oxidative stress; Nrf2
10.3969/j.issn.1002-7386.2016.23.001
项目来源:河北省医学科学研究重点课题(编号:20150666);中国博士后科学基金资助项目(编号:2015M582480);广东省自然科学基金项目(编号:2016A030313100)
050000 石家庄市,河北医科大学第二医院骨科(宋永周、童九辉、马维);河北省石家庄市第三医院(关健、苏瑞红);河北省定州市人民医院CT核磁科(李飞、孙淑芹);暨南大学附属第一医院骨关节外科(王华军)
关健,050011 河北省石家庄市第三医院关节外科;
E-mail:467999223@qq.com
R 68
A
1002-7386(2016)23-3525-04
2016-09-02)

