鹿茸胶原多肽复合酶水解工艺研究
李 冰,李 梁,王露露,董思敏,黄宝亮,张 晶
(吉林农业大学 中药材学院,吉林 长春 130118)
鹿茸胶原多肽复合酶水解工艺研究
李 冰,李 梁,王露露,董思敏,黄宝亮,张 晶
(吉林农业大学 中药材学院,吉林 长春 130118)
【目的】 对鹿茸胶原多肽进行复合酶水解,优化水解工艺,并测定水解液分子量分布。【方法】 以碱性蛋白酶和胰蛋白酶为供试酶类,选用酶解时间、pH值、酶解温度、加酶量为影响因素,采用响应面试验设计优化单酶水解条件,根据响应面试验所得到的单酶水解的最适条件,确定双酶复合水解方案。通过 Sephadex G25测定鹿茸胶原多肽的分子量分布。【结果】 碱性蛋白酶最优水解条件为:酶解时间3.6 h,pH值10.50,酶解温度55 ℃,加酶量4%,水解液的水解度为22.03%;胰蛋白酶最优水解条件为:酶解时间3.2 h,pH值8.00,酶解温度50 ℃,加酶量 4.4%,水解液的水解度为15.81%。复合酶水解条件:酶解温度为52.5 ℃,调节pH值为10.50,加入4%的碱性蛋白酶酶解3.6 h;调节pH值至8.00,加入4.4%的胰蛋白酶酶解3.2 h,所得水解液的水解度可达33.42%。复合酶水解胶原多肽的分子量分布在400~1 400 u。【结论】 确定了鹿茸胶原多肽碱性蛋白酶和胰蛋白酶复合水解的工艺条件。
鹿茸;响应面试验;复合酶水解;胶原多肽
鹿茸是鹿科动物雄性梅花鹿(CervusnipponTemminck)或马鹿(CervuselaphusL.)未骨化密生绒毛的幼角[1]。《神农本草经》中记载鹿茸“味甘、性温、主漏下恶血,寒热惊痢,益气强志,生齿不老”[2]。通过对多种品系鹿茸中化学成分的分析发现,鹿茸中粗蛋白质含量占干质量的50%以上,而其中胶原蛋白则为含量最高的蛋白质[3-4]。胶原蛋白起着支撑器官、保护机体的功能,具有很强的生物活性和生物功能[5],但胶原蛋白分子质量为300 ku,不溶于水,不易被人体吸收利用[6]。胶原多肽是胶原蛋白的水解产物,其进入人体后,可直接被肠道吸收,在提高机体免疫力、增强抗病能力、维护健康方面有显著的功效[7-9]。胶原多肽因具有保湿、抗氧化和抗衰老等功效[10-12],已被广泛地应用于医药、化妆品、保健品等高附加值多肽产品中[13]。由于蛋白酶对肽键作用具有专一性,在单酶水解时,只能从几个固定的氨基酸残基处进行水解,水解程度受到限制。为了得到分子质量更小的水解产物,采用复合酶水解是一种趋势。本研究采用响应面试验设计优化鹿茸胶原多肽单酶水解过程,并进一步对复合酶水解过程进行探讨,建立了鹿茸胶原多肽碱性蛋白酶和胰蛋白酶复合水解的工艺条件,旨在更大程度上提高鹿茸胶原蛋白的水解度,使水解物分子质量更小,为其多肽产品的开发奠定基础。
1 材料与方法
1.1 材 料
1.1.1 鹿茸胶原蛋白粉 鹿茸胶原蛋白粉,实验室自制,纯度为72%左右(采用羟脯氨酸比色法测定)。
1.1.2 试 剂 磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸,均为分析纯。胰蛋白酶,北京鼎国昌盛生物技术有限责任公司生产;碱性蛋白酶、还原型谷胱甘肽、氧化型谷胱甘肽、VC、VB12,上海瑞永生物科技有限公司生产。
1.1.3 仪器与设备 PB-10酸度计(德国赛多利斯公司),紫外可见分光光度计(上海元析仪器有限公司),SBS-100数控计滴自动部分收集器(上海青浦沪西仪器厂),数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司),冷冻干燥机(北京博医康实验仪器有限公司),20 mm×40 cm Sephadex G25层析柱。
1.2 方 法
1.2.1 水解度(DH)的测定 DH是指蛋白质中的肽键被水解的百分数,即DH=h/htot,其中h为蛋白质水解后每克蛋白中被裂解肽键的物质的量(mmol/g),htot指每克原料蛋白中肽键的物质的量。本试验DH的测定采用pH-stat法[14]。水解过程中用0.1 mol/L的NaOH来控制pH值,使其保持基本不变。由于鹿茸胶原蛋白水解产生氨基酸使pH值下降,所以可根据其保持初始pH值所需的NaOH的量计算其水解度。

式中:VNaOH为消耗NaOH溶液的体积(mL);CNaOH为消耗NaOH溶液的浓度,取0.1 mol/L;MP为被水解的蛋白质质量(g);htot为每克原料蛋白质中肽键的物质的量,胶原蛋白取均值8.0 mmol/g[15];pK为平衡常数;pH为水溶液的氢离子浓度。
1.2.2 复合酶水解提取胶原多肽工艺的研究 准确称取一定量的自制鹿茸胶原蛋白粉,加入适量磷酸盐(pH 7.5,0.02 mol/L)溶解制成10 g/L的胶原溶液,同时加入蛋白酶,调节pH值,在一定的温度条件下反应一定时间,灭活酶,将溶液于 10 000 r/min 离心30 min,上清液冻干即得胶原多肽粉。
采用响应面分析中的Box-Behnken中心组合试验设计,优化碱性蛋白酶和胰蛋白酶水解过程。选取酶解时间(A)、pH值(B)、酶解温度(C)和加酶量(D)进行单酶解4因素3水平正交试验,因素水平见表1和表2,研究碱性蛋白酶和胰蛋白酶对胶原蛋白水解度的影响。根据响应面试验所得到的单酶水解的最适条件,设计2种酶混合水解和先后水解试验,确定双酶复合水解方案。
1.2.3 Sephadex G25测定胶原多肽分子量分布 通过Sephadex G25层析柱(20 mm×40 cm)测定鹿茸胶原多肽分子量分布。取1 mL样品用0.1 mol/L的磷酸盐缓冲液(pH 7.0)洗脱,收集洗脱液,在280 nm下检测吸光度(A280)。分别用VC、还原型谷胱甘肽、氧化型谷胱甘肽、VB12上Sephadex G25层析柱,按参考文献[16]的方法测定各已知分子量标准物的洗脱体积,绘制分子量测定标准曲线。

表 1 鹿茸胶原多肽碱性蛋白酶酶解试验因素、水平及编码
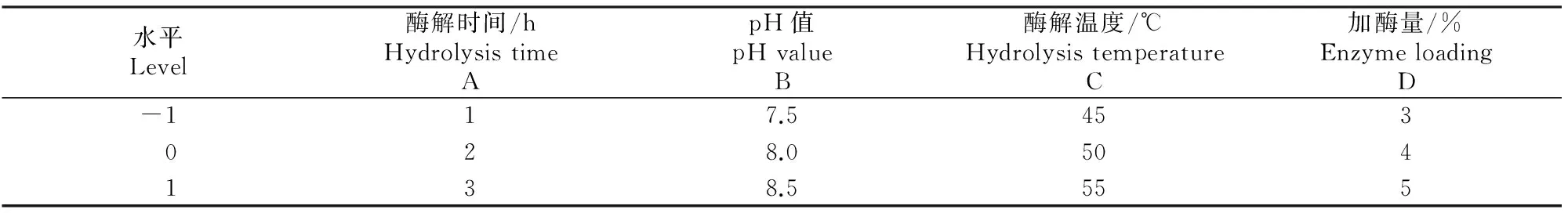
表 2 鹿茸胶原多肽胰蛋白酶酶解试验因素、水平及编码
2 结果与分析
2.1 碱性蛋白酶提取鹿茸胶原多肽条件的优化
鹿茸胶原多肽碱性蛋白酶单一酶解试验设计方案和结果见表3。利用Design Expert 8.05软件对表3中数据进行多元回归拟合,得各因素与DH的多元二次回归方程:DH=21.74+0.5A+0.71B+0.22C+0.36D+0.54AB+0.16AC+0.25AD+0.19BC-0.68BD-0.11CD-0.67A2-0.99B2-2.13C2-0.64D2。为检验该方程的有效性,确定各自变量对响应值的影响程度,对回归模型进行方差分析,结果见表4。

表 3 鹿茸胶原多肽碱性蛋白酶酶解Box-Behnken中心组合试验结果

表 4 鹿茸胶原多肽碱性蛋白酶酶解的二次多项模型方差分析结果
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。表6同。
Note:“*” indicates significant differenceP<0.05,“**” indicates extremely significant differenceP<0.01.The same for table 6.
表4结果表明,该二次方程模型达极显著水平(P=0.000 1<0.01),且失拟项不显著(P>0.05),说明该方程拟合较好,试验误差小,可用于碱性蛋白酶酶解法提取鹿茸胶原多肽工艺的分析和预测。对DH来说,一次项A、B、D,交互项BD,二次项A2、B2、C2、D2对胶原蛋白水解度有极显著影响,交互项AB有显著影响,表明各因素对胶原蛋白水解度的影响不是简单的线性关系。
响应面分析结果见图1。通过响应面分析软件中的Design-Expert求解方程,得出碱性蛋白酶酶解法提取鹿茸胶原多肽的最佳条件为:酶解时间3.61 h,pH值10.49,酶解温度55.09 ℃,加酶量 4.13%,此条件下模型水解度预测值为22.1%,考虑到实际情况,将其优化后的条件修正为酶解时间3.6 h,pH值10.50,酶解温度55 ℃,加酶量4%,测定该条件下鹿茸胶原蛋白最大水解度为22.03%,实测值与预测值基本一致,表明该优选工艺可靠。
2.2 胰蛋白酶提取鹿茸胶原多肽条件的优化
鹿茸胶原多肽胰蛋白酶单一酶解试验设计方案和结果见表5。利用Design Expert 8.05软件对表5中数据进行多元回归拟合,得各因素与DH的多元二次回归方程:DH=15.71-0.073A+0.067B+0.054C+0.82D+0.39AB+0.48AC+0.77AD+0.43BC+0.095BD-0.21CD-0.83A2-1.10B2-1.49C2-1.15D2。
为检验该方程的有效性,确定各自变量对响应值的影响程度,对回归模型进行方差分析,结果见表6。由表6可以看出,该二次方程模型达极显著水平(P=0.000 1<0.01),失拟项不显著(P>0.05),说明该方程拟合较好,可用于胰蛋白酶酶解法提取鹿茸胶原多肽工艺的分析和预测;对DH来说,一次项D、交互项AD和二次项A2、B2、C2、D2对水解度有极显著影响,交互项AB、AC、BC对DH有显著影响,且各因素之间有较强的交互作用。
响应面分析结果见图2。通过响应面分析软件中的Design-Expert求解方程,得出胰蛋白酶酶解法提取鹿茸胶原多肽的最佳条件为:酶解时间3.18 h,pH 值8.08,酶解温度50.03 ℃,加酶量4.42%,此条件下模型水解度预测值为15.87%,考虑到实际情况,将其优化后的条件修正为酶解时间3.2 h,pH值8.00,酶解温度50 ℃,加酶量4.4%,该条件下测定鹿茸胶原蛋白水解度为15.81%,实测值与预测值基本一致,表明该优选工艺可靠。

图 1 碱性蛋白酶水解时各因素之间的交互作用对鹿茸胶原蛋白水解度的影响

表 5 鹿茸胶原多肽胰蛋白酶酶解Box-Behnken中心组合试验结果

表 5(续) Continued table 5

表 6 鹿茸胶原多肽胰蛋白酶酶解的二次多项模型方差分析结果
2.3 复合酶水解方案的选择
根据响应面试验得到的单酶水解最适条件,确定了双酶复合水解的方案,结果如表7所示。由表7可以看出,选取碱性蛋白酶和胰蛋白酶进行复合酶水解试验,得到水解产物的水解度较之单酶都有一定的提高。复合酶水解的最佳条件为:碱性蛋白酶和胰蛋白酶先后水解,温度52.5 ℃,碱性蛋白酶在pH值 10.50,加酶量4%的条件下水解3.6 h;调节pH至8.00,胰蛋白酶添加量4.4%,水解3.2 h,所得水解液水解度为33.42%。

表 7 碱性蛋白酶和胰蛋白酶复合酶水解鹿茸胶原多肽试验结果
注:A.碱性蛋白酶;B.胰蛋白酶;A+B.同时加入碱性蛋白酶和胰蛋白酶酶解;A→B.先加入碱性蛋白酶酶解后加入胰蛋白酶酶解;B→A.先加入胰蛋白酶酶解后加入碱性蛋白酶酶解。
Note:A.Alkaline protease;B.Trypsin;A+B.Adding alkaline protease and trypsin at the same time;A→B.Adding alkaline protease before trypsin;B→A.Adding trypsin before alkaline protease.
2.4 鹿茸胶原多肽分子量分布
2.4.1 分子量标准曲线 VC、VB12、还原型谷胱甘肽、氧化型谷胱甘肽4种已知分子量标准物质的分子质量及洗脱液体积如表8所示。对表8数据进行回归分析,得分子量测定标准曲线回归方程为:Y=-38.359X+176.2,R2=0.998 1。Y为标准物的洗脱体积(mL),X为分子质量(u)的常用对数(lg M)。试验表明,lg M在2.1~3.3时X与Y线性关系良好。
2.4.2 胶原多肽的分子量分布 取水解液直接上柱,得到如图3所示的洗脱曲线。从图3可以看出,碱性蛋白酶和胰蛋白酶复合水解鹿茸胶原多肽的洗脱液在55.5 mL和76.5 mL出现了2个洗脱峰,将洗脱峰体积带入分子量测定标准曲线,计算出鹿茸胶原多肽的分子量分布在400~1 400 u。

表 8 标准物的分子量和洗脱体积

图 3 碱性蛋白酶和胰蛋白酶复合水解鹿茸胶原多肽产物的洗脱曲线
3 讨 论
胶原多肽的提取方法主要有2种:化学法和酶法。化学法是用酸、碱等化学试剂在一定温度下促使蛋白质分子的肽链断裂形成小分子物质。酸法多采用硫酸、盐酸等强酸在高温下反应,反应剧烈,设备腐蚀严重,并产生二次污染,现已逐渐被淘汰;碱法水解过程中发生消旋现象,得到的水解物无生物利用价值[17]。酶解法反应条件温和,反应时间短,无环境污染,产物理化性质稳定,作为胶原多肽提取方法已经成为发展趋势。
从同一种酶水解过程来看,不同的水解条件造成水解液的水解度不同[18],水解产物的分子量受水解过程影响[19]。在酶解温度52.5 ℃,碱性蛋白酶在pH 值10.50,加酶量4%的条件下水解3.6 h;调节pH至8.00,胰蛋白酶添加量4.4%,水解3.2 h的条件下,所得水解液的水解度最大可达33.42%,分子量分布在400~1 400 u。不同的酶水解位点不同,试验结果表明,复合酶水解能够有效提高鹿茸胶原蛋白的水解度,而复合酶的组合方式对水解液水解度的影响较大。
有学者同时加入木瓜蛋白酶和胰蛋白酶提取牛皮胶原多肽,在最优工艺条件下胶原蛋白的水解度为32.02%[20];杨吉平等[21]曾用胃蛋白酶和胰蛋白酶双酶法制备梅花鹿鹿茸胶原多肽,在最佳工艺条件下酶解得到的鹿茸胶原多肽相对分子质量小于3 000的约占60.65%,相对分子质量小于5 000的约占88.16%。在本研究中,最佳工艺条件下水解液的水解度略高于文献报道,分子量也比文献报道的更小,适用于工业生产,为工业化生产鹿茸胶原多肽提供理论依据。
[1] 国家药典委员会.中华人民共和国药典 [M].北京:化学工业出版社,2010:303.
National Pharmacopoeia Committee.Chinese pharmacopoeia [M].Beijing:Chemical Industry Press,2010:303.
[2] Byongtae J,Sungjin K,Sangmoo P,et al.Effect of antler grow-th period on the chemical composition of velvet antler in sika deer(Cervusnippon) [J].Mammalian Biology,2008,74(5):374-380.
[3] 薄士儒,李庆杰,王春雨,等.鹿茸化学成分与药理作用研究进展 [J].经济动物学报,2010,14(4):243-248.
Bo S R,Li Q J,Wang C Y,et al.Research progress on chemical composition and pharmacological effects of cervi cornu pantotrichum [J].Journal of Economic Animal,2010,14(4):243-248.
[4] 李和平.中国茸鹿品种(品系)的鹿茸化学成分 [J].东北林业大学学报,2003,31(4):26-28.
Li H P.The velvet chemical compositions of velvet-deer breeds or strains in China [J].Journal of Northeast Forestry University,2003,31(4):26-28.
[5] Birgit L,Erhard H.Mammalian collagen receptors [J].Matrix Biology,2007,26(3):146-155.
[6] Franchi M,Trire A,Quaranta M,et al.Collagen structure of tendon relates to function [J].The Scientific World Journal,2007,7:404-420.
[7] 王 茵,吴靖娜,苏 捷,等.鱼皮胶原多肽的降血压效果研究 [J].中国海洋药物,2014,33(2):39-44.
Wang Y,Wu J N,Su J,et al.Study on antihypertensive effect of collagen peptides from fish skin gelatin [J].Chinese Joural of Marine Drugs,2014,33(2):39-44.
[8] 冯成利,党蕊叶,李校坤,等.猪皮胶原多肽的提取及理化分析 [J].陕西师范大学学报(自然科学版),2007,37(6):20-23.
Feng C L,Dang R Y,Li X K,et al.Extraction of collagen protein peptide from pigskin and its analysis of physical and chemical propeties [J].Journal of Shaanxi Normal University(Natural Sciences Edition),2007,37(6):20-23.
[9] 李银清,赵 雨,唐仁能,等.梅花鹿茸胶原酶解物对去势大鼠骨质疏松症防治作用的实验研究 [J].天然产物研究与开发,2010,22(4):578-581.
Li Y Q,Zhao Y,Tang R N,et al.Prevention and therapeuticeffect of Sika deer velvet collagen hydrolysate on osteoporosis in ovariectomized rats [J].Natural Product Research and Development,2010,22(4):578-581.
[10] 刘高梅.小分子胶原多肽的抗氧化活性研究 [J].中国农学通报,2012,28(6):247-251.
Liu G M.Study on antioxidant effect of small collagen peptide [J].Chinese Agricultural Science Bulletin,2012,28(6):247-251.
[11] 林 琳,李八方.鱿鱼皮胶原蛋白水解肽抗氧化活性研究 [J].中国海洋药物,2006,25(4):48-49.
Lin L,Li B F.Studies on the antioxidation activity of squid (DosidicuseschrichitiiSteenstrup) skin gelatin hydrolysate [J].Chinese Joural of Marine Drugs,2006,25(4):48-49.
[12] Hou H,Li B F,Zhang Z H,et al.Moisture absorption and retention properties,and activity in alleviating skin photodamage of collagen polypeptide from marine fish skin [J].Food Chemistry,2012,135(11):1432-1439.
[13] 白海英,柯蕾芬,朱文赫,等.胶原蛋白应用的研究进展 [J].吉林医药学院学报,2013,34(2):133-134.
Bai H Y,Ke L F,Zhu W H,et al.Reasearch progess of collagen application [J].Journal of Jilin Medical College,2013,34(2):133-134.
[14] Adlder N J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid [J].Journal of Agricultural and Food Chemistry,1999,27(6):1256-1262.
[15] 韩凤杰.酶法制取比目鱼皮胶原寡肽及其功能性研究 [D].天津:天津科技大学,2006.
Han F J.Enzymatic preparation of collagen oligopeptides from flatfish(Paralichthysolivaceus) skin and their functions [D].Tianjin:Tianjin University of Science and Technology,2006.
[16] Huo J X,Zhao Z.Study on enzymatic hydrolysis ofGadusmo-rrhuaskin collagen and molecular weight distribution of hydrolysates [J].Agricultural Sciences in China,2009,8(6):723-729.
[17] 蒋挺大.胶原与胶原蛋白 [M].北京:化学工业出版社,2006.
Jiang T D.Collagen [M].Beijing:Chemical Industry Press,2006.
[18] Sathivel S,Bechtel P J,Babbitt J,et al.Biochemical and functional properties of herring (Clupeaharengus) byproduct hydrolysates [J].Joural of Food Science,2003,43(68):2196-2200.
[19] Kristinsson H G,Rasco S B A.Biochemical and functional pr-operties ofAtlanticsalmon(Salmosalar) muscle protein hydrolysed with various alkaline proteases [J].Joural of Agricultural and Food Chemistry,2000,48:657-666.
[20] 戴丹琴.酶法提取牛皮胶原多肽及其口服液的研制 [D].浙江宁波:宁波大学,2013.
Dai D Q.Extraction of cow leather collagen peptide by enzymatic hydrolysis and preparation of its oral liquid [D].Zhejiang,Ningbo:Ningbo University,2013.
[21] 杨吉平,张 鹤,董 颖,等.双酶法制备梅花鹿鹿茸胶原多肽的工艺研究 [J].食品科技,2014,39(1):244-248.
Yang J P,Zhang H,Dong Y,et al.Preparation of velvet antler collagen polypeptide of sika deer by double enzymatic method [J].Food Science and Technology,2014,39(1):244-248.
Composite enzymatic hydrolysis of collagen peptide from antler
LI Bing,LI Liang,WANG Lulu,DONG Simin,HUANG Baoliang,ZHANG Jing
(CollegeofChineseMedicinalMaterials,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
【Objective】 Hydrolysis of collagen peptide of antler by composite enzymes was optimized and the molecular weight (MW) distribution of hydrolysates was investigated.【Method】 Response surface design experiment was applied to optimize the hydrolysis conditions (including hydrolysis time,pH value,hydrolysis temperature and enzyme loading) for alkaline protease and trypsin to determine the optimal composite enzymatic hydrolysis of collagen peptide from antler.The molecular weight distribution of hydrolysates was also determined using Sephadex G25 partition.【Result】 The optimal conditions for alkaline protease were pH 10.50,temperature 55 ℃,and enzyme loading 4% for 3.6 h with the degree of hydrolysate (DH) of 22.03%.The optimal conditions for trypsin were pH 8.00,temperature 50 ℃,and enzyme loading 4.4% for 3.2 h with DH of 15.81%.The optimum parameters of composite enzyme hydrolysis were hydrolyzed 4% alkaline protease at 52.5 ℃ and pH 10.50 for 3.6 h before hydrolyzing 4.4% trypsin at pH 8.00 for 3.2 h.The obtained DH was 33.42%.The molecular weight distribution of collagen peptide from antler ranged from 400 to 1 400 u.【Conclusion】 This study determined the optimal conditions for composite enzymatic hydrolysis of collagen peptide from antler by alkaline protease and trypsin.
velvet antler;response surface design experiment;composite enzymatic hydrolysis;collagen peptide
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.028
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.056.html
2015-05-12
吉林省科技厅发展计划项目(20140204063YY,20130413044GH,20120246)
李 冰(1991-),女,吉林公主岭人,在读硕士,主要从事天然产物研究。E-mail:862256868@qq.com
张 晶(1971-),女,吉林长春人,教授,硕士生导师,主要从事天然产物研究。E-mail:zhjing0701@163.com
R284;Q512+.6
A
1671-9387(2016)11-0193-09

