蛹虫草中蓝光受体基因Cmwc–1和Cmwc–2的表达特性分析
李琴,毛玉梅,付鸣佳,沈俊良,金华燕,钟雪晴
(江西师范大学生命科学学院,江西 南昌 330022)
蛹虫草中蓝光受体基因Cmwc–1和Cmwc–2的表达特性分析
李琴,毛玉梅#,付鸣佳*,沈俊良,金华燕,钟雪晴
(江西师范大学生命科学学院,江西 南昌 330022)
采用 RT–PCR克隆蛹虫草中蓝光受体基因Cmwc–1和Cmwc–2。结果表明,Cmwc–2基因序列的翻译产物CmWC–2中存在1个PAS结构域和1个锌指结构域。实时荧光定量PCR结果显示,蛹虫草菌丝体Cmwc–1和Cmwc–2基因的表达量分别在蓝光照射后6 h和2 h达到峰值。子实体形成不同阶段Cmwc–1和Cmwc–2的相对转录量都有较大差异,生长50 d时蛹虫草子实体不同部位的Cmwc–1表达主要在子实体的中下段,Cmwc–2的表达主要在子实体的顶端和中段,畸形子实体中Cmwc–1和Cmwc–2的表达量都不高。
蛹虫草;蓝光;蓝光受体;基因Cmwc–1;基因Cmwc–2
投稿网址:http://xb.ijournal.cn
真菌可感受环境中的各种信号因子,光照是其中重要的因子。蓝光影响真菌的生长和发育,可以导致真菌的形态建成和生理生化变化,包括无性孢子的产生[1–2]、菌丝的生长发育[3]、趋光性[4–5]和类胡萝卜素产生[6–8]等。真菌受蓝光影响的研究[4–5,9–16]已经较为深入,已经在多种真菌中克隆和测序了多个感受蓝光信号的蓝光受体蛋白基因,对其中蓝光受体蛋白感受蓝光信号相关机制的研究已较深入。真菌中蓝光受体大都带有PAS域 (Per–Arnt–Sim domain),只是不同真菌来源蓝光受体的PAS域数量有差异[4–5,9–16]。PAS域可以使不同蓝光受体间结合成复合体(white collar complex,WCC)结构[17–19]。此外,部分蓝光受体中带有LOV 域(light, oxygen or voltage domain),可结合有色素基团黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD),用于接受蓝光信号[10,20]。真菌中蓝光受体蛋白大多为锌指蛋白(zinc finger protein),表明蓝光受体接受蓝光信号以后转变成有活性的转录因子,产生生理和生化效应[4–5,9–14]。目前对脉孢菌(Neurospora crassa)中蓝光受体蛋白White Collar–1(WC–1)、White Collar–2 (WC–2)和VIVID[9–11,21]的研究已比较成熟,这为其他真菌蓝光受体的研究提供了依据。
蛹虫草(Cordyceps militaris)是一种很重要的食药兼用真菌。根据《中华人民共和国食品卫生法》和《新资源食品管理办法》,蛹虫草已在中华人民共和国卫生部2009年3号公告中被列为新资源食品。目前对蛹虫草的研究主要集中在蛹虫草的栽培培养、有效成分提取和品种形态描述等方面,对菌丝体生长和子实体的形成机制研究不多。笔者对蛹虫草中2个蓝光受体基因进行克隆,并对这2个蓝光受体基因在蛹虫草菌丝体和子实体中的表达特性进行分析,旨在揭示光照对蛹虫草子实体形成的影响。
1 材料和方法
1.1 菌种
蛹虫草菌株(Cordyceps militaris F411)由江西师范大学生命科学学院生物技术实验室保藏。
1.2 蛹虫草菌丝体的蓝光诱导培养和取样
将蛹虫草菌种接种在加了1%奶粉的PDA培养基中,在24 ℃恒温培养箱中进行培养。将接种的培养皿用锡铂纸包裹,在黑暗中培养4 d后去除锡铂纸,持续进行蓝光光照培养,并在设定的照射时间点迅速将蛹虫草置于–80 ℃冰冻,用于提取蛹虫草总RNA。
1.3 蛹虫草子实体的培养和取样
将蛹虫草已经活化菌种接入到100 mL PDB培养基中,20 ℃摇菌至菌丝体成球状,直径约0.4 mm,而后取5 mL液体菌种接种到固体培养基中(将30 g优质大米加入到450 mL罐头瓶中,再加入液体培养基35 mL,高压121 ℃灭菌40 min),于温度20 ℃、相对湿度75%左右避光培养。待菌丝布满整个平面并扎到瓶底时开始见光,补充日光灯照于温度20 ℃、相对湿度70%下培养。当培养基表面出现米粒状的橘黄色菌蕾时换透气瓶盖,继续见光培养至子实体形成。
待蛹虫草形成子实体原基后取样。取样时分2种情况:一是对在不同阶段的子实体取样,分别是接种后18 d的菌丝体、接种后18 d的子实体原基、20 d子实体、24 d子实体、28 d子实体、32 d子实体、36 d子实体、40 d子实体和45 d子实体;二是对生长50 d的正常子实体和畸形子实体取样,其中将正常生长的子实体分为顶端膨大部分、子实体上段(子实体上部1/3)、子实体中段(子实体中部1/3)和子实体下段(子实体下部1/3) 4个部分。每次取样后,–80 ℃超低温冰箱保存。
1.4 蛹虫草总RNA的提取和cDNA第一链的合成
按照Trizol试剂(上海生工生物工程有限公司)说明书提取蛹虫草RNA,并进行琼脂糖凝胶电泳和OD值检测。以Oligo(dT)15为引物,用第一链cDNA合成试剂盒(上海生工生物工程有限公司)将所提取的总RNA 反转录成cDNA,用作基因的克隆;荧光定量cDNA第一链的合成参照PrimeScript® RT reagent Kit With gDNA Eraser(大连宝生物工程有限公司)试剂盒说明书进行。
1.5 蛹虫草Cmwc–1和Cmwc–2基因的克隆
根据http://www.ncbi.nlm.nih.gov/sites/entrez? db=Nucleotide&cmd=Search&term=AEVU01000000 NCBI上相关蛹虫草序列Cordyceps militaris CM01 whole genome shotgun sequence contig55(GenBank序列号为AEVU010 00055.1)和contig5(GenBank序列号为AEVU01 000005.1)设计引物[22]。使用软件ORF finder寻找蓝光受体基因的ORF,再使用Oligo 6.0软件设计一系列引物(表1)。 PCR反应程序:95 ℃预变性2 min,94 ℃变性 40 s,55 ℃退火1 min,72 ℃延伸3 min,30个循环。Cmwc–1–mRNA和Cmwc–1–mRNA的3'端采用3'–RACE方法进行扩增,其cDNA第一链的合成采用引物3'Adaptor Primer。1st PCR采用Downtouch PCR,引物GSP1和3'Outer;2nd PCR使用的引物为GSP2和3' Inner。

表1 PCR扩增中用到的引物Table 1 Primers for PCR amplification
1.6 蛹虫草Cmwc–1和Cmwc–2表达的real–time PCR检测
针对Real–time PCR设计扩增Cmwc–1基因和Cmwc–2基因的部分序列引物列于表2。内标基因采用管家基因甘油醛–3–磷酸脱氢酶(glyceraldehyde–3–phosphate dehydrogenase, GAPDH)基因,在NCBI上搜索到了GAPDH基因(GenBank序列号为FJ374269.1)[23],并设计相应的引物(表2)。每个反应设置3 次重复,取平均值,用2–ΔCt法计算目的基因的相对表达水平。

表2 在荧光定量PCR中用到的引物Table 2 Primers for RT–qPCR amplification
2 结果与分析
2.1 蛹虫草Cmwc–2的克隆和序列分析结果
将蛹虫草总RNA经反转录后得到的cDNA作为PCR的底物,用上游引物WC2e1及下游引物WC2e2进行PCR扩增,得到Cmwc–2基因的序列,长度约为1 575 bp(图1),通过3' 端RACE方法获得了长1 009 bp的3' 端序列。用DNAman软件对上述两端序列进行拼接及比对,得到了Cmwc–2–mRNA的部分序列,其长度为1 575 bp (其GenBank序列号为JX852619.1),且ORF序列长度为1 509 bp。

图1 蛹虫草Cmwc–2基因开放读框中部分序列的PCR扩增结果Fig.1 Electrophoresis of partial sequence of PCR products from gene Cmwc–2 open reading frame in C. militaris
使用DNASTAR editseq的Translate DNA功能得到Cmwc–2基因ORF可能的翻译后的蛋白质CmWC–2,其氨基酸序列长度为502 aa,GeneBank序列号为AFZ15762.1。序列呈送NCBI后初步确定为cutinase palindrome–binding protein。进一步分析表明,CmWC–2包含1个PAS功能域(161~235)和1个GATA型的锌指结构域(447~484)。将CmWC–2的氨基酸序列在http://smart.embl–heidelb erg.de/进行在线分析,得到了与上述一致的结果(图2)。 将CmWC–2氨基酸序列在NCBI上进行蛋白质BLAST比对的结果表明,CmWC–2与多种真菌中的WC–2蛋白有很高的同源性。 用DNAman软件将蛹虫草中CmWC–2的PAS域和锌指结构域分别与7种真菌的WC–2相应功能域进行比对的结果表明,CmWC–2与球孢白僵菌(Beauveria bassiana, NCBI参考序列号为XP_008594722.1)、Stachybotrys chlorohalonata (GenBank序列号为KFA63896.1)、脉孢菌(Neurospora crassa,GeneBank序列号为XP_963819.3)、冬虫夏草(Ophiocordyceps sinensis,GenBank序列号为 EQK98372.1)、水稻恶苗病菌(Fusarium fujikuroi,GenBank序列号为CCT62872.1)、顶头孢霉(Acremonium chrysogenum,GenBank序列号为KFH41821.1)和罗伯茨绿僵菌(Metarhizium robertsii,NCBI 参考序列号为
XP_007823629.2)中相应的功能结构域都有同源性(图3)。
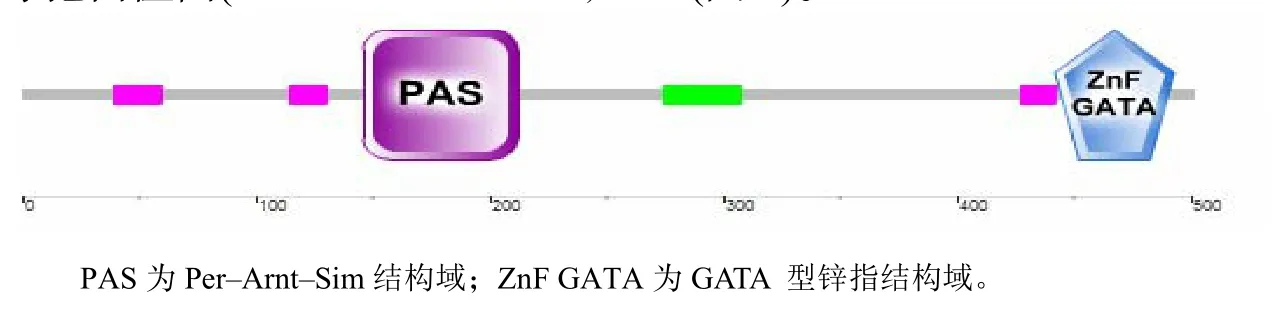
图2 蛹虫草蓝光受体CmWC–2的功能域Fig.2 Functional domain of blue light receptor CmWC–2 in C. militaris

图3 不同真菌WC–2中的PAS结构域与GATA型锌指结构域的同源性分析结果Fig. 3 Homology of PAS domain and GATA type of zinc finger domain in WC–2 for different fungus
2.2 蛹虫草Cmwc–1的克隆和序列分析结果
用分段上游引物WC1e1U、WC1e2U、WC1e3U、WC1e4U、WC1e5U分别与分段下游引物WC1e1D、WC1e2D、WC1e3D、WC1e4D、WC1e5D对应进行PCR扩增,得到Cmwc–1基因ORF的5个分段序列,3' 端RACE方法可获得1 020 bp左右的序列。 将得到的序列采用DNAman软件分析,Cmwc–1–mRNA长为3 248 bp(GenBank序列号为JX845417.1),且ORF序列长度为2 892 bp。
用软件DNASTAR editseq中的Translate对Cmwc–1基因进行ORF翻译后,获得的蛋白质CmWC–1的氨基酸序列长度为963 aa(GenBank 序列号为AFU65172.1)。将其于NCBI上进行蛋白质分析比对的结果(图 4)表明,此蛋白质为GATA型锌指结构蛋白(zinc finger domain–containing protein,GATA–type),包含3个PAS结构域(324~440,520~618,639~734)和一个锌指结构功能域(836~882)。

图4 蛹虫草蓝光受体CmWC–1的功能域Fig.4 Functional domain of blue light receptor CmWC–1 in C. militaris
2.3 蛹虫草Cmwc–1和Cmwc–2基因表达的real–time PCR检测结果
2.3.1 蛹虫草菌丝体蓝光诱导下的Cmwc–1和
Cmwc–2表达的real–time PCR检测结果结果表明,Cmwc–1和Cmwc–2基因在无蓝光情况下的相对表达量非常低,在有蓝光情况下的相对表达量有很大的变化,其中Cmwc–2基因的相对表达量在持续蓝光照射之初有个快速的上升,在蓝光照射2 h的时候达到最大值,而后快速下降并维持在较低水平,至照射12 h时又开始快速上升,在照射14 h时出现第2次高峰,但转录水平值比照射2 h时的小(表3)。 Cmwc–1基因表达量的上升较慢,在蓝光照射6 h时出现峰值,随后平缓下降,在蓝光照射22 h也再次出现峰值,转录水平也比照射6 h时的小(表3)。比较这2种蓝光受体的表达,Cmwc–1基因的表达有一个明显的滞后效应,且Cmwc–2基因每次出现表达高峰时,Cmwc–1基因的表达也有所上升。另外Cmwc–2的相对表达量比Cmwc–1的相对表达量要高很多。
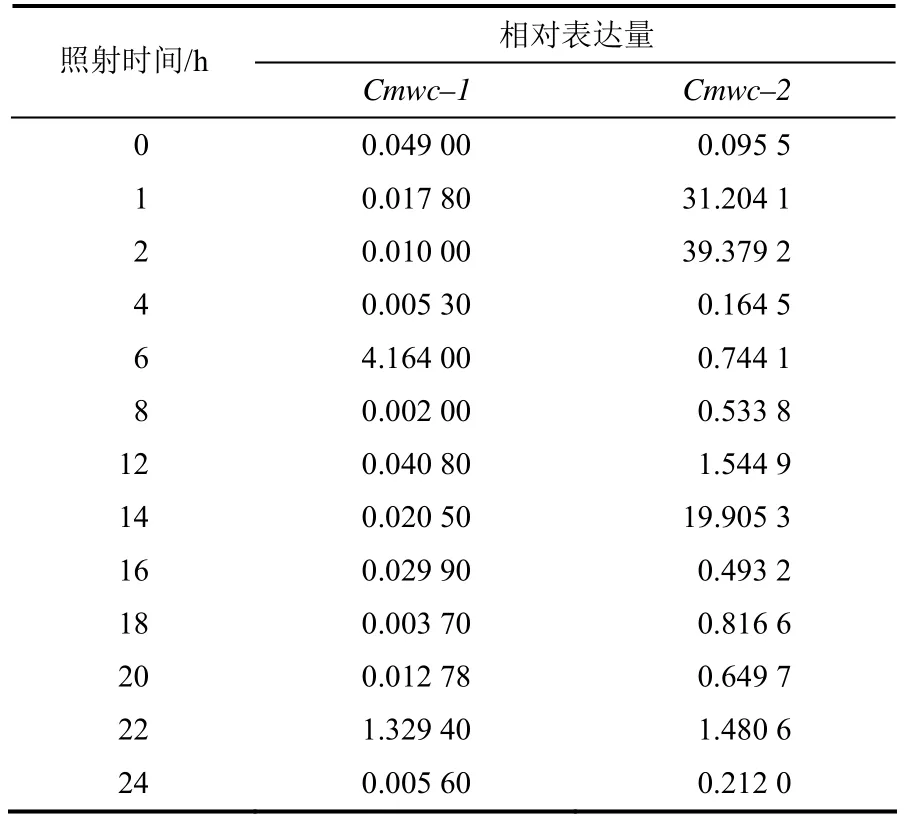
表3 蓝光照射下蛹虫草菌丝体Cmwc–1和Cmwc–2基因mRNA的相对表达量Table 3 mRNA relative expression level of gene Cmwc–1 and Cmwc–2 in C. militaris under the blue light radiation of different time
2.3.2 蛹虫草子实体不同生长阶段Cmwc–1和
Cmwc–2表达的real–time PCR检测结果检测结果表明:蛹虫草每个生长阶段Cmwc–1和Cmwc–2的相对转录量都有较大的差异(图5)。Cmwc–1总体相对转录量较低,在菌丝体、原基和子实体0~1 cm阶段相对转录量非常低,而在子实体长至1~2 cm(生长24 d)时上升很快,而后在子实体2~3 cm(生长28 d)时又迅速降低,在子实体3~7 cm(生长32~45 d)阶段一直保持稳定的低转录水平。Cmwc–2基因总体相对转录量较高,在菌丝体、原基和子实体0~3 cm(生长18~28 d)时的相对转录量保持稳定,在子实体3~4 cm(生长32 d)时快速上升,而在子实体4~6 cm(生长36~40 d)又降到了相对最低,最后在子实体6~7 cm(生长45 d)时阶段上升到了与子实体3~4 cm(生长32 d)阶段相当的水平。

图5 蛹虫草子实体不同生长阶段Cmwc–1和Cmwc–2的相对表达量Fig.5 mRNA relative expression level of gene Cmwc–1 and Cmwc–2 at different growing stages of fruiting body of C. militaris
2.3.3 蛹虫草子实体不同部位Cmwc–1和Cmwc–2表达的real–time检测结果
蛹虫草子实体生长过程中可产生正常子实体和畸形子实体,本研究中所用的为生长50 d的正常子实体(子实体长7~8 cm)和畸形子实体。将正常生长的子实体分为4个部分:顶端膨大部分、子实体上段(子实体上部1/3)、子实体中段(子实体中部1/3)和子实体下段(子实体下部1/3)。 对正常子实体4个部分和畸形子实体的Cmwc–1、Cmwc–2表达的相对转录量进行检测与分析的结果(图6)显示:正常子实体中Cmwc–1在顶端膨大部分相对转录量极低,在子实体下段的转录量相对较高;畸形子实体Cmwc–1基因的转录水平与正常子实体中段的相似。Cmwc–2的相对转录量在子实体中段部分最高,在子实体顶端膨大部分较高,在其他部分的转录量相对较低;Cmwc–2在畸形子实体中的基因转录水平与正常子实体中段的相当。

图6 蛹虫草子实体不同部位Cmwc–1和Cmwc–2的相对表达量Fig.6 mRNA relative expression level of gene Cm wc–1 and Cmwc–2 at different fruiting body sections of C. militaris
3 结论与讨论
蓝光是很重要的环境因子,真菌可以感受到蓝光信号,并产生生理和生化改变,而其感受蓝光的重要机制就是在菌体中产生蓝光受体。本研究中克隆了蛹虫草2个蓝光受体基因Cmwc–1和Cmwc–2的ORF序列,并确定了这2个基因翻译产物CmWC–1和CmWC–2的氨基酸序列。结果表明,在CmWC–1中有3个PAS域(其中第1个PAS域也称做LOV域)和1个锌指结构域。该结果与文献[24]中的CmWC–1基本相同。在CmWC–2中有1个PAS域和1个锌指结构域, CmWC–2与另外7种真菌蓝光受体WC–2相应结构域的同源性很高。CmWC–1和CmWC–2的结构与脉孢菌中蓝光受体蛋白WC–1和WC–2的结构类似[9,11],CmWC–1和CmWC–2是蛹虫草中的蓝光受体蛋白。蛹虫草中蓝光受体蛋白WC–1和WC–2均带有PAS结构域,表明这2个蓝光受体在行使功能时可形成CmWC–1/CmWC–2复合体结构。
蓝光受体WC–1和WC–2带有锌指结构,表明这类蛋白质为转录因子,调控其他基因的表达[9–11]。蛹虫草Cmwc–1和Cmwc–2基因的充分表达在蓝光照射6 h比较合适,Cmwc–1转录水平峰值的出现与Cmwc–2的并不同步。在脉孢菌中wc–1基因的表达对wc–2基因的表达存在负反馈作用[18]。蛹虫草中Cmwc–1和Cmwc–2基因表达的不同步可推测这种负反馈机制可能存在。
Cmwc–2基因的相对转录量比Cmwc–1基因的高很多。在脉孢菌中,WC–1和WC–2通过PAS域形成复合体(white collar complex ,WCC)结构,且WCC复合体中含有超过1个以上的WC–1分子[18],所以蛹虫草中Cmwc–1和Cmwc–2基因表达量的差异表明在形成CmWC–1/CmWC–2复合体时,其复合体结构不同于脉孢菌中的WCC结构。
在蛹虫草的菌丝体和子实体中均存在Cmwc–1和Cmwc–2基因的表达,说明这2个蓝光受体基因的表达产物形成的CmWC–1/CmWC–2复合体对蛹虫草菌丝体和子实体发育有重要作用。这2个基因在蛹虫草子实体不同生长发育阶段的相对表达量不同。 Cmwc–1在子实体形成前期的表达量很低,在接近中期时有个快速的增长,中后期的表达比较稳定;Cmwc–2的相对表达量在子实体形成的前期和中期都维持在一个较高的水平,在中后期有较大的波动。由此可推测:在子实体形成的前期和中期,Cmwc–1和Cmwc–2基因表达有利于促进CmWC–1/ CmWC–2复合体的形成和子实体的生长发育。这2个基因在蛹虫草子实体不同部位的相对表达量也不同, Cmwc–1在子实体顶端的表达量极低,其表达主要集中在子实体的中下段部位,而Cmwc–2在子实体的顶端部位和中段部位均有较好的表达。这表明子实体顶端的生长不依赖于CmWC–1/ CmWC–2复合体的形成,而子实体中、下部分的生长可能依赖CmWC–1/CmWC–2复合体结构。
[1] Corrochano L M,Cerda-Olmedo E.Sex,light and carotenes:the development of Phycomyces[J].TrendsGenet,1992,8(8):268–274.
[2] Kertesz-Chaloupkova K,Walser P J,Granado J D,et al. Blue light overrides repression of asexual sporulation by mating type genes in the basidiomycete Coprinus cinereus[J].Fungal Genet Biol,1998,23(1):95–109.
[3] Lauter F R,Marchfelder U,Russo V E A,et al. Photoregulation of cot–1,a kinase-encoding gene involved in hyphal growth in Neurospora crassa[J]. Fungal Genet Biol,1998,23(3):300–310.
[4] Idnurm A,Rodriguez-Romero J,Corrochano L M,et al. The Phycomyces madA gene encodes a blue–light photoreceptor for phototropism and other light responses [J].Proc Natl Acad Sci USA,2006,103(12):4546–4551.
[5] Sanz C,Rodríguez-Romero J,Idnurm A,et al.From the cover:Phycomyces MADB interacts with MADA to form the primary photoreceptor complex for fungal phototropism [J].Proc Natl Acad Sci USA,2009,106(17):7095–7100.
[6] 付鸣佳,王小菁.蓝光诱导的胶孢炭疽菌(Colletotrichum gloeosporioides)类胡萝卜素积累[J].微生物学报,2005,45(5):795–797.
[7] 付鸣佳,王小菁,黄文芳.蓝光诱导蛹虫草菌丝类胡萝卜素的积累[J].微生物学通报,2005,32(5):24–28.
[8] Harding R W,Turner R V.Photoregulation of the carotenoid biosynthetic pathway in albino and white collar mutants of Neurospora crassa [J].Plant Physiol,1981,68(3):745–749.
[9] Ballario P,Vittorioso P,Magrelli A,et al.White collar–1,a central regulator of blue light responses in Neurospora,is a zinc finger protein [J].EMBO J,1996,15:1650–1657.
[10] He Q,Cheng P,Yang Y,et al.White collar–1,a DNA binding transcription factor and a light sensor [J].Science,2002 ,297(5582):840–843.
[11] Linden H,Macino G.White collar 2,a partner in blue-light signal transduction,controlling expression of light–regulated genes in Neurospora crassa[J].The EMBO J,1997,16:98–109.
[12] Silva F,Torres-Martínez S,Garre V.Distinct white collar–1 genes control specific light responses in Mucor circinelloides[J].Mol Microbiol,2006,61(4):1023–1037.
[13] Silva F,Navarro E,Peñaranda A,et al.A ring-finger protein regulates carotenogenesis via proteolysisindependent ubiquitylation of a white collar–1–like activator [J].Mol Microbiol,2008,70(4):1026–1036.
[14] Purschwitz J,Müller S,Kastner C,et al. Functional and physical interaction of blue and red-light sensors in Aspergillus nidulans [J].Current Biology,2008,18(4):255–259.
[15] Kihara J,Moriwaki A,Tanaka N,et al. Characterization of the BLR1 gene encodinga putative blue-light regulator in the phytopathogenic fungus Bipolaris oryzae[J]. FEMS Microbiol Lett,2007,266(1):110–118.
[16] Schmoll M,Franchi L,Kubicek C P.Envoy,a PAS/LOV domain protein of Hypocrea jecorina (Anamorph Trichoderma reesei),modulates cellulase gene transcription in response to light [J].Eukaryotic Cell,2005,4(12):1998–2007.
[17] Cheng P,Yang Y,Gardner K H,et al.PAS domainmediated WC–1/WC–2 interaction is essential for maintaining the steady–state level of WC–1 and the function of both proteins in circadian clock and light responses of Neurospora [J].Mol Cell Biol,2002,22:517–524.
[18] Cheng P,Yang Y,Wang L,et al.WHITE COLLAR–1,a multifunctional Neurospora protein involved in the circadian feedback loops,light sensing,and transcription repression of wc–2[J].The Journal of Biological Chemistry,2003,278(6):3801–3808.
[19] Talora C,Franchi L,Linden H,et al.Role of a white collar–1–white collar–2 complex in blue–light signal transduction [J].EMBO J,1999,18:4961–4968.
[20] Froehlich A C,Liu Y,Loros J J,et al.White Collar–1,a circadian blue light photoreceptor,binding to the frequency promoter [J].Science,2002,297(5582):815–819.
[21] Schwerdtfeger C,Linden H.VIVID is a flavoprotein and serves as a fungal blue light photoreceptor for photoadaptation [J].EMBO J,2003,22(18):4846–4855.
[22] Zheng P,Xia Y,Xiao G,et al.Genome sequence of the insect pathogenic fungus Cordyceps militaris,a valued traditional Chinese medicine [J].Genome Biol,2011,12(11):R116.
[23] Gong Z,Su Y,Huang L,et al.Cloning and analysis of glyceraldehyde–3–phosphate dehydrogenase gene from Cordyceps militaris [J].Afr J Agric Res,2009,4(4):402–408.
[24] Yang T,Dong C.Photo morphogenesis and photo response of the blue-light receptor gene Cmwc–1 in different strains of Cordyceps militaris[J].FEMS Microbiol Lett,2014,352:190–197.
责任编辑:王赛群
英文编辑:王 库
Expression characteristics of blue light receptor Cmwc–1 and Cmwc–2 gene from Cordyceps militaris
Li Qin, Mao Yumei#,Fu Mingjia*, Shen Junliang, Jin Huayan, Zhong Xueqing
(College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China)
ORF sequence of gene Cmwc–1 and Cmwc–2, the blue light receptor, were cloned from fungus Cordyceps militaris by approach of RT–PCR. There were 1 PAS functional domains and 1 zinc finger functional domain at putative CmWC–2 amino acid sequence in Cmwc–2 ORF. The real-time PCR results showed that the translation of gene Cmwc–1 and Cmwc–2 reached their peaks in 6 h and 2 h, respectively. The relative transcription level of gene Cmwc–1 and Cmwc–2 were quite different according to their growing stages. The relative transcription level of Cmwc–1 was mainly distributed at the middle and lower section of fruiting body, and rarely spotted at the top after 50 d inoculation, while, it was mainly at the top and the middle section for Cmwc–2. There were little relative transcription level of Cmwc–1 and Cmwc–2 in abnormal fruiting body.
Cordyceps militaris; blue light; blue light receptor; Cmwc–1; Cmwc–2
Q939.5
A
1007-1032(2016)06-0601-07
2015–12–31
2016–10–24
国家自然科学基金项目(31060004;31260010)
李琴(1990—),女,江西南昌人,硕士研究生,主要从事真菌分子生物学研究,15070811079@163.com;#共同第一作者,毛玉梅(1989—),女,山东聊城人,硕士研究生,主要从事真菌分子生物学研究,maoyumei.love@163.com;*通信作者,付鸣佳,博士,教授,主要从事真菌分子生物学研究,mingjiafu@126.com

