不同形态硒、维生素E、紫萝卜提取物体外抗氧化协同作用研究
郑时莲,潘 瑶,张云龙,邓泽元,李红艳
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
不同形态硒、维生素E、紫萝卜提取物体外抗氧化协同作用研究
郑时莲,潘 瑶,张云龙,邓泽元,李红艳*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
本文比较了不同形态硒(包括亚硒酸钠,SS;L-硒甲基半胱氨酸,L-Se-MSC;富硒酵母,SEY)、维生素E(VE)和紫胡萝卜提取物(Ant)之间的抗氧化协同作用。分别建立DPPH、Fe3+和ABTS+·三种体外抗氧化模型,绘制清除率曲线,计算各物质的半抑制浓度(IC50)。采用等辐射分析法,根据等效公式计算复配后的理论值(IC50add),将其与实际测量值(IC50 mix)进行比较。结果显示,SS和L-Se-MSC的体外抗氧化性较弱,而SEY在体外具有较强抗氧化能力。同一模型中,不同复配比例的抗氧化协同效应不同。协同效应最佳的组合比例在DPPH模型中为:VEmix∶Antmix∶SEYmix=4∶1∶1,在Fe3+模型中为:VEmix∶Antmix∶SEYmix=1∶4∶1,在ABTS+·模型中为:VEmix∶Antmix∶SEYmix=1∶1∶1。因此,同一物质在不同模型中的抗氧化效应不同,SEY、VE与Ant联用具有抗氧化协同作用,但同一组合在不同抗氧化模型中表现出的效应有所不同。
硒,维生素E,紫萝卜提取物,抗氧化,协同作用
硒(Se)是人和动物体内一种重要的微量元素,在人体内发挥着重要的生物学作用,其存在形式主要有有机硒和无机硒两种。其中,无机硒亚硒酸钠(Sodium selenite,SS)中的硒元素在体内作为多种抗氧化酶的活性中心发挥抗氧化作用[1]。有机硒L-硒甲基硒代半胱氨酸(L-Se-methylselenocysteine,L-Se-MSC)是甲基化的硒代半胱氨酸,是一种新型的硒强化剂,外观为粉末状或颗粒状物质[2]。有机硒富硒酵母(Se-enriched yeast,SEY)是在培养酵母的过程中加入无机硒,酵母生长时硒与酵母体内的蛋白质和多糖有机结合转化为生物硒,从而消除了化学硒对人体的毒副反应和肠胃刺激,使硒能够更高效、更安全地被人体吸收利用[3]。有机硒、无机硒和VE都有一定的抗氧化能力[4]。维生素E(Vitamin E,VE)又称生育酚,是一种脂溶性维生素[5]。紫色作物中存在着大量的花色苷,具有强抗氧化作用。据美国《健康》杂志报道[6],紫萝卜含有高浓度的花色苷,天然的紫萝卜花青素是有效的抗氧化剂。研究发现两种或多种有抗氧化功效的因子联用存在抗氧化协同作用[7]。
等辐射分析法评价抗氧化相互作用的优点在于判断准确,直观方便[8]。研究表明,该方法适用于不同药物之间相互作用的评价,近年来也逐渐用于评价天然产物的抗氧化相互作用。本实验在Luszczki 等[9]的等辐射法的基础上略加改进,运用等效公式对复配药物的相互作用进行定性分析,协同率对复配药物的协同强弱进行定量分析,研究五种抗氧化物质(SS、L-Se-MSC、SEY、VE和Ant)之间的协同作用。分别建立三种体外抗氧化模型(DPPH法、Fe3+还原法及ABTS+·法),探讨不同抗氧化模型之间的差异,研究不同形态硒的抗氧化作用,另外,参照孙玥等[10]的复配方法,研究以不同比例(1∶1∶0、1∶1∶1、1∶1∶4、4∶1∶1、1∶4∶1)与VE、Ant复配后的抗氧化协同能力。
1 材料与方法
1.1 材料与仪器
L-硒甲基硒代半胱氨酸(L-Se-MSC) 由江西川奇制药有限公司提供;亚硒酸钠(SS) 由国药集团化学试剂有限公司提供;富硒酵母(SEY) 由安琪酵母股份公司提供;水溶性维生素E(VE) 1,1-二苯基-1-苦味肼基自由基(DPPH) 由美国Sigma公司提供;紫萝卜提取物(Ant) 由江西国亿生物有限公司提供;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),过硫化钾 来自广东西陇化工厂。其他试剂均为分析纯。
SP-1900UV紫外可见分光光度计 来自上海光谱仪器有限公司;QL-861涡流混合器 来自太仓科教器材厂;HH-S11电热恒温水浴锅 来自广州户瑞明仪器有限公司;AR1140电子分析天平来自奥豪斯仪器有限公司。
1.2 抗氧化模型的建立
根据周玮婧[11]等方法,加以改善,建立DPPH、Fe3+、ABTS+·三种体外抗氧化模型。
1.2.1 试剂配制 取L-Se-MSC、SS、SEY、VE和Ant所需用量,用蒸馏水溶解成浓度适合(5、10、20、40、60、100、150 μg/mL)的样品储备液,冷藏待用。注:VE为脂溶性维生素,先用少量乙醇溶解,再进行后续实验。
1.2.2 DPPH自由基清除法 DPPH配制成1×10-4mol/L,取2 mL DPPH与等体积不同浓度的受试物混合,充分摇匀。室温暗光下反应30 min,在517 nm处测定其吸光值,平行三次。
清除率(%)=[A0-(Ai-Aj)/A0]×100
(式中:A0为对照实验(蒸馏水水代替样品溶液)的吸光度;Ai为样品实验组的吸光度;Aj为样品干扰实验(无水乙醇代替DPPH溶液)的吸光度)。
1.2.3 Fe3+还原法 取2 mL不同溶度的受试物与1 mL PBS(pH6.6)缓冲溶液混合后,加1 mL l%的铁氰化钾溶液于50 ℃水浴20 min后迅速冷却,然后加入1 mL 三氟乙酸(10%),混匀静置10 min。取2 mL上清液,加入3 mL水后加0.2 mL三氯化铁(0.1%)溶液,完全显色后以试剂空白做参比,于700 nm处测定吸光值,吸光值越强,还原能力越强。
1.2.4 ABTS自由基清除法 ABTS储备液的配制:取5 mL ABTS阳离子,80 μL K2S2O8储备液用PBS溶液稀释成工作液,在734 nm处将吸光值调整至0.7±0.02。取4 mL ABTS+·工作液与10 μL不同浓度受试物混合,常温避光静置6 min,在734 nm波长处测定吸光度。
清除率(%)=[A0-Ai/A0]×100
(式中:A0为对照实验(蒸馏水水代替样品溶液)的吸光度;Ai为样品实验吸光度。)
1.2.5 数据处理 本实验采用IC50值作为评价抗氧化能力大小的指标。协同效果的评价采用等辐射分析法[12]。具体步骤如下:
(1)选择合适的IC50值。运用Probit回归分析做各样品(SS、L-Se-MSC、SEY、Ant和VE)的剂量-效应曲线,求得各物质单独的IC50值。
(2)采用(1)中相同的方法,求得复配后各组合的IC50 mix。
(3)根据等效公式计算IC50add。
IC50add=IC50A/[P1A+R×(P2B+P3C)]
注:式中:R为A、B、C三种抗氧化剂单独应用时的效价比,P1为抗氧化剂A在复配组中所占的比例;P2为抗氧化剂B在复配组中所占的比例,P3为抗氧化剂C在复配组中所占的比例。
(4)采用独立样本t检验来检验理论值与实验值之间的显著性。
(5)将三种药物的IC50 mix及95%置信区间分别绘制在三维坐标轴上,两两相连成等效相加面,将VEmix∶Antmix∶SEYmix分别为1∶1∶0、1∶1∶1、1∶1∶4、4∶1∶1、1∶4∶1比例测得的IC50 mix标在坐标轴上,点的位置由以下公式决定:
Z=SEYC/SEYS+VEC/VES+AntC/AntS
设SEYC/SEYS,VEC/VES,AntC/AntS是配方中富硒酵母、维生素E和紫萝卜提取物占各自IC50的分数,当SEYC/SEYS+VEC/VES+AntC/AntS=1时,为加和作用。当SEYC/SEYS+VEC/VES+AntC/AntS>1时为拮抗作用。若当SEYC/SEYS+VEC/VES+AntC/AntS<1时,为协同作用。
协同率:组合的协同率(%)=(抗氧化理论值-抗氧化实验值)×100/抗氧化理论值。
2 结果与讨论
2.1 不同形态硒、维生素E、紫萝卜提取物在三种模型中抗氧化能力的测定
实验测定了不同形态硒(L-Se-MSC、SS、SEY)、VE、Ant在三种抗氧化体系(DPPH,Fe3+还原,ABTS+·)中单独的抗氧化活性。由图1可知,L-Se-MSC和SS表现出的清除DPPH·、ABTS+·和还原Fe3+的能力都较弱,说明其体外抗氧化活性较低。这可能是由于L-Se-MSC和SS的抗氧化活性主要依赖于细胞膜上的酶,当Se作为体内抗氧化酶活性中心时能够产生抗氧化效应,在体外不能表现出来[13]。而SEY在生物体内能转化成大量的生物硒,故能表现出较强的抗氧化效应。因此实验选用SEY、VE和紫萝卜提取物作为组合,探究其抗氧化协同作用。

图1 不同抗氧化剂在三种模型中的抗氧化能力Fig.1 The effects of antioxidants on DPPH,Fe3+,ABTS+· models注:A:清除DPPH自由基能力;B:还原 Fe3+能力;C:清除ABTS+能力。
2.2 富硒酵母、维生素E和紫萝卜提取物在三种模型中抗氧化能力的测定
由表1可知,不同的模型中,抗氧化物的抗氧化能力是不一样的,IC50值越大,表示抗氧化能力越弱,IC50值越小,则抗氧化能力越强。在DPPH模型中,VE的IC50值最低,具有最强的抗氧化能力。在Fe3+中,Ant的抗氧化能力最强,在ABTS模型中,SEY的抗氧化能力最强。这可能是由于三种模型的抗氧化方法作用机理不一样而得到不同的结果。DPPH模型机理是在有机相中自由基接受抗氧化剂的活泼氢或电子而褪色,其抗氧化活性大小与酚羟基官能团的数目、溶剂的极性以及物质在溶剂中的溶解度有关[14]。在DPPH模型中,活性顺序为VE>Ant>SEY。这可能是因为VE和Ant都有酚羟基结构,但是Ant为粗提物,花色苷主要成分含量不高,同时花色苷也是水溶性物质,在有机相中的溶解度可能会使得Ant清除DPPH自由基的能力受到一定的限制。在Fe3+模型中,Fe3+在水相中获得由抗氧化剂提供的电子,进而被还原成Fe2+,测定抗氧化物质基于电子转移的抗氧化能力。在此实验中VE和Ant拥有高度电子离域的苯环结构,但是SEY 没有。因此它们的供电子能力为Ant>VE>SEY。ABTS模型机理是ABTS在适当的氧化剂作用下氧化成ABTS+·,在抗氧化物存在时ABTS+·的产生会被抑制。本实验结果显示,抗氧化能力顺序为SEY>Ant>VE。研究表明,ABTS法更适用于水溶性抗氧化混合物的测定[15]。有机硒富硒酵母的抗氧化活性可能来自其中的硒蛋白和硒多糖[16],为混合物,而Ant也为混合物只有VE是纯物质。综上所述,抗氧化机理不同,得到不同的实验结果。因此,要通过不同的实验模型共同评价抗氧化物的体外抗氧化能力。
表1 富硒酵母、维生素E和紫萝卜提取物在三种模型中抗氧化效果分析
Table 1 Effects of Se-enriched yeast,Vitamin E and extract from purple carrots on three anti-oxidant models
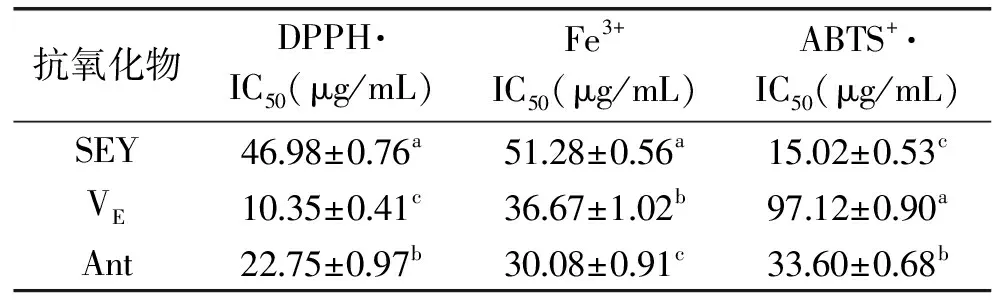
抗氧化物DPPH·IC50(μg/mL)Fe3+IC50(μg/mL)ABTS+·IC50(μg/mL)SEY4698±076a5128±056a1502±053cVE1035±041c3667±102b9712±090aAnt2275±097b3008±091c3360±068b
注:IC50值通过Probit法进行曲线拟合求得。a,b,c表示不同抗氧化物质种类间的成分及抗氧化活性在0.05 水平上的存在显著性差异。
2.3 富硒酵母、维生素E、紫萝卜提取物在3种体外化学模型中协同作用分析
表2 3种抗氧化剂复配后在DPPH模型中协同作用效果分析
Table 2 Synergistic DPPH free radical scavenging activity of three antioxidants
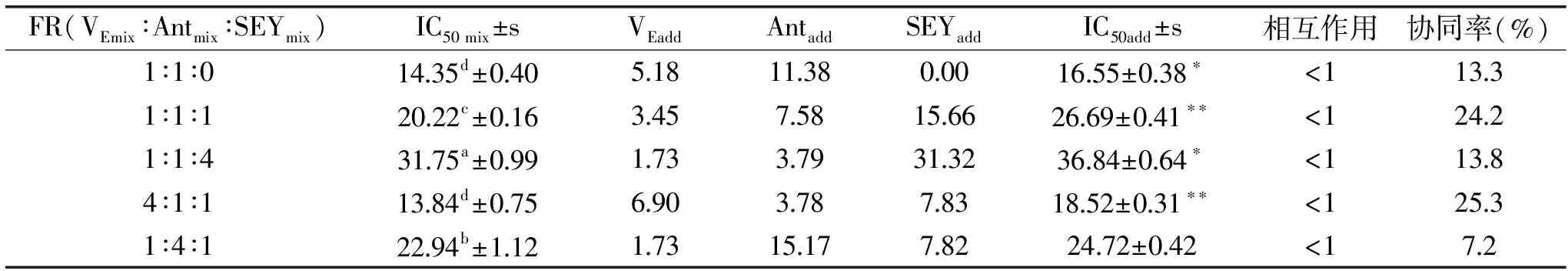
FR(VEmix∶Antmix∶SEYmix)IC50mix±sVEaddAntaddSEYaddIC50add±s相互作用协同率(%)1∶1∶01435d±04051811380001655±038∗<11331∶1∶12022c±01634575815662669±041∗∗<12421∶1∶43175a±09917337931323684±064∗<11384∶1∶11384d±0756903787831852±031∗∗<12531∶4∶12294b±11217315177822472±042<172
表3 3种抗氧化剂复配后在Fe3+还原模型中协同作用效果分析
Table 3 Synergistic Fe3+reducing power of three antioxidants

FR(VEmix∶Antmix∶SEYmix)IC50mix±sVEaddAntaddSEYaddIC50add±s相互作用协同率(%)1∶1∶03393c±045163415040003138±020∗>1-811∶1∶13541b±0801089100317093801±015∗<1681∶1∶44081a±02654550134194464±028∗∗∗<1864∶1∶13468bc±02521785018553534±018∗<1191∶4∶13337c±02654420058553405±021<130
表4 3种抗氧化剂复配后在ABTS+·模型中协同作用效果分析
Table 4 Synergistic ABTS free radical scavenging activity of three antioxidants

FR(VEmix∶Antmix∶SEYmix)IC50mix±sVEaddAntaddSEYaddIC50add±s相互作用协同率(%)1∶1∶0583a±012486168000656±020∗∗<11721∶1∶1204c±006324112051487±005∗∗∗<15811∶1∶4330b±017162056100319±008>1﹣344∶1∶1597a±015647056025729±006∗∗∗<11811∶4∶1312b±013162224025414±021<1246
注:在表2~表4中,IC50值通过 Probit 法进行曲线拟合求得。表中的单位均为μg/mL,采用one-way ANOVA分析,a、b、c表示在0.05 水平上的有显著性差异;理论值和实际值采用非配对T检验,***p<0.001,**p<0.01,*p<0.05;VEadd、Antadd、SEYadd 为复合配方中单一组分抗氧化剂理论上应该产生的效果;IC50 mix、IC50add分别为实验值和理论值;FR为配方质量比。
由表2~表4可知,不同比例的复配组合在同一抗氧化模型中存在差异。协同效应最佳的组合比例分别为:VEmix∶Antmix∶SEYmix=4∶1∶1(DPPH模型)、1∶4∶1(Fe3+模型)、1∶1∶1(ABTS+·模型)。同一模型中,以不同比例复配后,相同抗氧化因子的抗氧化协同作用也不同。比如:在DPPH实验中,5种比例配方的实际产生的抗氧化协同效应低于理论上所产生的抗氧化协同效应。不同比例混合的抗氧化因子的抗氧化活性不同,可能与各混合物中的植物化学物含量的不同有关。例如:阿魏酸、根皮素和维生素E以不同比例混合,其抗氧化相互作用也不同[17]。ABTS模型中,VEmix∶Antmix∶SEYmix为1∶1∶4的IC50 mix值(3.30±0.17)μg/mL,Fe3+还原模型中,VEmix∶Antmix∶SEYmix为1∶1∶0的IC50 mix值(33.93±0.45) μg/mL,两组的IC50 mix值均大于理论值,表现出抗氧化拮抗作用。ABTS模型中,SEY含量高时表现出拮抗作用,原因可能是抗氧化物AOH与另外的抗氧化物BOH反应生成AOH-BOH,使两种抗氧化剂的抗氧化活性双双降低,导致其从协同作用向拮抗作用转变,从而表现出拮抗作用。Fe3+还原模型中,当样品中含有还原电位比Fe3+低的抗氧化成分时,会影响它们的抗氧化相互作用,Ant为混合物,有可能会产生这样的结果。同时,相同的复配组合在不同模型中存在差异。在DPPH模型中,VE的含量越高,Ant含量越低,其复配后的抗氧化效应越强。这可能是因为VE的烷醇环第六位的羟基是活性基团,该羟基上的活泼氢可以捕获活性氧自由基,进而能切断自由基的连锁反应,表现出较强的抗氧化能力,从图1中也能得到相同的结论。而在ABTS+·模型中,结果有所不同。
SEY、VE和Ant联合使用后,具有一定的抗氧化协同作用,且协同作用的强弱受复配比例的影响。抗氧化协同作用机理的主要核心理论为抗氧化功效因子之间的相互再生作用。大多数理论认为,复合抗氧化功效因子之间可以通过相互修复,再生形成氧化还原循环系统,进而使复合抗氧化效果明显强于单一抗氧化剂[18-19]。紫萝卜提取物的主要成分是花色苷,花色苷抗氧化能力的强弱与其本身的结构有很大的关系:苷元母核B环上的3′,4′邻二酚羟基具有强的供氢能力,能够捕获自由基,具有较强的抗氧化能力;如果在A环的5,7,8位增加羟基的话可以不同程度的增加花色苷的抗氧化能力[20]。花色苷能与VE自由基发生氢原子转移反应,使VE再生[21],继而发挥抗氧化协同作用;SEY中的有效物质可以与VE交换电子从而使VE含量维持正常水平,并不断发挥抗氧化作用[22]。两种以上的抗氧化功效因子复合使用时,各种抗氧化剂也可能使体系中产生的游离基相互作用,生成新的酚类化合物继续发挥抗氧化作用,增强体系整体的抗氧化性能[23]。除此之外,也有报道认为[24]多种抗氧化功效因子之间存在基于氧化还原电位差的偶联氧化,可以降低直接反应的两种抗氧化功效因子之间的电位落差,使反应更容易进行。
3 结论
通过以上的实验数据分析,发现抗氧化物质之间的协同抗氧化作用与抗氧化评价方法的原理、抗氧化物质本身的抗氧化能力、抗氧化物质有效浓度等因素有关。SEY、VE和Ant联合使用具有一定的抗氧化协同作用,且协同作用的强弱受配方比例的影响,其中协同效应最佳的组合比例分别为:VEmix∶Antmix∶SEYmix=4∶1∶1(DPPH模型)、1∶4∶1(Fe3+模型)、1∶1∶1(ABTS+·模型)。
[1]赵晶,康世良. 健康仔猪口服亚硒酸钠后血液硒浓度与抗氧化系统动态变化规律的研究[J]. 畜牧兽医学报,2003(06):554-557.
[2]Keck A,Finley J W. Cruciferous vegetables:cancer protective mechanisms of glucosinolate hydrolysis products and selenium[J]. Integrative Cancer Therapies,2004,3(1):5-12.
[3]贾洪峰,贺稚非,刘丽娜. 富硒酵母的研究进展[J]. 四川食品与发酵,2005,41(3):8-12.
[4]姚昭,邓泽元,李红艳. 有机硒、无机硒、VE单独使用及有机硒与VE联用对大鼠体内抗氧化能力的影响[J]. 食品科学,2013,35(15):272-276.
[5]Niki E. Role of vitamin E as a lipid-soluble peroxyl radical scavenger:invitroandinvivoevidence[J]. Free Radical Biology and Medicine,2014:3-12.
[6]Aaby K,Skrede G,Wrolstad R E. Phenolic composition and antioxidant activities in flesh and achenes of strawberries(Fragaria ananassa)[J]. Journal of Agricultural and Food Chemistry,2005,53(10):4032-4040.
[7]Liu R H. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals[J]. The American journal of clinical nutrition,2003,78(3):517S-520S.
[8]纪宏新,张兴安. 等辐射分析法研究麻醉药物相互作用进展[J]. 中国药物与临床,2009(06):508-511.
[9]Luszczki J J,Antkiewicz-Michaluk L,Czuczwar S J. Isobolographic analysis of interactions between 1-methyl-1,2,3,4-tetrahydroisoquinoline and four conventional antiepileptic drugs in the mouse maximal electroshock-induced seizure model[J]. European Journal of Pharmacology,2009,602(2):298-305.
[10]孙玥. 食用抗氧化功效因子多组分相互作用评价和配方优化模型构建及应用[D]. 南昌:南昌大学,2012.
[11]周玮婧,隋勇,孙智达,等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学,2012(03):5-8.
[12]陈鸿,潘宁玲,王国林. 等辐射分析法的原理及应用[J]. 国外医学.麻醉学与复苏分册,2004(05):267-269.
[13]赵晶,康世良,王伟. 肌注亚硒酸钠后仔猪血硒浓度与抗氧化系统动态变化[J]. 动物医学进展,2002(06):93-95.
[14]Mishra K,Ojha H,Chaudhury N K. Estimation of antiradical properties of antioxidants using DPPH assay:A critical review and results[J]. Food Chemistry,2012,130(4):1036-1043.
[15]刘薇,邱乐,杨婧,等. ABTS与邻二氮菲-Fe3+法测定保健食品抗氧化能力比较分析[J]. 食品工业,2013(03):120-124.
[16]王菲,李梦一,叶淑红,等. 富硒酵母中硒蛋白的抗氧化性质[J]. 大连工业大学学报,2014(05):325-327.
[17]Zhang Q,Huang W,Lv X,et al. Puerarin protects differentiated PC12 cells from H2O2-induced apoptosis through the PI3K/Akt signalling pathway[J]. Cell Biology International,2012,36(5):419-426.
[18]Ip C,Thompson H J,Zhu Z,et al.Invitroandinvivostudies of methylseleninic acid:evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention[J]. Cancer Research,2000,60(11):2882-2886.
[19]吕锋. 紫萝卜花色苷的提取、结构、稳定性和抗氧化性研究[D]. 南昌:南昌大学,2007.
[20]Cai Y,Ma L,Hou L,et al. Antioxidant effects of green tea polyphenols on free radical initiated peroxidation of rat liver microsomes[J]. Chemistry and Physics of Lipids,2002,120(1):109-117.
[21]Thoo Y Y,Abas F,Lai O,et al. Antioxidant synergism between ethanolic Centella asiatica extracts andα-tocopherol in model systems[J]. Food chemistry,2013,138(2):1215-1219.
[22]Saucier C E D T,Waterhouse A L. Synergetic activity of catechin and other antioxidants[J]. Journal of Agricultural and Food Chemistry,1999,47(11):4491-4494.
[23]Djordjevic A,Spasic S,Jovanovic-Galovic A,et al. Oxidative stress in diabetic pregnancy:SOD,CAT and GSH-Px activity and lipid peroxidation products[J]. Journal of Maternal-Fetal and Neonatal Medicine,2004,16(6):367-372.
[24]Sargis R M,Subbaiah P V. Protection of membrane cholesterol by sphingomyelin against free radical-mediated oxidation[J]. Free Radical Biology and Medicine,2006,40(12):2092-2102.
Antioxidant synergy effectinvitroamong different forms of selenium,Vitamin E and purple carrot extract
ZHENG Shi-lian,PAN Yao,ZHANG Yun-long,DENG Ze-yuan,LI Hong-yan*
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Theantioxidanteffectsofindividualandcombinedthreekindsofseleniumincludingsodiumselenite(SS),L-Se-methylselenocysteine(L-Se-MSC),Se-enrichedyeast(SEY),VitaminE,anthocyaninextractsofpurplecarrotsweredeterminedbyDPPHradicalscavengingactivity,Fe3+reducingpowerandABTSradicalscavengingactivity.IsobolographicanalysiswasusedtocalculatetheactualantioxidantvalueinIC50 mixandevaluatethesynergisticantioxidanteffectofindividualandcombineddifferentformsselenium,VitaminEandpurplecarrotextract.TheresultsindicatedthatL-Se-MSCandSSpossessedlowantioxidantactivityin vitroantioxidantmodel,whileSEYpossessedhighantioxidantactivitywhichexhibitedsynergisticeffectwithVitaminE,anthocyaninextractsofpurplecarrots.Inthesamemodel,differentcombinationshaddifferenteffects.ThebestratioinDPPHmodelwasVEmix∶Antmix∶SEYmix=4∶1∶1,intheFe3+model,thebestonewasVEmix∶Antmix∶SEYmix=1∶4∶1andVEmix∶Antmix∶SEYmix=1∶1∶1wasthebestoneinABTS+·model.Inthesamecombination,differentfactorsshoweddifferenteffects.Thecombinationofseleniumyeast,vitaminE,andanthocyaninextractsofpurplecarrotshadsynergisticantioxidanteffects.
selenium;VitaminE;purplecarrotextract;antioxidants;synergisticeffect
2016-02-26
郑时莲(1990-),女,硕士研究生,主要从事天然产物活性方面研究,E-mail:zhengshilian07@163.com。
*通讯作者:李红艳(1986-),女,博士,副教授,主要从事天然产物方面的研究,E-mail:lihongyan61@gmail.com。
国家自然青年科学基金(31301433);江西省博士后科研项目(2013KY04)。
TS255.1
A
1002-0306(2016)19-0086-05
10.13386/j.issn1002-0306.2016.19.008

