啤酒腐败微生物与啤酒微生物稳定性研究进展
王 伟, 刘雅文, 谷凤霞, 孙 珍, 堵国成, 李宪臻*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.大连工业大学 生物工程学院,辽宁 大连 116034)
啤酒腐败微生物与啤酒微生物稳定性研究进展
王 伟1,2, 刘雅文2, 谷凤霞2, 孙 珍2, 堵国成1, 李宪臻2*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.大连工业大学 生物工程学院,辽宁 大连 116034)
尽管生产环境和卫生条件已经得到大幅改善,但啤酒生产过程中仍然会发生微生物污染,因此,真正意义上的啤酒纯种酿制是很难实现的。为了有效控制生产过程中的微生物污染,本文系统介绍了啤酒微生物的多样性及其在生产工序中的分布,探讨了啤酒环境对抑制啤酒微生物污染的影响,讨论了啤酒微生物对啤酒质量与风味的积极贡献,提出合理控制外源微生物侵染是形成不同啤酒典型特征的关键。
啤酒微生物;微生物稳定性;酿制;污染;酵母
虽然啤酒生产技术有了长足发展,但啤酒生产始终无法实现完全纯种酿造,生产过程中仍有可能发生微生物污染,导致啤酒质量不稳定[1]。工业化啤酒生产可以通过巴氏灭菌、过滤和低温储存等预防啤酒腐败,但微型啤酒生产和桶装啤酒则未经灭菌,需要特别关注啤酒的微生物稳定性。
1 啤酒微生物分类
根据啤酒腐败特征及其与啤酒质量的关系,可以将啤酒污染微生物分为专性啤酒微生物、潜在啤酒微生物、间接啤酒微生物、指示微生物和隐性微生物五类。
1.1 专性啤酒微生物
专性啤酒微生物能在啤酒环境中存活,无需较长适应时间就能在啤酒中生长繁殖,并使啤酒产生异味和混浊,严重影响啤酒质量。Lactobacillusbrevis、Lb.lindneri、Lb.brevisimilis、Lb.frigidus、Lb.coryniformis、Lb.casei、Pediococcusdamnosus、Pectinatuscerevisiiphilus、Pec.frisingensis、Megasphaeracerevisiae和Selenomonaslacticifex等属于该类微生物[2]。
1.2 潜在啤酒微生物
潜在啤酒微生物在正常情况下不能在啤酒中生长,但当啤酒处在高pH、低啤酒花浓度、低发酵度、低酒精度或高氧含量等特定条件下则能够生长,那些经暴露在啤酒中较长一段时间后能适应生长的微生物也包括在该类微生物中。Lb.plantarum、Lb.lactis、Lb.raffinolactis、Leuconostocmesenteroides、Micrococcuskristinae、Ped.inopinatus、Zymomonasmobilis和Z.raffinosivorans等属于该类微生物[2]。
1.3 间接啤酒微生物
间接啤酒微生物不能在成品啤酒中生长,但可在生产过程中的某些阶段生长,使啤酒产生异味。肠道菌和某些野生Saccharomyces菌以及某些好氧酵母等属于这类微生物,Obesumbacteriumproteus和Rahnellaaquatilis是啤酒酿造过程中最重要的肠杆菌腐败微生物[3]。
1.4 指示微生物
指示微生物不会引起啤酒腐败,但常伴随啤酒腐败菌一起生长,指示微生物的检出通常预示酿造过程中有啤酒腐败菌存在,表明酿造过程中的卫生状况发生问题。Acetobacterspp.、Acinetobactercalcoaceticus、Gluconobacteroxydans、Pantoeaagglomerans、Klebsiellaspp.和好氧野生酵母是这类微生物的代表[2]。
1.5 隐性微生物
隐性微生物是指啤酒酿造过程中偶尔能检测到,甚至在某些条件下能存活并能从成品啤酒中分离出来的一类微生物,这类微生物对啤酒质量不构成任何危害,通常是土壤/水源性微生物,是由水污染引起或在长期运行的生产线上逐渐形成。产孢细菌、肠杆菌、球菌和产膜酵母是典型的这类微生物[2]。如果检出频率过高,说明卫生状况有待改善。
2 啤酒微生物的多样性
迄今为止,仅发现有少数几类细菌能在啤酒这种恶劣条件下生长并使啤酒腐败,包括革兰阳性菌和阴性菌(表1)[4]。革兰阳性菌几乎都属于乳酸菌,对生产危害性最大,70%以上的啤酒腐败都与这类菌有关[3];革兰阴性菌Pectinatus和Megasphaera是导致啤酒腐败的第二主要微生物,因为现代啤酒技术已大幅降低了成品啤酒中的氧含量,这类严格厌氧菌在啤酒腐败中的作用正在逐渐增加;与细菌相比,野生酵母对啤酒腐败较不严重,但却很难从酿酒酵母中除去。

表1 啤酒微生物及其对啤酒质量的影响

续表1
注:“+”代表反应阳性;“-”代表反应阴性
2.1 乳酸菌(Lactic acid bacteria, LAB)
LAB是革兰阳性、非生孢子的杆菌或球菌,严格发酵型、兼性厌氧。啤酒LAB具有抗啤酒花活性,能在普通LAB无法存活的啤酒中生长,主要通过产生絮状物和形成酸味与非典型气味等使啤酒腐败[5]。最主要的啤酒LAB是Lb.brevis,能形成各种异味和芳香味并使啤酒混浊[6]; 其次是Ped.damnosus, 能产生双乙酰等各种不良风味[7]。
一般而言,啤酒花的存在可以保障革兰阳性菌不能在啤酒中生长,但某些LAB在适应啤酒花的过程中,进化出抗啤酒花基因horA和horC等,而在啤酒中生存并腐败啤酒[1]。horA和horC基因分别编码ATP依赖型和质子动势依赖型多药转运蛋白,赋予LAB啤酒花抗性。LAB的啤酒腐败能力与菌种状态相关[8],啤酒花抗性是唯一的种间差异,其典型特征是腐败菌和非腐败菌共存于同一类LAB中。
2.1.1 乳杆菌(Lactobacillus) 并不是所有乳杆菌都能在啤酒中生长,事实上,只有少数乳杆菌才能腐败啤酒[6]。Lb.brevis在啤酒生产过程中被检出的频率较高[6],是专性异型发酵菌,一般对啤酒花具有抗性。Lb.lindneri是仅次于Lb.brevis的啤酒腐败乳杆菌,大约15%~20%的啤酒腐败是由其引起的[3],该菌对啤酒花具有高抗性,耐热温度比其他LAB高。与上述两菌相比,Lb.buchneri、Lb.casei、Lb.coryneformis、Lb.curvatus和Lb.plantarum则是不常见的啤酒腐败LAB[9],Lb.brevisimilis、Lb.malefermentans、Lb.parabuchneri、Lb.collinoides和Lb.paracaseisubsp.paracasei也曾经被报道是啤酒腐败LAB[9]。
2.1.2 小球菌(Pediococcus)Pediococcus是革兰阳性球菌,同型发酵,能在啤酒中生长并产生丝状物和大量双乙酰,存在于从麦汁到成品啤酒的各个酿造环节。生产中已发现的小球菌包括Ped.acidilactici、Ped.damnosus、Ped.dextrinicus、Ped.halophilus、Ped.inopinatus、Ped.Parvulus和Ped.pentosaceus[5],其中,Ped.damnosus是最常见的啤酒腐败菌,能够抗啤酒花,通常在啤酒和后酵过程中出现,很少在接种酵母中被检出。而Ped.inopinatus则经常在接种酵母中被检出,但很少在发酵过程的其他阶段发现[2]。Ped.inopinatus和Ped.dextrinicus能在高于pH 4.2和低酒精、低啤酒花浓度的啤酒中生长,但从未发现Ped.pentsaceus和Ped.acidilactici会影响成品啤酒的质量[2]。
2.2 醋酸菌(Acetic acid bacteria)
醋酸菌有10个属,与啤酒腐败有关的主要是G.oxydans[10]。因为能将酒精氧化为乙酸,醋酸菌能在高酒精度中生存,并产生尖酸的异味和芳香味。醋酸菌污染大都发生在灌装线上,且与氧通量有关。在灌装和过滤工序中,70%污染微生物是A.pasteurianussubsp.pasteurianus,在发酵过程和清酒罐中也偶尔发现有Acetobacter和Gluconobacter污染[1]。
2.3 肠杆菌(Enterobacteriaceae)
只有少数肠杆菌偶尔会被发现与啤酒酿造相关,如O.proteus、R.aquatilis和Citrobacterfreundii[10]。O.proteus通过产生乙偶姻、乳酸、丙醇、DMS、异丁醇和2,3-丁二醇腐败啤酒和麦汁[11],一般只在接种酵母中发现,且在发酵前24 h具有重要影响,用污染有O.proteus的酵母酿造的啤酒会产生一种欧洲防风草样或水果异味[3]。Cb.freundii和R.aquatilis通过产生双乙酰、二甲基硫化物、乙偶姻、乙醛、乳酸和2,3-丁二醇等形成的各种异味和芳香物而影响啤酒质量[2],这些化合物的产生总是发生在发酵的开始阶段。Enterobacteragglomerans也是一种污染接种酵母的腐败菌,能够延迟发酵过程,当麦汁被E.agglomerans污染后,所酿啤酒会含有不正常的高水平双乙酰和二甲硫醚[3]。
2.4 发酵单胞菌属(Zymomonas)
Z.mobilis是发酵单胞菌中第一个分离到的啤酒腐败菌,耐氧性厌氧,在pH 3.4以上和酒精浓度(体积分数)10%以下生长,一般都在灌装阶段被发现[12]。因为发酵过程中产生高水平的乙醛和硫化氢,通常使啤酒具有果味和硫化物味特征,其啤酒腐败活性与Pectinatus菌相似[10]。
2.5 果胶杆菌(Pectinatus)
果胶杆菌是严格厌氧的革兰阴性菌,能产生大量乙酸、丙酸和乙偶姻而使啤酒混浊[10],已在很多啤酒生产线上分离到这类菌,大约在20%~30%微生物污染中起主要作用,特别是在非巴氏杀菌的啤酒中[13]。目前已确认的有Pec.cerevisiiphilus、Pec.frisingensis和Pec.haikarae,它们因形成各种脂肪酸、硫化氢和甲硫醇等,使啤酒混浊并有类似臭鸡蛋的难闻气味[13],主要感染未经巴氏杀菌的啤酒。
2.6巨型球菌(Megasphaera)
巨型球菌是严格厌氧的革兰阴性菌,腐败特征是混浊,并形成大量丁酸和少量乙酸、异戊酸、己酸与乙偶姻[14]。这类菌只在发酵开始阶段出现,当酒精浓度高于2.8%时抑制生长,但酒精浓度高于5.5%时才完全不生长。巨型球菌一般都与果胶杆菌同时出现,大约与3%~7%的啤酒腐败有关[14]。由于现代灌装技术大幅降低了成品啤酒中的氧含量,由Megasphaera和Pectinatus引起的啤酒腐败正呈上升趋势。目前已发现M.cerevisiae、M.paucivorans和M.sueciensis与啤酒腐败有关[13],与Pectinatus菌一样,所产硫化氢会使啤酒有一种粪便气味[13],主要感染低酒精度的非巴氏杀菌啤酒。
3 啤酒微生物分布
来自于酵母与麦汁原料、发酵与熟化过程或生产设备等的微生物污染为初次污染,来源于灌装过程的微生物污染为二次污染。50%以上的啤酒腐败都是二次污染引起的,但初次污染所引起的啤酒腐败则更为严重[15]。啤酒制造过程中各个阶段可能出现的啤酒微生物见图1。

图1 啤酒微生物及其在酿造工艺中可能出现的阶段Fig.1 Beer microorganisms in the different stage of the brewing process
3.1 大麦和麦汁
麦汁中的微生物主要来源于麦田、储存过程和麦汁加工过程,包括植物品种、气候、土壤、储存和运输等都会影响大麦和麦汁中的微生物种类[15]。Fusariumgraminearum和F.culmorum产霉菌毒素在酿造过程中无法剔除或降解,会留存在成品啤酒中[15]。大麦中的微生物群落因收获后管理措施的不同而有很大差异,大麦表面的微生物通过形成致密的生物膜,能提高对干燥、加热和抗生素等的耐性[15]。表2列出了收获后大麦中常见的微生物种类[15]。
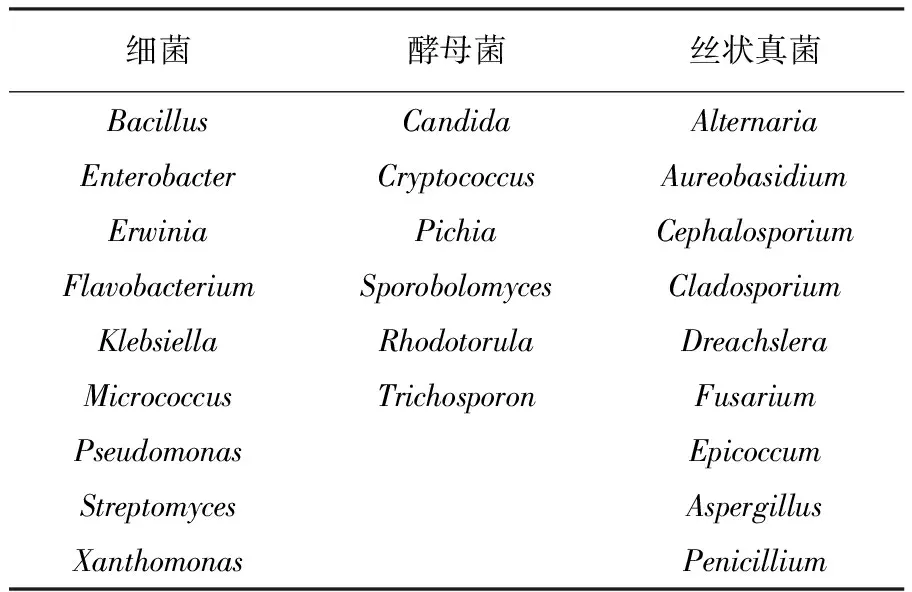
表2 收获后大麦中常见微生物
3.2 糖化和麦汁分离
如果糖化温度下降或未加酒花麦汁保持在60 ℃以下,嗜温菌会在糖化过程中繁殖。大多数LAB因对啤酒花敏感而不能在加入啤酒花的麦汁中存活,但之前生长的LAB会使麦汁含有令人不快的异味[4]。Bacillus的孢子会存留在麦芽和谷物等辅料中,在麦芽煮沸过程中能存活下来。研究发现B.coagulans在55~70 ℃的甜麦汁中放置2 h会产生大量乳酸,并与亚硝胺形成有关[16]。当用污染有R.aquatilis的麦汁生产啤酒时,成品啤酒中能检测到异常水平的双乙酰和双甲基硫化物[2]。
3.3 发酵
野生酵母是发酵过程常见污染菌之一,分为非Saccharomyces和Saccharomyces菌,会使啤酒产生混浊、异味和芳香等异常状况[1],发酵过程污染的非Saccharomyces菌主要包括Brettanomyces、Candida、Debaryomyces、Dekkera、Filobasidium、Hanseniaspora、Kluyveromyces、Pichia、Torulaspora和Zygosaccharomyces等。同型发酵Ped.damnosus是在酿酒酵母和啤酒中最常见的球菌污染物,但Ped.inopinatus常发现在酿酒酵母中,很少在发酵过程的其他阶段检出,这类菌能使啤酒含有高双乙酰并延长发酵时间[3]。革兰阴性厌氧菌S.lacticifex和Zymophilusraffinosivorans也存在于酿酒酵母中,是啤酒腐败菌。在酿酒酵母中存在的O.proteus和R.aquatilis抑制发酵并使啤酒形成高pH值。在发酵早期被Enterobacteriaceae属中的某些菌污染的酿酒原料与游离氨基酸脱羧形成生物氨有关[17]。
3.4 灌装
在非巴氏灭菌的成品啤酒中,20%~30%啤酒腐败都是由Pectinatus菌引起的,在麦汁和瓶装啤酒中会产生大量乙酸和丙酸以及乙偶姻,其啤酒腐败的典型特征是混浊和因硫化氢和甲硫醇形成的臭鸡蛋味[10]。7%以上的啤酒腐败是由Megasphaera引起的,M.cerevisiae是目前发现该属中唯一能引起啤酒腐败的菌[10],尽管有报道该菌能在5.5%酒精中生长,但在pH低于4.1和酒精浓度高于2.8%时生长常被抑制,该菌引起的啤酒腐败通常会产生大量丁酸和小量乙酸、硫醇、异戊酸和戊酸,以及乙偶姻和硫化氢,后者会使啤酒产生难闻的气味[10]。尽管LAB包含很多属,但能引起啤酒腐败的很少,Lactobacillus和Pediococcus对啤酒质量危害最大,会产生不愉快的酸味和非典型气味等,啤酒腐败LAB也与生物胺产生有关[16]。
3.5 成品啤酒
Lb.brevis是成品啤酒中最普遍存在的腐败菌,具有抗啤酒花能力[3]。由于能发酵糊精和淀粉,会导致啤酒混浊和高消糖度,在成品啤酒中形成高双乙酰含量,是啤酒腐败中需要特别关注的污染菌[5]。Lb.lindneri也是成品啤酒中常见污染菌,约占成品啤酒腐败的15%~20%[12]。其他导致成品啤酒腐败的乳杆菌还有Lb.buchneri、Lb.casei、Lb.collinoides、Lb.coryneformis和Lb.plantarum,但这些异型发酵LAB远没有Lb.brevis或Lb.lindneri常见[12]。
Pediococci污染会使啤酒粘附性增加,最常见的是具有啤酒花抗性并高产双乙酰的Ped.damnosus[5],Ped.inopinatus和Ped.dextrinicus也能够在pH 4.2以上且低酒精、低啤酒花浓度的啤酒中生长[3]。成品啤酒中也发现有Ped.claussenii[3],但随着卫生条件的改善,Pediococcus菌引起的啤酒腐败正逐渐下降。
Kocuriakristinae是非典型啤酒腐败菌,能在低酒精与低啤酒花浓度和高于pH 4.5的啤酒中生长,产生水果型非典型芳香[3]。
4 啤酒的微生物稳定性
啤酒对绝大多数微生物都是一种极度贫乏和恶劣的生存环境,对腐败微生物具有天然抗性,包括4%~5%酒精浓度、pH 3.8~4.7酸性条件、高CO2浓度与极低氧含量的厌氧环境、低含量糖与氨基酸等营养物。啤酒也含有啤酒花苦味酸,对革兰阳性菌有毒性。
啤酒中的酒精能通过增加质子进入细胞质的通路,改变细胞膜透性,使细胞无法保持体内pH平衡,从而增强细胞对低pH的敏感性[18]。低pH能强化弱有机酸进入胞内的能力,导致胞内酸化,破坏胞内酶系统并使营养吸收减少,引起代谢衰竭。低pH也与啤酒花抗菌性表现协同作用[7],因为啤酒花抗菌活性随pH降低而增加,一般认为pH每降低0.2能增大50%的啤酒花抗菌活性[5]。很多病原菌在典型的啤酒pH条件下都不能生长,仅有Yersiniaenterocolitica、Staphylococcusaureus、C.botulinum和Salmonellaspp.能在啤酒的pH水平下生长[19],而且,即使能在这种低pH下生长,啤酒中的其他抑菌因子如乙醇、啤酒花、CO2等也能保证这些病原菌不能存活。
降低啤酒中的氧含量,不仅能提高啤酒化学稳定性,也能降低很多病原菌生长的可能性[19]。CO2能通过各种机制抑制病原菌生长:形成厌氧环境以排除好氧病原菌生长、使pH降低从而影响羧化和脱羧化反应等。营养缺乏也对微生物污染产生抑制作用,因为游离氨基氮、总可溶氮和麦芽三糖的水平增加,明显提高细菌生长活性[20]。在啤酒生产过程中加入啤酒花的目的是为了赋予啤酒一种特殊的苦味和芳香,但是,啤酒花中很多化合物如蛇麻酮、葎草酮、异葎草酮和蛇麻酸已被证明能够诱导B.subtilis的细胞膜泄漏[5],导致糖和氨基酸过膜的主动转运被抑制,使呼吸中断和蛋白质、DNA与RNA合成终止。啤酒花不仅能影响质子动势的损耗,也能使二价阳离子在啤酒花敏感细胞中受约束,进一步抑制细胞代谢[1]。啤酒花苦味酸在提高微生物稳定性方面起主要作用[5],能够保护啤酒免受包括病原菌等大部分微生物感染,但其仅能抑制革兰阳性菌,对革兰阴性菌无效。
5 啤酒微生物的积极作用
一直以来,有两个重要观念始终贯穿于啤酒生产过程:一个是啤酒生产是纯种酿造,另一个是啤酒生产务必要保证无菌过程。但是,正如前面所讨论的,啤酒微生物始终伴随在啤酒生产过程中,即使再洁净的卫生环境也无法避免啤酒酵母之外的微生物侵染。
事实上,不是所有啤酒微生物都对啤酒酿造具有负面作用,Hartnett等[21]从大麦中分离到6株能够合成某些细菌素的LAB,研究发现这些细菌素能够抑制酿造过程中的啤酒腐败菌。由大麦等啤酒原辅料带来的这些LAB,不仅能防治制麦和糖化过程中的微生物污染,而且在麦汁煮沸过程中被杀死,但所产生的细菌素由于其自身的热稳定性与pH稳定性和对啤酒酵母无作用,可以在发酵过程中继续发挥抗微生物活性,以防止后续的麦汁和啤酒被腐败微生物污染。研究也发现这些细菌素由于是小分子肽,对啤酒风味不产生任何不利作用。乳酸菌Lb.fermenti、Lb.helveticus、Lb.acidophilus和Lb.plantarum能产生细菌素,其中的一些细菌素对B.cereus、Sc.aureus、C.botulinum、C.perfringens、C.dificile和Listeriamonocytogenes等病原菌具有抑菌活性[22]。
由大麦表面带入的丝状真菌能产生各种水解酶,比如,大麦表面污染微生物Rhizopusoligosporus产生β-葡聚糖酶、木聚糖酶和蛋白酶,但淀粉降解能力并没有增加[23],因此,在制麦过程中能够改善麦芽糖化效果,提高麦汁浸出率和氨基酸含量,进而明显改善啤酒发酵特性。
迄今在腐败啤酒中分离到的啤酒微生物中,60%~90%都是LAB,尤以Lb.brevis最常见[1,9],但并非所有LAB都是啤酒腐败菌。某些LAB能通过其代谢特性,直接或间接影响酿造过程,以改善啤酒品质、安全性和风味等[22]。糖化过程中由大麦引入的某些LAB菌因产酸而降低pH,有利于麦芽糖化,因为正常情况时的pH值为5.7~5.75,不利于糖化酶如β-葡聚糖酶(4.5~4.8)、 α-淀粉酶(5.3~5.7)、 β-淀粉酶(5.1~5.3)和羧肽酶(4.5~4.6)等发挥作用,由LAB引起糖化醪酸化的优点包括较高的发酵极限、更宽的蛋白降解和更短的过滤时间,同时还可以改善啤酒苦味、双乙酰还原、啤酒色泽和风味稳定性等[24]。
某些LAB中具有蛋白水解体系,能催化蛋白质水解为短肽和游离氨基酸,直接或间接成为风味物质的前体,同时也为酵母发酵产酒精提供足够的氮源[25],其中的精氨酸氨肽酶还能水解苦味肽以释放出芳香族氨基酸,为香味化合物的形成提供前体物质。
某些Lb.brevis能将大麦等细胞壁中的半纤维素聚糖水解利用,而另一些Lb.brevis能够同时发酵大多数不同的糖质化合物,比如,核糖和葡萄糖、麦芽糖和果糖等可同时被利用,大幅降低啤酒中的不可发酵糖的含量,提高啤酒发酵度[26]。生物胺由于其对人体的危害性,是影响啤酒质量的重要物质,研究发现,某些乳杆菌如Lb.plantarum能够通过胺氧化酶降低生物胺在啤酒中的含量[27],因此,酿造过程中的Lb.plantarum对于啤酒生产是有利的。酿造过程中的某些Lactobacillus菌也能通过产生抗生素物质,控制病原菌污染[28-29]。
6 展 望
啤酒酿造过程中的微生物污染是无法避免的,有些啤酒微生物来源于啤酒原辅料,有些来源于啤酒酿造过程中的生产环境;有些啤酒微生物对啤酒酿造是有害的,会引起啤酒腐败,但有些是有益的,可以改善啤酒质量。事实上,对啤酒腐败微生物的传统定义是能够在啤酒环境中生长而导致啤酒产生异味和混浊的微生物,研究发现某些污染微生物能够改善啤酒风味或抑制有害微生物在啤酒中生长。维持某些啤酒微生物在啤酒生产工艺中的稳定生长,可以保持品牌啤酒的特定风味,对于啤酒生产是有利的。因此,绝对的纯种酿造工艺无法实现品牌啤酒间的差异性,而不同地域、不同生产厂的特殊生产环境所形成的特定混菌发酵,才是形成不同啤酒典型特征的关键。所以,有关啤酒微生物研究应更加关注如何有效控制合理的外源微生物侵染与啤酒风味的相互影响。
[1] Suzuki K. 125th Anniversary review: microbiological instability of beer caused by spoilage bacteria[J]. J I Brewing, 2011, 117(2): 131-155.
[2] Vaughan A, O'Sullivan T F, Sinderen D. Enhancing the microbiological stability of malt and beer[J]. J I Brewing, 2005, 111(4): 355-371.
[3] Hollerová I, Kubizniaková P. Monitoring gram-positive bacterial contamination in Czech breweries [J]. J I Brewing, 2001, 107(6): 355-358.
[4] Sakamoto K, Konings W N. Beer spoilage bacteria and hop resistance[J]. Int J Food Microbiol, 2003, 89(2): 105-124.
[5] Suzuki K, Iijima K, Sakamoto K, et al. A review of hop resistance in beer spoilage lactic acid bacteria[J]. J I Brewing, 2006, 112(2): 173-191.
[6] Lin J, Cao Y, Sun J, et al. Monitoring spoilage bacteria and wild yeasts in eastern Chinese breweries[J]. J Am Soc Brew Chem, 2008, 66(1): 43-47.
[7] Menz G, Vriesekoop F, Zarei M, et al. The growth and survival of food borne pathogens in sweet and fermenting brewers’wort [J]. Int J Food Microbiol, 2010, 140(1): 19-25.
[8] Suzuki K, Sami M, Ozaki K, et al. Genetic characterization of hop-sensitive variants obtained from beer-spoilageLactobacillusbrevis[J]. J Am Soc Brew Chem, 2005, 63(1): 11-16.
[9] Menz G, Andrighetto C, Lombardi A, et al. Isolation, identification and characterization of beer-spoilage lactic acid bacteria from microbrewed beer from Victoria, Australia[J]. J I Brewing, 2010, 116(1): 14-22.
[10]van Vuuren H J J, Priest F G. Gram-negative brewery bacteria. In: Priest F G, Campbell I. Brewing Microbiology[M]. New York: Kluwer Academic/Plenum Publishers, 2003: 219-245.
[11]Priest F G, Barker M. Gram-negative bacteria associated with brewery yeasts: reclassification ofObesumbacteriumproteusbiogroup 2 asShimwelliapseudoproteusgen. nov., sp. nov., and transfer ofEscherichiablattaetoShimwelliablattaecomb. nov. [J]. Int J Syst Evol Microbiol, 2010, 60(4): 828-833.
[12]Stewart G G. Beer stability. In: Priest F G, Stewart G G. Handbook of Brewing[M]. Boca Raton: Taylor E Francis Group, 2006: 715-726.
[13]Paradh A D, Mitchell W J, Hill A E. Occurrence ofPectinatusandMegasphaerain the major UK breweries [J]. J I Brewing, 2011, 117(4): 498-506.
[14]Juvonen R, Suihho M L.Megasphaerapaucivoranssp. nov.,Megasphaerasueciensissp. nov. andPectinatushaikaraesp. nov., isolated from brewery samples, emended description of genusPectinatus[J].Int J Syst Evol Microbiol, 2006, 56(4): 695-702.
[15]Bokulich NA, Bamfortha CW. The microbiology of malting and brewing [J]. Microbiol Mol Bio Rev, 2013, 77(2): 157-172.
[16]Kalac P, Krízek M. A review of biogenic amines and polyamines in beer [J]. J I Brewing, 2003, 109(2): 123-128.
[17]Gasarasi G, Kelgtermans M, Verstrepen K J, et al. Occurrence of biogenic amines in beer: causes and proposal remedies [J]. Monatsschriftfur Brauwissenschaft, 2003, 56(3-4): 58-63.
[18]Barker C, Park S F. Sensitization ofListeriamonocytogenesto low pH, organic acids, and osmotic stress by ethanol [J]. Appl Environ Microbiol, 2001, 67(4): 1594-1600.
[19]Vriesekoop F, Krahl M, Hucker B, et al. 125th Anniversary review: bacteria in brewing: the good, the bad and the ugly [J]. J I Brewing, 2012, 118(4): 335-345.
[20]Menz G, Aldred P, Vriesekoop F. Pathogens in beer. In: Preedy V R. Beer in Health and Disease Prevention [M]. Amsterdam: Academic Press, 2009: 403-413.
[21]Hartnett DJ, Vaughan A, van Sinderen D. Antimicrobial-producing lactic acid bacteria isolated from raw barley and sorghum [J]. J I Brewing, 2002, 108(2): 169-177.
[22]Lowe D P, Arendt E K. The use and effects of lactic acid bacteria in malting and brewing with their relationships to antifungal activity, mycotoxins and gushing: a review [J]. J I Brewing, 2004,110(3):163-180.
[23]Noots I, Derycke V, Jensen H, et al. Studies on barley starchy endosperm cell wall degradation by Rhizopus VII [J]. J Cereal Sci, 2003, 37(1): 81-90.
[24]Rhee SJ, Lee JE, Lee CH. Importance of lactic acid bacteria in Asian fermented foods [J]. Microb Cell Fact, 2011, 10(S1): S5.
[25]Nandan A, Gaurav A, Pandey A, et al. Arginine specific aminopeptidase fromLactobacillusbrevis[J]. Braz Arch Biol Technol, 2010, 53(6): 1443-1450.
[26]Michlmay H, Hell J, Lorenz C, et al. Arabinoxylan oligosaccharide hydrolysis by family 43 and 51 glycosidases fromLactobacillusbrevisDSM 20054 [J]. Appl Environ Microbiol, 2013, 79(21): 6747-6754.
[27]Capozzi V, Russo P, Ladero V, et al. Biogenic amines degradation byLactobacillusplantarum: toward a potential application in wine [J]. Front Microbiol, 2012, 3: 122.
[28]Yang Z, Jin C, Gao L, et al. Alleviating effects ofLactobacillusstrains on pathogenicVibrioparahaemolyticus-induced intestinal fluid accumulation in the mouse model [J]. FEMS Microbiol Lett, 2013, 339(1): 30-38.
[29]Wada T, Noda M, Kashiwabara F, et al. Characterization of four plasmids harboured in aLactobacillusbrevisstrain encoding a novel bacteriocin, brevicin 925A, and construction of a shuttle vector for lactic acid bacteria andEscherichiacoli[J]. Microbiology, 2009, 155(5):1726-1737.
Advance in Beer Spoilage Microbes and Microbiological Stability of Beer
WANG Wei1,2, LIU Ya-wen2, GU Feng-xia2, SUN Zhen2, DU Guo-cheng1, LI Xian-zhen2
(1.Schl.ofBiotech.,JiangnanUni.,Wuxi214122;2.Schl.ofBio-Engin.,DalianPolytech.Uni.,Dalian116034)
Microbial beer-spoilage incidents still can happen during some stages of the production process despite of the environment and hygienic conditions in the brewery has been improved greatly, therefore, it is difficult to realize pure yeast beer brewing in real meaning. In order to effectively control the microbial contamination in the beer production, the microbial diversity in beer and the distribution of microbial sources in production working processes were introduced systematically in this paper. The effects of beer environment to contain microbial contamination was investigated, and the positive contribution of beer microbes on beer quality and flavor was discussed, and put forward that reasonably control foreign microbial invasion is the key of the formation of the typical characteristics of beer.
spoilage microbes; microbiological stability; brew; contamination; yeast
国家自然科学基金项目(31371742);公益性行业(农业)科研专项(201303095);大连市科技计划项目(2013B11NC078)
王伟 男,博士研究生。研究方向为啤酒微生物。Tel: 0411-86318769,E-mail: dlww98@163.com
* 通讯作者。男,教授,博士生导师。主要从事微生物资源与生物催化研究。Tel: 0411-86323717, E-mail: xianzhen@mail.com
2015-01-04;
2015-03-22
Q93
A
1005-7021(2016)01-0080-09
10.3969/j.issn.1005-7021.2016.01.014

