骨髓单个核细胞体外培养诱导分化为脂肪细胞
周 芳,王金祥,李自安,刘菊芬,白盈盈,杨建勇,朱光旭,潘兴华
骨髓单个核细胞体外培养诱导分化为脂肪细胞
周 芳,王金祥,李自安,刘菊芬,白盈盈,杨建勇,朱光旭,潘兴华
目的体外培养骨髓单个核细胞(BMNCs),并观察其成脂肪细胞分化能力。方法无菌取SD大鼠骨髓制作细胞悬液,差速贴壁法培养第三次贴壁细胞,传代扩增,取3~5代细胞用于实验。流式细胞分析检测CD34、CD44、CD45、CD90、CD144 (VE-cadherin)和血管内皮细胞生长因子受体-2(KDR)表达;STEMPROAdipogenesis Differentiation Kit检测细胞成脂肪分化能力。结果通过差速贴壁法可获得相对单一的BMNCs,流式细胞分析表明培养的BMNCs细胞表达CD34、CD44、CD45及CD90等表面标志,但不表达CD144和KDR;在未经诱导的情况下,培养的BMNCs能自发分化为脂肪细胞;培养BMNCs成脂肪细胞诱导后在第3、5、7 d,成脂率分别为(22.4±3.8)%、(55.6±11.4)%以及(82.4±17.7)%,显著高于诱导培养第1 d[(1.3±1.1)%,P<0.01]。结论骨髓单个核细胞体外培养后可以诱导分化为脂肪细胞。
骨髓单个核细胞;间充质干细胞;脂肪细胞分化
人脂肪细胞在整个成年期都存在更新换代,具有脂肪分化潜能的干、祖细胞的持续性供应对于维持脂肪生成极其重要。最新研究表明,骨髓源性干细胞(BBSCs)可参与脂肪生成。对于一般患者,BSCs对皮下脂肪细胞的贡献率大约占10%,对于肥胖患者则可高达25%,证明至少在骨髓移植患者,骨髓可以被认为是脂肪前体细胞的储存库[1]。骨髓间充质干细胞(BMSCs)可向脂肪细胞分化,然而其向脂肪细胞分化能力并不一致,甚至有文献报道人原代培养的BMSC在体外诱导时,绝大部分细胞并不能分化为脂肪细胞[2],因此,除了BMSCs外,骨髓内其他细胞极可能也具有脂肪细胞分化潜能。本实验利用差速贴壁法获得相对单一的骨髓单个核细胞(BMNCs),经体外培养后研究其成脂肪细胞分化能力,以期为脂肪生成和脂肪组织再生研究提供理论和技术参考。
1 材料与方法
1.1 实验材料 昆明医科大学实验动物中心[许可证号:SCXK(滇)K2015-0002]提供的1~2月龄雄性SD大鼠。DMEM/F12干粉培养基 (Hyclone公司),STEMPROAdipogenesis Differentiation Kit(Gibco),优质胎牛血清(PAA公司),内皮生长因子添加剂(ECGs,Millipore),内皮基础培养基 -2(EBM-2,Lonza),4’,6-二脒基-2-苯基吲哚(DAPI,Sigma),CO2培养箱 (Harris公司),流式细胞分析仪(FACScan, Becton Dickinson),倒置荧光相差显微镜(Leica)。
1.2 实验方法
1.2.1 细胞培养 脱臼处死1~2月龄雄性SD大鼠,无菌取髓制作细胞悬液,EBM-2培养基差速贴壁法培养第三次贴壁细胞,传代扩增,取3~5代(P3)细胞用于实验。
1.2.2 流式细胞分析 取P3细胞制作细胞悬液,与相应抗体混合,4℃孵育45 min,加入冷PBS 1 ml,洗涤2次,再加入冷PBS 500 μl,混匀,放入流式管中,4℃避光保存。对非直接荧光标记抗体,用冷PBS稀释第一抗体,4℃孵育1.5 h,离心弃上清;加入第二抗体,4℃孵育避光30 min,将细胞重新悬浮于500 μl PBS中混匀,放入流式管中,4℃避光保存,用流式细胞分析仪检测。
1.2.3 成脂肪细胞分化 收集P4细胞,接种到12孔板中,培养至细胞100%甚至过度融合时,弃培养液,加入成脂肪分化诱导液培养,用4%多聚甲醛固定,加入油红O染色。为进行细胞成脂肪细胞百分率计算,采用DAPI标记细胞核,计算公式为:脂肪细胞百分率=(油红O染色阳性细胞数÷细胞总数)× 100%。
1.3 统计学方法 应用SPSS10.0统计软件包进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 BMNCs的体外培养及生长特征 由于骨髓内不同细胞的贴壁时间和营养要求不同,因此,通过差速贴壁可以达到初步纯化细胞的目的。应用DMEM/F12和EBM-2培养基分别培养第一次贴壁细胞(FACs)、第二次贴壁细胞(SACs)和第三次贴壁细胞(TACs),48 h后观察培养细胞状态,EBM-2培养的PACs(图1A)密度明显高于DMEM/F12培养组(图1D);DMEM/F12培养基培养的SACs见有少量形态已发生改变的细胞生长(图1E),而EBM-2培养组可见少量梭形细胞和大量形态尚未发生改变的细胞(图1B);对于TACs,EBM-2培养可见大量形态未发生改变的贴壁细胞 (图1C),DMEM/F12组几乎未见贴壁生长细胞(图1F)。TACs培养4~6 d(图1G和H),大量细胞形态发生改变,主要呈长三角形或“海虾样”形状,至约第10 d,细胞呈融合生长状态(图1I)。
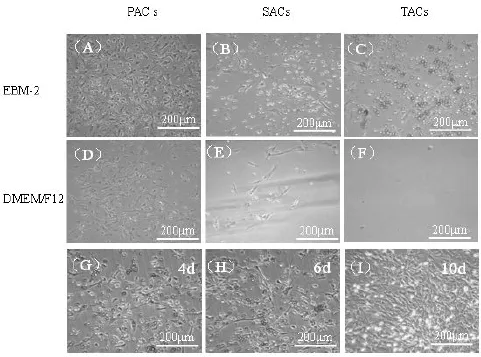
图1 骨髓单个核细胞的体外培养以及生长特征
2.2 培养BMNCs表面标志表达分析 流式细胞分析表明,培养的BMNCs细胞CD34表达率为(86.6±6.7)%,CD44为(92.1±7.9)%,CD45为(88.4± 3.6)%,CD9为(81.3±7.8)%,几乎不表达CD144(VE-cadherin)和血管内皮细胞生长因子受体-2(VEGFR-2)(也称KDR)(图2)。
2.3 BMNCs向脂肪细胞诱导分化 在未经诱导的情况下,BMNCs原代培养第4 d,发现少数培养的BMNCs疑似自发分化为脂肪细胞(图3A和B)。在成脂肪细胞分化诱导的条件下,诱导培养第1 d,有少量脂肪细胞出现,在第3、5、7 d,BMNCs成脂率分别为(22.4±3.8)%、(55.6±11.4)%以及(82.4±17.7)%,显著高于诱导培养第1 d(P<0.01)。
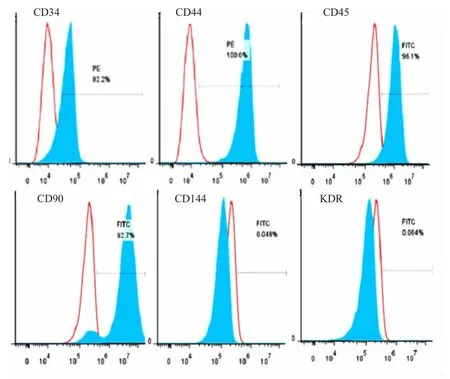
图2 细胞表面标志表达的流式细胞分析
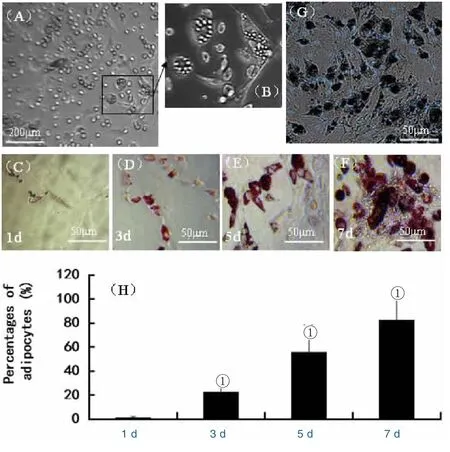
图3 培养的BMNCs向脂肪细胞诱导分化
3 讨论
脂肪组织在人能量平衡中发挥着关键作用,而成熟脂肪细胞不能通过有丝分裂增殖,增生是通过脂肪细胞前体细胞以及干、祖细胞分化得以实现[3]。既往研究显示,BMSCs、脂肪干细胞以及一些脂肪前体细胞可分化为脂肪细胞,但是其能力并不一致。有文献报道,人原代培养的BMSC在体外诱导时,绝大部分细胞并不能分化为脂肪细胞[2],如果BMSCs并不是骨髓脂肪细胞的主要来源,那么骨髓内就还存在其他可以分化为脂肪细胞的干、祖或前体脂肪细胞。
正常情况下骨髓内含有BMSCs、造血干细胞(HSCs)、内皮细胞等多种类型的细胞,采用差速贴壁法培养全骨髓,可获得相对单一的 BMNCs[4]。EBM-2培养基可促进多种细胞生长;ECGs适合于低血清或无血清条件下刺激内皮细胞、平滑肌细胞、内皮祖细胞(EPCs)等细胞生长[5]。本实验应用DMEM/F12和EBM-2培养基分别培养PACs、SACs、TACs,DMEM/F12培养的TACs基本上无细胞生长,而EBM-2培养下见大量细胞生长,表明TACs基本上排除了BMSCs、成纤维细胞等早期贴壁细胞的污染,获得了相对单一的BMNCs。流式细胞分析表明,BMNCs表达CD34、CD44、CD45以及CD90等表面标志,这与文献报道的MSCs表面标志表达有明显区别,MSCs未见有CD34、CD45表达[6],而本实验培养的BMNCs CD34表达率高达(86.6±6.7)%。骨髓中,CD34是HSCs的主要标志,表明培养的BMNCs应由HSCs分化而来;CD45为典型的淋巴细胞标志,培养细胞CD45表达率为(88.4±3.6)%,提示BMNCs可能具有重要免疫学特性。由于文献中常用EBM-2培养EPC,但是培养细胞不表达VE-cadherin和KDR这两种比较典型的EPCs标志,表明该细胞和EPCs一样来源于HSCs,但是具有不完全一样的生物学特性。即使在未经诱导情况下,BMNCs原代培养第4 d,也可以发现少数BMNCs疑似自发分化为脂肪细胞。成脂肪分化实验表明,诱导后第7 d,成脂率高达(82.4±17.7)%,表明培养的BMNCs具有较高的成脂肪细胞分化能力。
目前关于脂肪分化的文献多数聚焦于BMSCs、脂肪干细胞等的脂肪分化研究[7],鲜见有对骨髓源性的其他类型细胞脂肪分化的报道,本实验证实骨髓源性BMNCs可以分化为脂肪细胞,表明骨髓脂肪细胞除BMSCs外,尚存在其他重要来源,而且与MSCs的脂肪分化能力相比,BMNCs可能较BMSCs在脂肪增生中发挥更为主导的作用[2],这为脂肪组织更新和增生的深入研究提供了部分新的实验基础。本实验培养条件简单,获得的细胞具有极强的增殖和脂肪分化能力,并且可以传代培养,因此,可能为脂肪分化相关研究提供一种较好的细胞模型。
[1] Rydén M,Uzunel M,Hard JL,et al.Transplanted bone marrow-derived cells contribute to human adipogenesis[J].Cell Metab,2015,22(3):408-417.
[2] Russel KC,Phinney DG,Lacey MR,et al.In vitro highcapacity assay to quantify the clonal heterogeneity in trilineage potential of mesenchymal stem cells reveals a complex hierarchy of lineage commitment[J].Stem Cells,2010,28:788-798.
[3] Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276:71-74.
[4] 朱光旭,周芳,阮光萍,等.供体年龄影响融合生长内皮祖细胞对平滑肌细胞表型转换及增殖迁移作用 [J].中国病理生理杂志,2015,31(2):769-766.
[5] Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275 (5302):964-967.
[6] Oswald J,Boxberger S,Jorgensen B,et al.Mesenchymal stem cells can be differentiated into endothelial cells in vitro[J].Stem Cells,2004,22(3):377-384.
[7] Caldarelli I,Speranza MC,Bencivenga D,et al.Resveratrol mimics insulin activity in the adipogenic commitment of human bone marrow mesenchymal stromal cells[J].Int J Biochem Cell Biol,2015,60:60-72.
Differentiation of BMNCs cultivated in vitro into fat cells
Zhou Fang1,2,Wang Jinxiang1,Li Zi'an1,Liu Jufen1,Bai Yingying1,2,Yang Jianyong1,Zhu Guangxu1,Pan Xinghua11.Cell Biological Therapy Center,Kunming General Hospital of Chengdu Military Command,Kunming,Yunnan,650032,China;National Joint Engineering Laboratory of Stem Cells and Immune Cells and Biological Medicine Technology,Kunming,Yunnan,650032,China;Key Laboratory of Cell Therapy Technology and Translational Medicine of Yunnan Province,Kunming,Yunnan,650032,China;2.Clinical College of Kunming General Hospital of Chengdu Military Command,Kunming Medical University,Kunming,Yunnan,650032,China
Objective To observe the capacity of in vitro cultured bone marrow mononuclear cells(BMNCs)to differentiate into fat cells.MethodsThe bone marrow of SD rats was sampled in a sterile manner to prepare cell suspension.The third adherent cells were cultivated by differential adhesion method for passage and amplification.Passage three (P3)-passage five (P5)of the third adherent cells were used in the experiments.The expressions of CD34,CD44,CD45,CD90,CD144(VE-cadherin)and the vascular endothelial growth factor receptor-2(KDR)were detected by flow cytometry;the capacity of cells to differentiate into fat cells was detected by STEMPROAdipogenesis Differentiation Kit.ResultsRelatively homogeneous BMNCs were obtained by differential adhesion method.Flow cytometry indicated that the cultured BMNCs cells expressed CD34,CD44,CD45 and CD90 while did not express CD144 and KDR.Even in the absence of adipocyte differentiation induction,the cultured BMNCs might be spontaneously differentiated into fat cells.On the 3rd,5th and 7th day since BMNCs were induced to fat cells,the fat cell percentages were(22.4± 3.8)%,(55.6±11.4)%and(82.4±17.7)%respectively,which were all significantly higher than that on the first day of induction culture [(1.3±1.1)%,P<0.01].ConclusionBMNCs cultivated in vitro may be differentiated into fat cells.
BMNC;MSC;fat cell differentiation
R 318.1
A
1004-0188(2016)12-1382-04
10.3969/j.issn.1004-0188.2016.12.009
2016-06-27)
国家自然科学基金(81170316);国家科技支撑计划项目(2014BI01B00);云南省科技创新团队建设项目(20140810)
650032昆明,成都军区昆明总医院细胞生物治疗中心,干细胞与免疫细胞生物医药技术国家地方联合实验室,云南省细胞治疗技术转化医学重点实验室(周 芳,王金祥,李自安,刘菊芬,白盈盈,杨建勇,朱光旭,潘兴华);昆明医科大学成都军区昆明总医院临床学院(周 芳,白盈盈)
朱光旭:E-mail:zhguxu@aliyun.com;潘兴华:E-mail: panxinghua@aliyun.com

