从3个角度深入理解元素周期表
◇ 北京 李书霞 白传江
从3个角度深入理解元素周期表
◇ 北京 李书霞 白传江
中学化学重要的表有3个:元素周期表、溶解度表、金属活动顺序表.在这3个表中“元素周期表”最为关键,是学习和研究化学的重要工具.在系统学习元素周期表和元素周期律之前,大家通常会按照原子序数背诵前20号元素甚至更多,但在高中学完《必修2》 第1章《物质结构 元素周期律》之后,我们会深刻体会到“族”的概念,同族元素的性质有着明显的相似性和递变性,可以说是“分类”学习的又一典范,能帮助我们解释和理解多数物质的性质及反应事实.有人将元素周期表誉为学习化学的一座“灯塔”,所以,学好并用好元素周期表具有重要的意义.
1 绘制元素周期表,明晰周期表的结构
在不参考任何工具书的情况下,亲自绘制一张元素周期表,在绘制过程中能逐渐明晰元素周期表的整体结构.绘制要求如下:
1) 在一个7行18列的表格中绘出周期表的轮廓.
2) 在左侧标出周期序数,在上方标出族序数.
3) 填充1~20号元素的名称、符号、序数.
4) 补全碱金属和卤族元素的名称、符号、序数.
5) 找到铁、铜、锌的位置.
6) 画出金属和非金属的分界线.
7) 标注镧系和锕系元素的位置.
8) 写出第七周期第ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族元素的原子序数.
例1(1) 同周期第ⅡA、ⅢA元素原子序数差可能为________.
(2) 同主族且在相邻周期的2种元素原子序数差可能为________.
(3) 主族中只有________元素全部为金属元素.
(4) 周期表中有一对同主族相邻元素,原子序数存在2倍关系,它们是________.
(5) 核电荷数为113~118元素的位置有什么规律?
(6) 根据所学知识推断,原子序数为88的元素位于____周期____族.
答案(1) 1、11、25. (2) 2、8、18、32. (3) 第ⅡA族. (4) O和S. (5) 均位于第七周期,所处主族序数与核电荷数的个位数相同. (6) 第七周期第ⅡA族.
2 分析物质的性质,理解周期表的规律
1) 对比分析碱金属、卤族元素的性质,探究同主族元素的相似性和递变性,如表1、2.
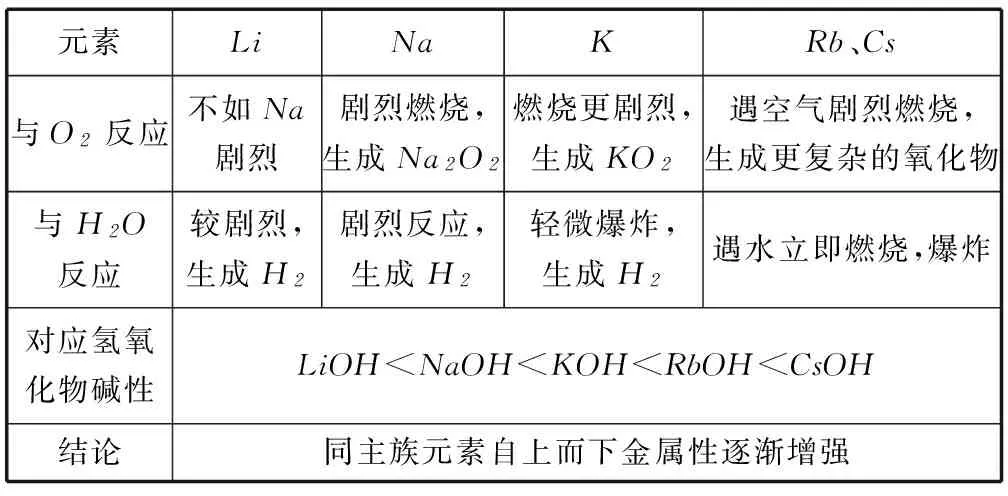
表1 碱金属元素的化学性质

表2 卤族元素单质与H2反应
2) 对比分析第3周期元素的性质,探究同周期元素的递变性,如表3、4.
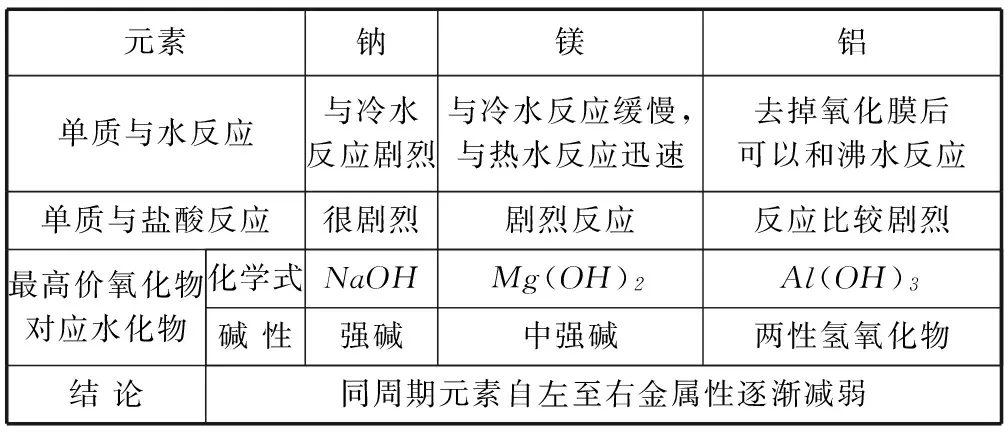
表3 第3周期金属元素的化学性质
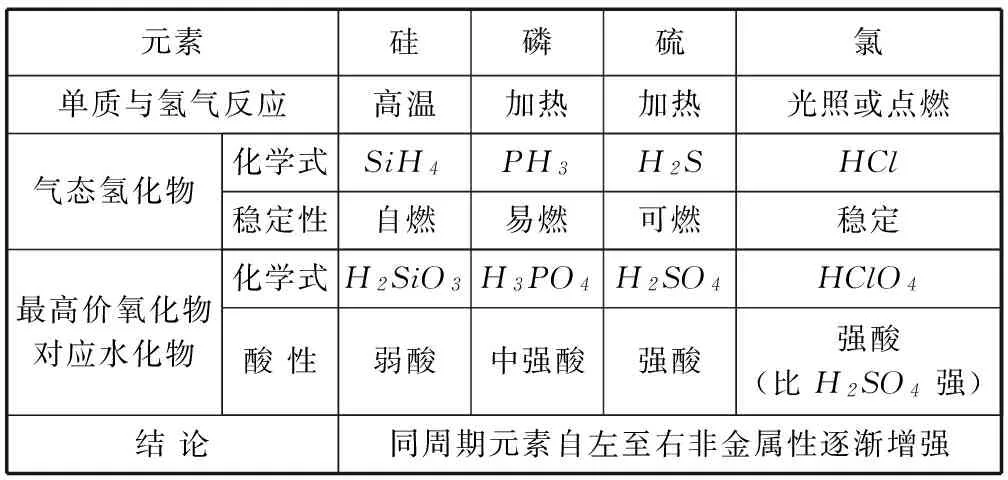
表4 第3周期非金属元素的化学性质
例2(1) 元素金属性强弱的判据________.
(2) 元素非金属性强弱的判据________.
(3) 解释元素性质的相似性:为什么卤族元素的氢化物均为HX型化合物?
(4) 解释元素性质的递变性.
(ⅰ) Cl元素非金属性强于S;
(ⅱ) K金属性大于Na;
(5) 碱金属和卤族元素单质自上而下颜色、状态、密度的变化趋势是一致的,但是熔、沸点的变化却相反,如碱金属元素单质的熔、沸点自上而下是逐渐减小的,而卤族元素单质的熔、沸点却是自上而下逐渐增大,思考为什么?
答案(1) 金属性判据:单质与水(或酸)反应置换氢的难易程度;最高价氧化物对应水化物(氢氧化物)的碱性强弱.
(2) 非金属性判据:单质与氢气生成气态氢化物的难易程度以及氢化物稳定性强弱;最高价氧化物对应水化物的酸性强弱.
(3) 因为卤族元素原子的最外层电子数均为7,和氢原子最外层的1个电子形成1对共用电子对,从而形成稳定结构.
(4) (ⅰ) Cl元素和S元素位于同周期,Cl元素的原子序数大于S元素,Cl元素的原子半径小于S元素,Cl元素的得电子能力强于S元素,所以Cl元素的非金属性强于S元素.
(ⅱ) K和Na位于同主族,K的电子层数大于Na,K的原子半径大于Na,K的失电子能力强于Na,所以K的金属性强于Na.
(5) 因为碱金属元素单质属于金属晶体,其熔、沸点由金属键的强弱决定,随着电子层数增大,金属离子的半径越大,金属键的键长越长,金属键越弱,熔、沸点越低;而卤素单质属于分子晶体,其熔、沸点由分子间作用力的强弱决定,随着卤素单质的相对分子质量增大,分子间作用力也越强,所以熔、沸点就越高.
3 关注周期表的元素分区,了解周期表的应用
元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对现有元素的一种自然分类,我们可以根据元素在周期表中的位置,推测其原子结构和可能具有的性质,从而进一步研究和开发其实际用途,此为学习化学最重要的“位—构—性”关系.由于在元素周期表中位置靠近的元素性质相似,所以启发了人们在元素周期表的一定区域内寻找元素并发现物质的新用途.
1) 可以推测未知元素的存在及其性质.
绘制出第1张元素周期表的门捷列夫曾利用周期律预言了11种元素及其性质,在后续研究中一一得到了证实.我们在《必修1》的元素化合物部分学习了一些典型代表物的性质,虽然只是涉及了少数物质,但是根据周期表揭示的规律就能预知陌生物质的性质.例如对于我们不熟悉的硒及其化合物的性质,可以根据其相邻同主族硫元素及其化合物的性质做出合理的推测.
2) 可以在周期表中金属与非金属的分界处找到半导体材料.
大家知道,硅是目前应用最广泛的半导体材料,其实,半导体器件的研制始于锗,但由于锗矿极分散,制备和提纯成本很高,后来发展到研制与它同族且同样位于金属与非金属分界线的硅.同理,镓及其化合物也在电子器件制造中有着重要的工业价值.
3) 可以在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料.
中学化学接触到催化剂如MnO2、FeCl3、CuSO4、Cu/Ag、V2O5、铁触媒、铂钯合金等均为过渡元素金属或其化合物.随着历史沿革和科学技术的发展,人类大量使用的金属由青铜器过渡到钢铁和铝合金以及性能优越的未来金属钛,这4种金属中有3种均为过渡金属材料.
4) 可以对氟、氯、硫、磷这个区域内的元素及其化合物进行研究,制备高效低毒的农药.
砷、氟、氯、硫、磷等元素在周期表中位置比较靠近,它们形成的化合物大多毒性较大,可以作为研制农药的原料.早期人们使用含砷的有机物作为农药,由于高毒性高残留而被禁止,之后,开发研制出了一系列含氯和磷的化合物,经过不断实践和改进,现在的农药将高效、广谱、安全、无毒、不污染环境等作为使用标准.
链接练习
1. 已知33As、35Br位于同一周期,下列关系正确的是( ).
A 原子半径:r(As)>r(Cl)>r(P);
B 热稳定性由强到弱顺序为HCl、AsH3、HBr;
C 还原性由强到弱顺序为As3-、S2-、Cl-;
D 酸性由强到弱顺序为H3AsO4、H2SO4、H3PO4
2.下列说法正确的是( ).
A I的原子半径大于Br,HI比HBr的热稳定性强;
B P的非金属性强于Si,H3PO4比H2SiO3的酸性强;
C Mg 和Al位于同周期,所以MgO也可以与NaOH溶液反应;
D SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
链接练习参考答案
1. C. 2. B.
清华大学附属中学)

