探析高考化学实验题中温度的控制
李宗来●
江苏省响水中学(224600)
探析高考化学实验题中温度的控制
李宗来●
江苏省响水中学(224600)
化学实验题是高考的热点题型之一,高考再现率很高.要想快速而准确的解决实验综合题,要掌握实验基本操作技能、理解实验原理、控制实验条件等,而温度是重要条件之一,本文总结归纳常见的温度控制目的和方式,以期能举一反三,提高实验题的得分率.
一、控制温度防止物质的分解或逸出(升华)

例1 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示).实验控制在较低温度下进行的原因是 ____;
解析 对于气体通入溶液中的反应,降低温度能提高气体的溶解度,从而促进反应的充分进行,同时低温能防止I2升华或防止I2进一步被氧化.
答案:使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化)
变式练习1 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示.
已知:通常状况下二氧化氯沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体稀释,以防爆炸.回答下列问题:
装置B用冰水浴的原因是____;
解析 由题干信息:通常状况下二氧化氯沸点为11.0℃,极易爆炸,因此常温下二氧化氯为气态;用冰水
将其冷凝为液态,以防爆炸.

总结提升 温度过高常见易分解的物质有:NH4NO3、NH4Cl等铵盐、氨水,HNO3、AgNO3、HClO、HI等;温度过高会逸出有Cl2、O2、NH3、N2等常见气体,温度过高易升华的有I2、低沸点易挥发的有浓盐酸、液溴、乙醇、乙酸等,同时要注意应用题干中有关物质的性质受温度的影响.
二、 控制温度调节反应速率

例2 硫酸铜可用作镀铜离子添加剂.实验室在如图所示装置(夹持、加热装置省去未画)内反应生成硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体.请回答下列问题:加热三颈烧瓶,将反应温度控制在70~80℃,其原因是____ .
解析 反应温度控制在70~80℃,温度不高不低,因为温度太低,反应太慢,温度太高,HNO3易分解.
变式练习2 碘化钠是实验室中常见的分析试剂,常用于医疗和照相业.工业上通常用水合肼(N2H4·H2O,100℃以上分解)还原法制取碘化钠,工艺流程如下:
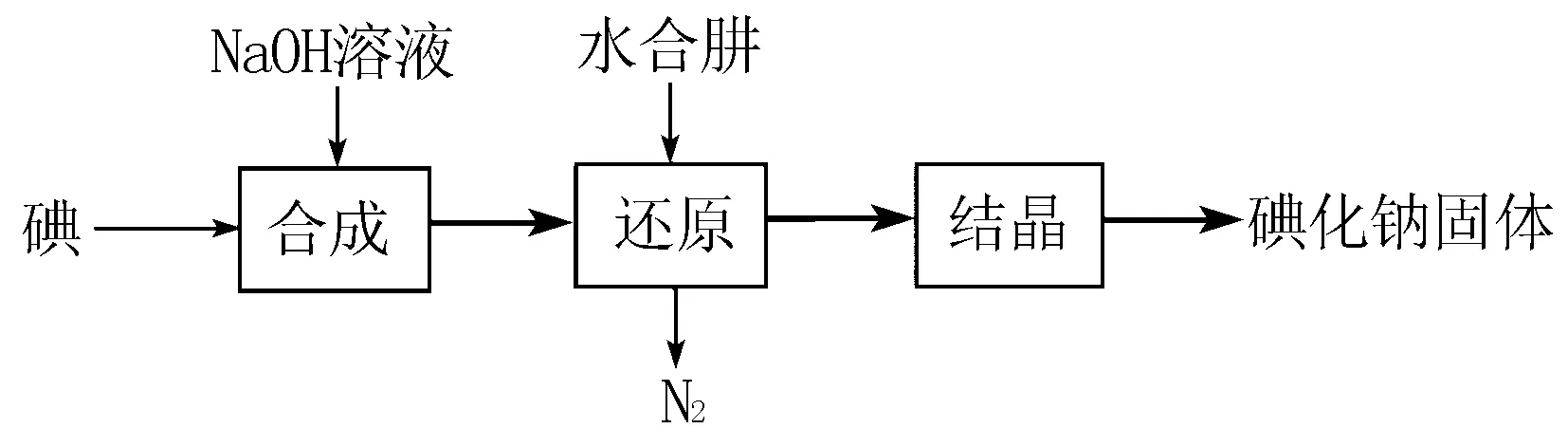
还原过程必须保持反应温度在60~70℃,这个温度既能 ____ ,又能 ____ .
答案:保证反应的快速进行,避免N2H4·H2O高温分解.
总结提升 温度越高,反应速率越快,能够提高化工生产效率,但同时也要考虑高温时原料的分解或逸出所造成的浪费,所以控制温度在一个合理的范围内(温度不高也不低),要兼顾反应速率和控制原料的分解、逸出,问题回答时要从这两个方面着手,对于一个可逆反应,还要考虑温度对转化率的影响.
三、控制温度防止副反应的发生
例3 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4],生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是____.
解析 减压蒸发(蒸馏)可以降低温度,防止蒸发时温度过高,碱式硫酸铁中Fe3+进一步水解生成Fe(OH)3.
变式练习3 Cl2和KOH在较高温度下反应生成KClO3.在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行,实验中可采取的措施是____、 ____ .

答案: 缓慢滴加盐酸、装置C加冰水浴.
总结提升 温度影响反应发生机理,因此会因温度不同而导致副反应的发生,使产品中混入其它杂质,如乙醇在170℃时分子内脱水成乙烯,而140℃时分子间脱水成醚.工艺流程中减压蒸发(蒸馏)目的往往是降低温度,防止产品的分解或副反应的发生;对待控制特定温度下的反应,一般采用水浴加热(<100℃)、油浴加热(>100℃)优点是便于调节温度,同时受热比较均匀.降低温度一般可将反应装置置于冰水浴,对于放热反应可以缓缓通入反应物,减缓反应放热.
四、控制温度调节溶解度

例4 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____.
解析 从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,根据图上信息,高于60℃以后MnSO4·H2O的溶解度减小,而MgSO4·6H2O的溶解度增大,因此控制结晶温度范围是高于60℃,这样可以得到纯净的MnSO4·H2O.
变式练习4 已知NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.____;b.____;c.洗涤;d.干燥.
答案:蒸发浓缩;高于38℃时冷却结晶过滤.

变式练习5 某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,____ ,得到FeSO4溶液, ____ ,得到FeSO4·7H2O晶体.
(注:Al3+开始沉淀的pH=3.0,沉淀完全的pH=5.0)
解析 过滤(除去不反应的SiO2),向反应液中加入足量的铁粉(将Fe3+还原为Fe2+),充分搅拌后,滴加NaOH溶液调节反应液的pH约为5(除去Al3+),过滤.或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤.滴加稀硫酸酸化(防止Fe2+受热水解)加热浓缩得到60℃(溶解度最高).冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥.
总结提升 温度影响溶解度,一般情况温度越大溶解度越大,对于特定问题要特殊对待,如Ca(OH)2、MnSO4·H2O的溶解度随温度的变大反而变小,解题首先要读懂题干中关于溶解度与温度关系的信息,运用温度对物质进行除杂、提纯、析出提取.冰(冷)水及乙醇、乙醚等有机溶剂洗涤晶体目的是降低其溶解度,减少损耗,同时易挥发的有机溶剂可以低温干燥.
五、巩固检测——综合训练
例5 焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
(a)
(b)
(c)
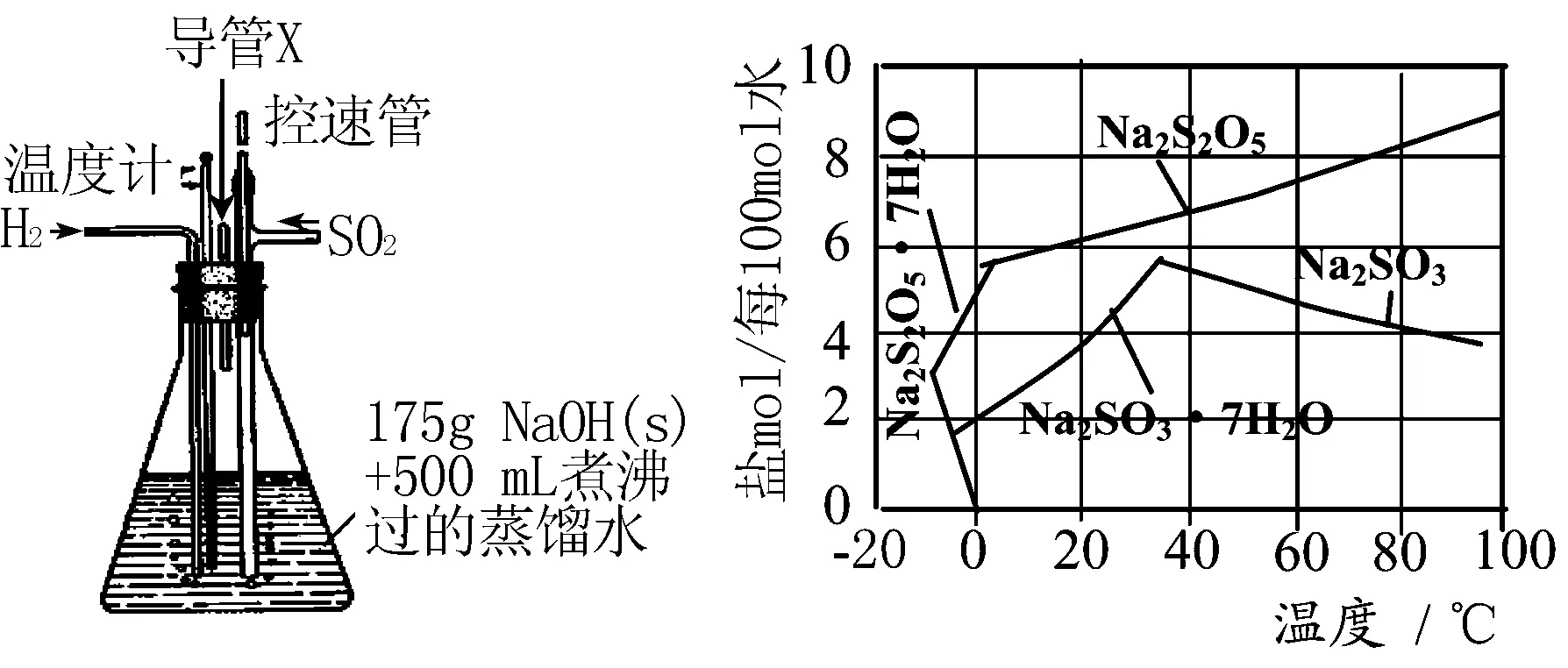
实验装置如下:
(1)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为 ____;实验后期须保持温度在约80℃,可采用的加热方式为 ____ .
(2)反应后的体系中有少量白色亚硫酸钠析出,参照图中溶解度曲线,除去其中亚硫酸钠固体的方法是 ____ ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 ____ .
解析 (1)SO2与NaOH溶液的反应本质是中和反应,属于放热反应,故温度会迅速升高;保持80℃可用水浴加热,便于控制温度.
(2)根据图像信息可得,Na2SO3的溶解度随温度升高而降低,而Na2S2O5的溶解度随温度升高而升高,故趁热过滤除去Na2SO3;30℃左右抽滤的理由是此时溶液中Na2SO3不饱和,不析出.
答案:(1)SO2与NaOH溶液的反应为放热反应,80℃水浴加热;
(2)趁热过滤,此时溶液中Na2SO3不饱和,不析出.
G632
B
1008-0333(2016)28-0082-03

