酒制山茱萸的炮制工艺研究
胡荣
(山西药科职业学院,山西太原030031)
酒制山茱萸的炮制工艺研究
胡荣
(山西药科职业学院,山西太原030031)
为了优选酒制山茱萸的炮制工艺,采用单因素考察法,对炮制工艺中的加酒量、闷润时间、蒸制时间3个因素进行优选,以马钱苷、熊果酸、齐墩果酸的含量为考察指标,建立RP-HPLC-ELSD测定方法。结果表明,最佳炮制工艺为黄酒用量25%、闷润时间1 h、蒸制时间3 h。炮制工艺合理可行,经方法学考察,RP-HPLC-ELSD法准确、重复性好,适用于山茱萸饮片的质量控制。
酒制;山茱萸;炮制工艺
中药山茱萸是植物山茱萸(Comus officinalisSieb.et Zucc)的干燥成熟果肉。山茱萸中含有多种化学成分,研究表明,其主要有效成分为马钱苷、熊果酸、齐墩果酸[1-6]。山茱萸是临床常用药物,常用炮制方法为酒制[7-12]。但酒制工艺的不同,会导致有效成分的含量差异较大,影响疗效,因此,酒制山茱萸炮制工艺需要进一步研究[13-18]。
本研究通过单因素试验研究山茱萸的酒制工艺,建立RP-HPLC-ELSD法,比较不同酒制工艺对山茱萸中马钱苷、熊果酸、齐墩果酸含量的影响,以优化饮片酒制工艺,旨在建立更佳山茱萸饮片的质量控制方法。
1 材料和方法
1.1 材料及仪器试剂
山茱萸药材购自浙江临安,经山西药科职业学院裴慧蓉教授鉴定为山茱萸科植物山茱萸ComusofficinalisSieb.et Zucc的成熟果肉。
Waters2420型蒸发光散射检测器(美国);Waters1525型高效液相色谱仪(美国);电子分析天平(Satorius BS124S,0.1 mg,德国;METTLER TOLEDO AB135-S,0.01 mg);电热恒温水浴锅(北京市长风仪器仪表公司);微孔滤膜(希波式,0.45 μm)。
熊果酸、马钱苷、齐墩果酸对照品(批号分别为110742-200313,111640-200503,110709-200304)购自中国药品生物制品检定所;水为纯净水;甲醇为色谱纯,其余试剂均为分析纯,高纯氮气。
1.2 试验方法
1.2.1 含量测定
1.2.1.1 液相色谱条件和系统适应性试验色谱条件:色谱柱为Lichrospher C18柱(德国),流动相为甲醇-0.04%醋酸溶液(A)-水-0.04%醋酸溶液(B),梯度洗脱的程序为0 min(38%A)→11 min(38%A)→11 min(90%A)→45 min(90%A)→46 min(38%A),流速1.0 mL/min,柱温27℃。理论塔板数按马钱苷峰计算,应不低于3 000。
ELSD参数:漂移管温度90℃;雾化气体N2压力172 375 p;光电倍增管电压70 V。
1.2.1.2 对照品及供试品溶液的制备分别精密称取熊果酸、马钱苷(在真空干燥器中干燥24 h)和齐墩果酸对照品10.21,10.05,10.19 mg,用甲醇定容于10 mL容量瓶中,之后用甲醇稀释100倍作为对照品溶液。
将干燥至恒质量的山茱萸样品粉碎成细粉过0.177 mm筛,精密称取0.5 g左右,倒入50 mL具塞锥形瓶中,加入15 mL分析纯甲醇,称质量,超声提取30 min,取出,用分析纯甲醇补足原质量,摇匀,0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。
1.2.1.3 线性关系考察取对照品溶液,依次进样5,10,15,20 μL,按1.2.1.1色谱条件测定熊果酸、马钱苷、齐墩果酸峰面积。以进样量X为自变量,峰面积A为因变量,得线性方程。
1.2.1.4 稳定性试验取同一份供试品溶液,一天之内每隔3 h进一针样,连续进5针,测定3种成分的峰面积,计算RSD。同一个样品溶液4℃冷藏,每天进样10 μL,连续5 d测定3种成分的峰面积,计算RSD。
1.2.1.5 精密度试验精确吸取对照品溶液A 3,7,12 μL和一份样品溶液10 μL,分别进样3次,测定熊果酸、马钱苷、齐墩果酸的峰面积,计算RSD。
1.2.2 单因素考察试验精密称取山茱萸9份,每份约10 g,按单因素考察试验选取的因素水平进行炮制,将炮制后的饮片置70℃烘箱中干燥至恒质量,粉碎成细粉,过0.177 mm筛。精密称取待测样品约5 g,按1.2.1.2供试品溶液的制备方法制备并进样10 μL,记录峰面积,计算马钱苷、齐墩果酸、熊果酸的含量。
2 结果与分析
2.1 液相色谱条件确定
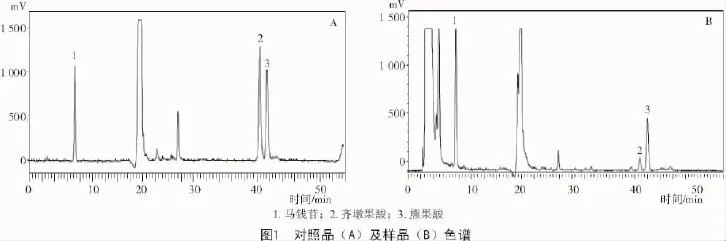
按照1.2.1.1的色谱条件分析对照品溶液和样品溶液,得色谱图(图1-A,B)。从图1-A可以看出,马钱苷和齐墩果酸、熊果酸的色谱峰相距甚远,而且后二者的峰也达到基线分离,故对三者的含量测定不会互相干扰。从图1-B可以看出,3种成分的出峰不受其他成分影响,故该色谱条件可用于同时测定山茱萸中马钱苷、齐墩果酸和熊果酸的含量。
2.2 线性关系
经测定,马钱苷、齐墩果酸、熊果酸的线性方程分别为:马钱苷A=15 281 684.456X+877 852.280,R=0.999 9,线性范围为0.150 9~2.013 9 μg;齐墩果酸A=25 709 818.899X-3 298 461.601,R=0.999 9,线性范围为0.204 8~1.334 1 μg;熊果酸A=26 313 989.101X-3 595 768.602,R=0.999 9,线性范围为0.202 8~1.329 1 μg。
2.3 稳定性试验
马钱苷、齐墩果酸和熊果酸一天内的相对标准偏差(RSD)值分别为0.12%,0.53%,0.74%,日间的RSD值分别为0.17%,0.76%,0.82%。试验结果表明,样品溶液在5 d内稳定。
2.4 精密度试验
试验结果表明,当对照品进样量为3 μL时,3种成分的RSD值分别为0.57%,0.79%,0.56%;当进样量为7 μL时,3种成分的RSD值分别为0.31%,0.70%,0.73%,在进样量为12 μL时,3种成分的RSD值分别为0.54%,0.95%,0.18%。当样品进样量为10 μL时,3种成分的RSD值分别为0.62%,0.45%,0.89%。RSD值均低于1%,表明仪器及进样精密度良好。
2.5 单因素考察试验
2.5.1 黄酒量的考察从表1可以看出,黄酒量为20%,25%时,所测得的齐墩果酸和熊果酸的含量有显著性差异,而黄酒量为25%,30%所测得的3种成分的含量均无显著性差异。从节约成本的角度考虑,故选择黄酒量为25%。

表1 不同黄酒量测得的马钱苷、齐墩果酸和熊果酸的含量(n=3)mg/g
2.5.2 闷润时间的考察从表2可以看出,闷润时间为0.5,1 h所测得的3种成分的含量有显著性差异,而闷润时间为1,1.5 h所测得的3种成分的含量均无显著性差异。从时间成本的角度考虑,故选择闷润时间为1 h。
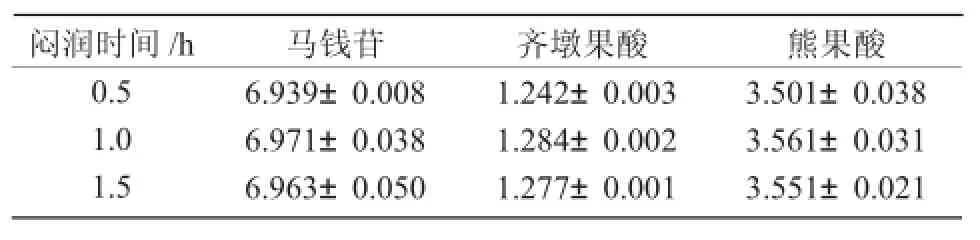
表2 不同闷润时间所测得的马钱苷、齐墩果酸和熊果酸的含量(n=3)mg/g
2.5.3 蒸制时间的考察从表3可以看出,蒸制时间为2,3 h所测得的3种成分的含量有显著性差异,而蒸制时间为3,4 h所测得的3种成分的含量均无显著性差异。从时间成本的角度考虑,故选择蒸制时间为3 h。

表3 不同蒸制时间所测得的马钱苷、齐墩果酸和和熊果酸的含量(n=3)mg/g
3 结论与讨论
本研究通过RP-HPLC-ELSD法同时测定山茱萸药材中的马钱苷、齐墩果酸和熊果酸的含量来优选山茱萸的酒制工艺为首次报道。马钱苷、齐墩果酸和熊果酸均为山茱萸的有效成分,同时测定3种成分的含量,能够更加全面地反映不同炮制工艺对饮片质量的影响。方法学考察结果显示,RP-HPLCELSD法线性关系良好,精密度和稳定性较高,而且简便、快捷,故该方法适用于山茱萸饮片的质量控制。
马钱苷属于环烯醚萜苷,齐墩果酸和熊果酸属于有机酸,二者分子极性差异很大,故要同时测定难度较大。预试验经过比较甲醇、乙醇、乙酸乙酯、氯仿4种溶剂对3种成分的提取效果,结果显示,甲醇对3种成分提取效果均较好,故以甲醇作为提取溶剂。本试验中为了避免分析时间过长而采用梯度洗脱。熊果酸和齐墩果酸属于同分异构体,色谱行为相似,为了达到较好的分离效果,本试验创新性地在流动相水和甲醇中同时加入少量醋酸溶液,既可以达到分离的目的,又可以避免因梯度洗脱而造成流动相pH值波动。由于CH3COOH在250 nm以下有末端吸收,所以,如果用紫外检测器,检测波长必须在250 nm以上,测定结果才不会受流动相影响。而熊果酸、齐墩果酸、马钱苷在250 nm以上无紫外吸收,故不能用紫外检测器。
本研究选用另一种通用检测器蒸发光散射检测器(ELSD)来检测,基于它的测定原理,ELSD几乎不受洗脱溶剂的影响,故在梯度洗脱全程,色谱基线稳定。
[1]戴建子,张志豪,唐蕾.山茱萸化学成分及药理作用研究进展[J].中国药房,2006,15(2):742-751.
[2]徐丽珍,李葱颖,田磊,等.山茱萸化学成分的研究[J].中草药,1995(2):62.
[3]袁菊丽,姜红波.山茱萸的主要化学成分及药理作用[J].化学与生物工程,2011(5):7.
[4]张程荣,曹岗,张云,等.山茱萸的化学、药理与炮制研究进展[J].中华中医药学刊,2011(9):2002.
[5]周京华,李春生,李电东,等.山茱萸有效化学成分的研究进展[J].中国新药杂志,2001(11):808-812.
[6]舒晓燕,侯大斌,阮期平,等.山茱萸的研究进展[J].中国药业,2007(10):60-62.
[7]薛刚,臧晋,刘风霞,等.山茱萸果实有效成分提取工艺条件的选择[J].中草药,1997(6):339-341.
[8]许甜甜,聂松柳,沈炳香,等.正交试验优选加压酒制山茱萸炮制工艺[J].中草药,2014(16):2339-2343.
[9]余宗亮,蔡宝昌,丁霞,等.正交实验优选山茱萸炮制工艺[J].中药新药与临床药理,2006(2):135-137.
[10]王晓明,刘华亮,袁珂,等.酒制山茱萸炮制工艺优选[J].中药材,2009,32(5):682-684.
[11]侯杰.中药酒蒸法的工艺研究[J].广州化工,2014,42(7):9.
[12]刘毅.山茱萸的炮制工艺与质量评价研究进展[J].中国中医药科技,2013,20(6):710.
[13]宋嬿,毛春芹,朱俊杰,等.炮制对山茱萸有效成分的影响研究[J].中国医药指南,2014,12(20):23-26.
[14]周莉莉,刘志强,吴国光,等.山茱萸炮制过程中环烯醚萜苷类成分的质谱研究[J].化学学报,2008,66(24):2712-2713.
[15]杜伟锋,梁小娟,蔡皓,等.山茱萸炮制前后的HPLC指纹图谱研究[J].中国药学杂志,2009(14):1059-1060.
[16]丁霞,蔡宝昌.山茱萸炮制前后有效成分含量比较[J].中成药,2006(11):1597-1600.
[17]张振凌,呼海涛,刘博,等.不同工艺酒制山茱萸马钱素、莫诺苷含量比较[J].中药材,2007,30(10):1217-1219.
[18]常增荣,李姣,郝博,等.中药山茱萸炮制前后特征化学成分的分析[J].药物分析杂志,2015,35(2):338-339.
Study on the Processing Technology of Wine of Comus officinalis
HU Rong
(Shanxi Pharmaceutical College,Taiyuan 030031,China)
To optimize processing technology of wine of Comus officinalis,the paper using the single factor investigation method to determine the dosage of wine,stuffy in run time,steamed time in processing technology,taking the content of glycosides,ursolic acid and oleanolic acid as examining index,established RP-HPLC-ELSD determination method.The results showed that the best processing technology was wine consumption 25%,boring time of1 h,steaming time 3 h.The processing technology was reasonable,the methodology investigation,the RP-HPLC-ELSD method was accurate and reproducible,suitable to the quality control of cut crude drug of Comus officinalis.
wine processing;fructus corni;processing technology
R283
A
1002-2481(2016)01-0077-04
10.3969/j.issn.1002-2481.2016.01.22
2015-09-15
胡荣(1982-),女,山西大同人,助教,主要从事中药材教学及质检研究工作。

