六溴环十二烷对拟长腹剑水蚤的急性毒性和生殖发育毒性效应❋
王晓敏, 朱丽岩, 陈学超, 江田田
(中国海洋大学海洋生命学院, 山东 青岛 266003)
六溴环十二烷对拟长腹剑水蚤的急性毒性和生殖发育毒性效应❋
王晓敏, 朱丽岩❋❋, 陈学超, 江田田
(中国海洋大学海洋生命学院, 山东 青岛 266003)
为探讨六溴环十二烷(Hexabromocyclododecane,HBCD)对海洋桡足类的毒性效应,本文研究了HBCD对拟长腹剑水蚤(Oithonasimilis)急性毒性、变态率、变态时间、成熟时间及繁殖力的影响。结果显示:HBCD对拟长腹剑水蚤的96 h-LC50为1.75 mg·L-1;不同浓度HBCD暴露下拟长腹剑水蚤的变态率、变态时间、首次抱卵时间、卵囊发育时间及抱卵雌体比率均受到显著影响;各浓度HBCD对拟长腹剑水蚤的生殖力未造成显著影响。研究表明,HBCD对拟长腹剑水蚤的急性毒性相对较低,但对其生殖发育具有显著的毒性效应,这可为HBCD的潜在生态风险评估提供一定的科学依据。
六溴环十二烷; 拟长腹剑水蚤; 急性毒性作用; 发育; 繁殖
六溴环十二烷(Hexabromocyclododecane,HBCD) 是一类添加型的含溴阻燃剂,在世界范围内具有广泛的应用,其持久性有机污染物的基本特性也被逐渐认识,现已受到国际社会的广泛关注[1]。但关于HBCD对水生生物毒性影响的研究还相对较少,其中以鱼类的报道较多。报道称HBCD能够引起幼虹鳟鱼氧化损伤[2],也能够引起稀有鮈鲫体内脂质、蛋白质和DNA的氧化损伤,造成其抗氧化能力下降[3]。高永飞[4]的研究表明,HBCD能增加斑马鱼幼鱼死亡率,并且对幼鱼孵化率有明显抑制效应。Deng等[19]也发现,HBCD可对斑马鱼胚胎的发育产生显著影响,其致毒机制可能是通过半胱氨酸蛋白酶参与的途径对斑马鱼胚胎造成氧化损伤并诱导细胞凋亡。此外,Nyholm等[5]对斑马鱼的研究发现HBCD可以通过亲代传递给后代,并且在斑马鱼卵中HBCD的浓度要明显高于母体中的浓度。可见,HBCD的急性毒性虽然相对不高,但其慢性和亚慢性毒性效应不容忽视[6],HBCD在海洋生态系统中的生物蓄积毒性还有待于进一步研究。
浮游动物在海洋生态系统的物质循环和能量流动中起着重要的作用,桡足类作为海洋浮游动物中的优势类群,在海洋生态系统的食物网中更是起着承上启下的关键作用。此外桡足类具有体型小、生活史短、繁殖快、对污染物高度敏感等优点,可作为毒理实验的理想模式生物之一。拟长腹剑水蚤(Oithonasimilis)是广温广盐种,在我国的各个海区都有分布,其中以黄渤海的分布最为广泛,常作为小型桡足类中的优势种出现,其丰度一般在春秋两季达到最高[7-8]。
关于HBCD的研究大多为针对哺乳动物进行的高剂量短期暴露实验,而关于HBCD对海洋无脊椎动物的亚慢性毒性效应的研究相对较少[3]。本文以拟长腹剑水蚤为研究对象,实验室条件下研究HBCD暴露对拟长腹剑水蚤急性毒性、变态率、变态时间、成熟时间及繁殖力的毒性影响,初步探讨HBCD对拟长腹剑水蚤的致毒机制及对种群存在的潜在危害,为HBCD引发的潜在生态风险评估提供基础数据。
1 材料与方法
1.1 实验材料
实验用拟长腹剑水蚤采自于青岛崂山南窑虾池,根据采样时的环境条件于温度(20±0.5) ℃、盐度20±1、光照12 h(L)∶12 h(D)条件下进行培养驯化。
培养及实验用海水为盐度30的砂滤海水,经0.45 μm微孔滤膜过滤并充分曝气,将盐度调至20±1待用。
实验以球等鞭金藻(Isochrysisgalbana)作为拟长腹剑水蚤饵料,藻种由中国海洋大学水产学院藻种室惠赠,在f/2培养液、温度20 ℃、盐度30、光照12 h(L)∶12 h(D)条件下培养至指数生长期待用。
HBCD购自于J&K Chemical Reagent Co., LTD,纯度95%。
1.2 实验方法
HBCD对拟长腹剑水蚤的急性毒性:实验在温度20 ℃、盐度20、光照12 h(L)∶12 h(D)、金藻浓度5×104cells·mL-1条件下进行。实验设定0.20、0.32、0.51、0.82、1.31、2.10、3.36 mg·L-1共7个实验组,1个空白对照组和1个丙酮对照组,每组3个平行,每个平行挑选20只健康活泼的个体。每天换水50%,观察桡足类的存活状况,并记录死亡个体数[9,23]。
HBCD对拟长腹剑水蚤发育的影响:根据96 h-LC50设定HBCD浓度为20、60、180 μg·L-1,设置1个对照组,每组3个平行。在体视显微镜下将孵化时间小于24 h的无节幼虫挑入盛有2 mL不同浓度HBCD溶液的24孔板中,每孔1只,每个24孔板作为一个平行,即24只无节幼虫。实验条件同急性毒性实验,每天在体视显微镜下换水50%,记录无节幼虫的死亡状况及变态时间[9,24]。
HBCD对拟长腹剑水蚤繁殖的影响:发育实验进行到14 d,80%的无节幼虫完成变态发育至桡足幼体期,将每个24孔板中的桡足幼体分别转移至50 mL烧杯中继续培养,每天换水50%并投喂饵料。实验进行至第26天,开始出现挂卵雌体,记录每只雌体的挂卵时间,将挂卵雌体转移至10 mL小烧杯中单独培养,统计卵囊发育时间(卵囊孵化到再次挂卵的时间间隔)及每只雌体产无节幼虫的情况[9,23]。
1.3 数据分析
运用软件SPSS 16.0在P=0.05的置信水平进行单因素方差分析(One-Way ANOVA)和LSD多重比较检验。
2 实验结果
2.1 HBCD对拟长腹剑水蚤的急性毒性效应
如图1所示,在实验浓度范围内,拟长腹剑水蚤的死亡率随着HBCD暴露浓度的增高而逐渐升高。运用软件SPSS 16.0对实验结果进行分析,求得HBCD对拟长腹剑水蚤的96 h-LC50为1.75 mg·L-1。
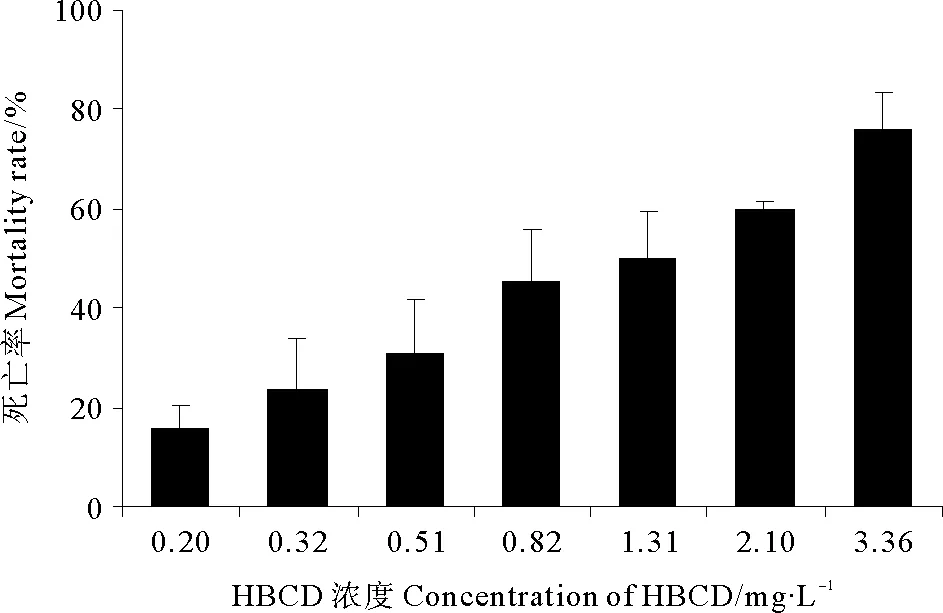
图1 HBCD暴露下拟长腹剑水蚤96 h的死亡率
2.2 HBCD对拟长腹剑水蚤发育的影响
2.2.1 HBCD对拟长腹剑水蚤变态率的影响 自实验第8天开始,对照组首先出现变态个体。从图2可以看出,至第10天,对照组和低浓度组的变态率急剧达到65%左右,而中高浓度组的变态率均不到20%,明显低于对照组。自第10天至第14天,对照组和低浓度组的变态率较为平缓地增长到80%左右,低浓度组略高于对照组,呈现出小幅度的促进效应。中浓度组最终变态率达到74.47%,与对照组相比无显著差异(p>0.05)。高浓度组与对照组相比,变态率显著降低(p<0.01),至第14天只有50%的个体完成变态。
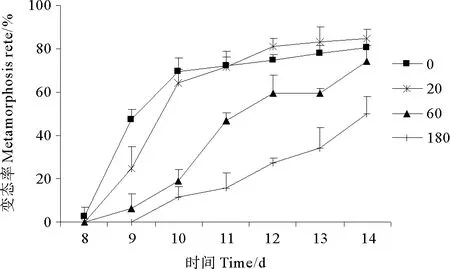
图2 HBCD对拟长腹剑水蚤变态率的影响
2.2.2 HBCD对拟长腹剑水蚤变态时间的影响 从图3可以看出,与对照组相比,不同浓度HBCD暴露下拟长腹剑水蚤无节幼虫的变态时间均受到一定程度的延迟。其中对照组无节幼虫的变态时间为8.84 d,低浓度组与对照组相比无显著差异,中浓度组的变态时间受到显著延迟(p<0.05),为10.67 d,而高浓度组与对照组相比差异极显著(p<0.01),无节幼虫的变态时间长达12.39 d。
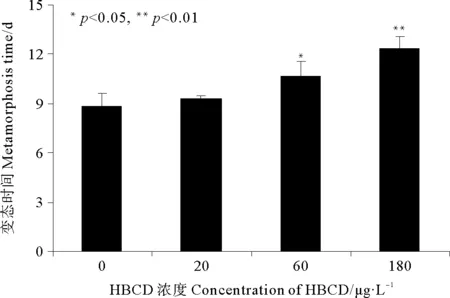
图3 不同浓度HBCD对拟长腹剑水蚤变态时间的影响
2.3 HBCD对拟长腹剑水蚤繁殖的影响
2.3.1 HBCD对拟长腹剑水蚤首次抱卵时间、卵囊发育时间和生殖力的影响 从表1可以看出,不同浓度HBCD暴露下,低浓度组拟长腹剑水蚤的首次抱卵时间与对照组相比略有提前,中高浓度组首次抱卵时间和卵囊发育时间均受到显著延迟(p<0.05),而生殖力与对照组相比并无显著差异(p>0.05)。
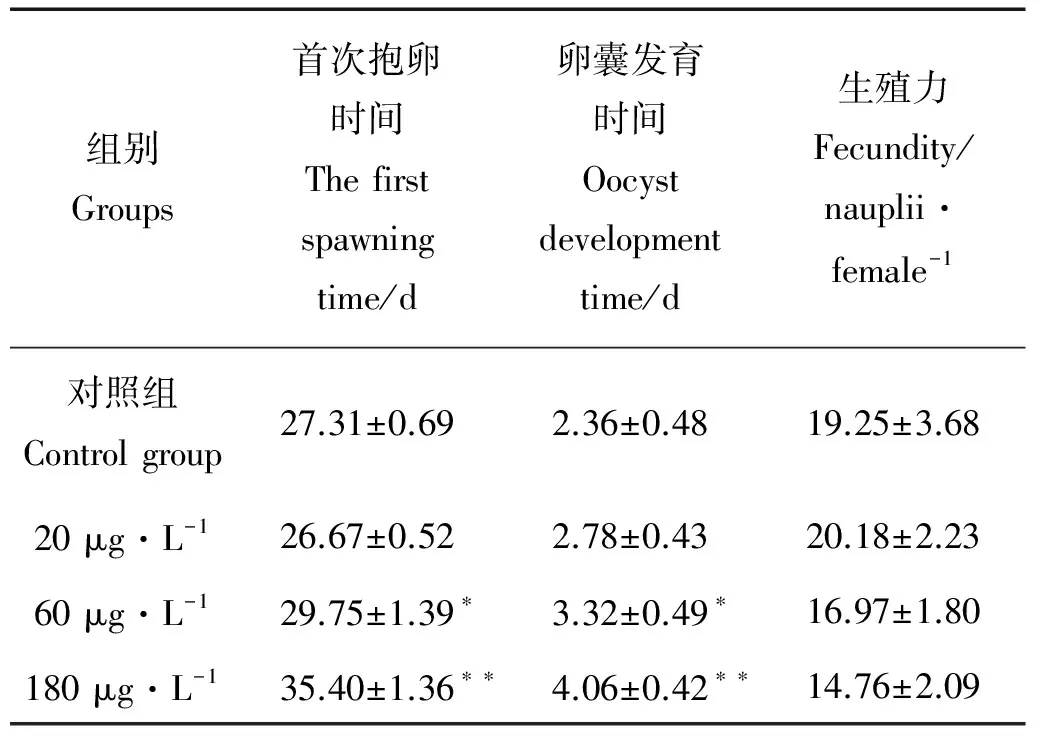
表1 HBCD对拟长腹剑水蚤首次抱卵时间、卵囊发育时间和生殖力的影响
Note:*p<0.05,**p<0.01
2.3.2 HBCD对拟长腹剑水蚤抱卵雌体比率的影响 从实验第26天开始,拟长腹剑水蚤开始出现抱卵雌体。从图4可以看出,至实验第36天,对照组的抱卵雌体比率达到90.48%,低浓度组为85.12%,略低于对照组,并无统计学上的显著差异(p>0.05),中高浓度组的抱卵雌体比率分别为75.83%和51.04%,与对照组相比均表现出显著差异(p<0.05)。
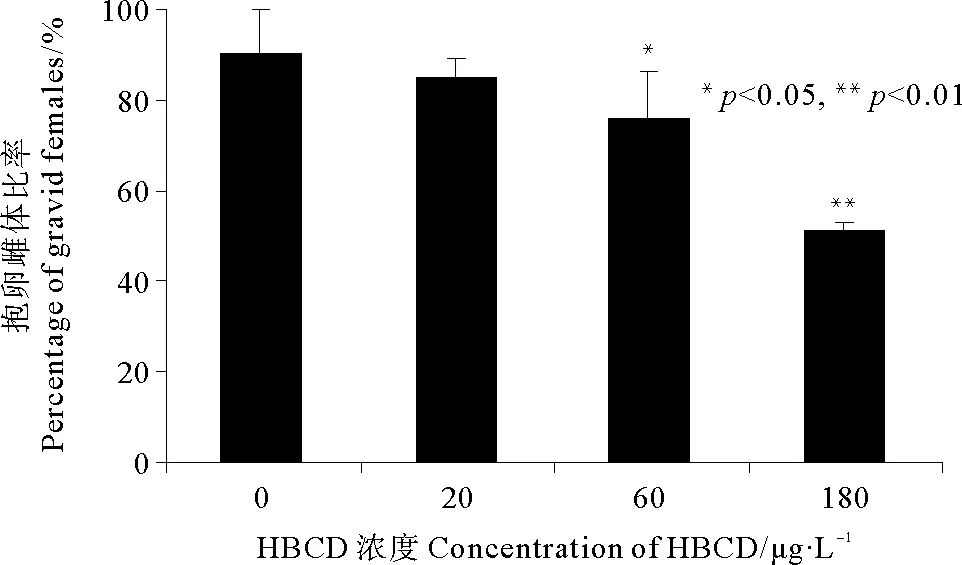
图4 不同浓度HBCD对拟长腹剑水蚤抱卵雌体比率的影响
3 讨论
HBCD在全球范围内的广泛使用带来了一定程度上的环境问题,目前在各种环境介质、生物体甚至是人体内均有广泛检出。Li 等[10]对莱州湾制造厂附近HBCD的含量进行了测定,沉积物和水生生物样品中HBCD的含量范围分别为293~1 029和7.90~815 ng·g-1。吴限等[11]研究了黄海北部近岸六溴环十二烷的分布特征,发现水体中HBCD含量达 0.12~2.23 ng·L-1,沉积物中 HBCD含量达0.55~24.75 ng·g-1,而生物体中HBCD含量高达0. 86~67.08 ng·g-1,表明黄海北部近岸生物对HBCD具有明显的生物富集现象,具有一定潜在的环境风险。胡小钟[12]对中国武汉地区鮰鱼体内的HBCD含量进行了研究,其中HBCD含量最高达到1172 ng·g-1脂重。在我国南部海岸HBCD含量在逐年增加,其在海洋哺乳动物体内的含量甚至已经超过多溴联苯醚[13]。虽然目前环境浓度对海洋桡足类可能造成的生态风险较低,但生物体对HBCD具有较强的生物富集性,而且随着HBCD的持续使用和富集,环境中HBCD的含量呈逐年升高的趋势,具有一定潜在的环境风险。本次研究以96 h-LC50为基础,研究一定浓度范围内HBCD对海洋桡足类生殖发育的毒性效应,为HBCD的环境容量阈值设定及污染控制提供一些基础数据。
3.1 HBCD对拟长腹剑水蚤急性毒性的影响
HBCD对拟长腹剑水蚤的96 h-LC50为1.752 mg·L-1。以往研究测定了20 ℃条件下HBCD对指状伪镖水蚤的96 h-LC50为296 μg·L-1[14],从实验结果可以看出,不同物种对HBCD的敏感性是不同的,拟长腹剑水蚤对HBCD的耐受性要高于指状伪镖水蚤。类似地,Willis等[15]测定水产养殖杀虫剂甲氨基阿维菌素苯甲酸盐对4种常见海洋桡足类的48 h-EC50,研究结果表明哲水蚤目三种桡足类比剑水蚤目的拟长腹剑水蚤对甲维盐更为敏感,这可能与不同种类的相对活动水平和毒物的作用方式有关,其中拟长腹剑水蚤是一种行动相对迟缓的游泳动物,通常悬浮在水流中,相反,哲水蚤类是高度能动的,会不断地游动和摄食。Castellani等[16]曾经报道,拟长腹剑水蚤在没有食物来源时,也能生存10 d以上,对于环境胁迫有很强的耐受性。可能正是因为拟长腹剑水蚤具有相对迟缓的活动方式及对环境良好的适应性和较强的耐受性,使其对HBCD耐受性要高于其它某些桡足类。此外,王玲等[17]以文昌鱼为实验对象,将其暴露于HBCD饱和溶液(8.6 μg·L-1)96 h进行急性毒性测试,96 h后未有个体出现死亡现象,结果表明HBCD的急性毒性相对较小。虽然HBCD的急性毒性相对不高,但其慢性和亚慢性毒性效应不容忽视[6]。
3.2 HBCD对拟长腹剑水蚤发育的影响
不同浓度HBCD暴露下,拟长腹剑水蚤的变态率先表现为略微的升高,后显著降低,其变态时间则表现为不同程度的延迟。低浓度HBCD作用下拟长腹剑水蚤的变态率略高于对照组,这可能是因为低浓度污染物作用下,机体进行应激反应,通过启动自身的修复机制来应对外在的污染胁迫[18]。目前,关于HBCD对水生生物的毒性影响以鱼类的报道较多。Deng 等[19]将斑马鱼胚胎暴露于HBCD中,研究结果表明HBCD可以通过影响半胱氨酸蛋白酶参与的途径引起氧化损伤,诱导细胞凋亡,从而对斑马鱼的胚胎发育产生显著影响。关于其他种类有机污染物对桡足类个体发育过程的毒性影响则有很多类似的报道。徐东晖等[20-22]的研究表明,各浓度的萘、多氯联苯和DDT均能引起火腿许水蚤幼体的变态率显著降低。Forget-Leray等[23]曾在研究内分泌干扰物对近缘真宽水蚤繁殖发育毒性影响时发现,暴露于一定浓度雌二醇和阿特拉津会引起生物个体变态时间的延迟,而暴露于苯并芘、邻苯二甲酸酯和壬基酚的个体则不会完成变态,并且引起死亡。在徐风风和Han等[24-25]的实验中,不同浓度BDE-47暴露下日本虎斑猛水蚤从无节幼虫到桡足幼体及成体的时间均表现为不同程度的延长。Andersen 和 Marcial等[26-27]发现,双酚A、邻苯二甲酸酯、辛基酚、壬基酚和甲基-萜烯等会对汤氏纺锤水蚤和日本虎斑猛水蚤的幼虫发育时间和蜕皮过程产生抑制作用。虽然有机污染物及桡足类个体的种类不尽相同,但上述结果与本此研究的结果基本是一致的。
桡足类无节幼虫的发育需要经过几个蜕皮期和一个变态期,而蜕皮过程和大多数与生殖有关的过程都是受蜕皮激素调控的,因此与节肢动物蜕皮激素有相似结构的外源化合物可能会对甲壳类动物的发育产生干扰[28]。HBCD对拟长腹剑水蚤水蚤发育过程造成不利影响可能就是因为HBCD的结构特点允许它能够结合到蜕化类固醇受体上,进而妨碍内源性蜕皮激素结合并活化其受体,最终导致生物个体变态率的降低和变态时间的延迟。类似的,Wollenberger等[29]发现,对节肢动物而言,其蜕皮类固醇激素的分泌可能会受多溴联苯醚的调节而对生物体的蜕皮系统产生不利影响,BDE-47的暴露会对日本虎斑猛水蚤的蜕皮过程产生抑制作用。Davies等[30]也发现了同样的规律,BDE会对大型溞的蜕皮类固醇激素的分泌起到控制作用,进而导致发育进程中蜕皮过程的损害或中断。此外,Zou等[31-32]的研究表明DEHP和4-辛基酚会抑制表皮壳二糖酶的活性,这种抑制至少能在一定程度上解释蜕皮慢化的原因。综上所述,拟长腹剑水蚤发育过程的损害可能就是HBCD的暴露导致了调控正常蜕皮过程的内分泌系统的紊乱。
3.3 HBCD对拟长腹剑水蚤繁殖的影响
HBCD对拟长腹剑水蚤繁殖的毒性影响,主要表现在首次抱卵时间延迟、卵囊发育时间延长、抱卵雌体比率降低,其中中高浓度组与对照组相比均有显著差异。各浓度HBCD对拟长腹剑水蚤的生殖力未造成显著影响。
低浓度HBCD作用下拟长腹剑水蚤的首次抱卵时间略有提前。在Andersen等[25]对汤氏纺锤水蚤的研究中发现,相当低浓度的雌二醇(23 μg·L-1)和双酚A(20 μg·L-1)就能刺激其卵巢的成熟。低浓度HBCD作用下拟长腹剑水蚤首次抱卵时间相对提前,可能是因为HBCD具有雌激素效应,在低浓度下能刺激拟长腹剑水蚤卵巢的成熟。而中高浓度组个体在无节幼虫期其变态过程就受到了一定的影响,变态个体比率降低,变态时间延长,导致发育同步的个体少,影响了成熟个体的交配,最终导致抱卵时间有所延长。Titleman等[33]的研究发现,剑水蚤目的一些桡足类(如矮小拟镖剑水蚤、拟长腹剑水蚤等)的雌体一生中可以利用一次交配获得的精子进行多次繁殖。这种独特的繁殖策略表明,拟长腹剑水蚤卵囊发育时间延长可能是HBCD暴露影响了雌性个体卵母细胞的成熟与排出及雄性个体产生成熟精子的数量,阻碍了雌性个体的再次受精,最终导致了卵囊发育时间的延长。
拟长腹剑水蚤的抱卵雌体比率随着HBCD浓度的升高显著降低。黄瑛在研究三丁基氧化锡对火腿许水蚤的影响时发现,暴露于一定浓度的三丁基氧化锡会造成火腿许水蚤抱卵雌体比率的显著降低。同样地,徐东晖等[20-22]的研究表明,一定浓度的萘、多氯联苯和DDT均能引起火腿许水蚤抱卵雌体比率显著降低。Han等[25]曾在分子水平、细胞水平和个体水平上针对BDE-47和PFOS对日本虎斑猛水蚤繁殖发育及防御基因表达的影响进行研究,研究发现BDE-47和PFOS可以诱导氧化压力,引起与解毒作用、抗氧化功能、细胞凋亡和细胞增生等基因转录调控有关的DNA损伤修复系统的损害,导致日本虎斑猛水蚤发育的延迟和繁殖的损伤。另一方面,Michalek 等[34]曾指出,生物体在逆境条件下为了解毒和适应,会对能量收支进行权衡,HBCD暴露下拟长腹剑水蚤的能量分配可能会偏向于解毒作用,造成用于生殖的能量减少。
低浓度HBCD暴露下拟长腹剑水蚤的生殖力略有升高,这可能是由于较低浓度的污染物能够刺激桡足类个体的活动,使其摄食量增加,代谢增强[35]。中高浓度组个体的生殖力有所降低,虽然与对照组并无显著差异,但桡足类个体变态率、抱卵雌体比率的显著降低及变态时间和卵囊发育时间的显著延长也必然会导致其种群数量的减少,长期作用下可能会引起浮游动物群落结构改变,对海洋生态系统造成一定的影响。
综上所述,HBCD可以影响拟长腹剑水蚤的发育和繁殖,可能是因为HBCD能引起细胞损伤以及内分泌系统的紊乱和能量代谢的改变。目前为止,HBCD对海洋无脊椎动物的毒性影响并没有广泛的研究,本实验研究了HBCD对拟长腹剑水蚤生活史中与发育和繁殖有关指标的毒性影响,从分子、细胞和个体水平上初步探讨了HBCD对拟长腹剑水蚤发育阻碍和繁殖损害的机制,为今后针对HBCD对海洋生物的毒性效应研究提供基础数据。
[1] Sellstrom U, Bignert A, Kierkegaard A, et al. Temporal trend studies on tetra-and pentabrominated diphenyl ethers and hexabromocyclododecane in guillemot egg from the baltic sea[J]. Environmental Science and Technology, 2003, 37(24): 5496-5501.
[2] Silke G, Aldert H P, Leo V, et al. Subacute effects of the brominated flame retardants hexabromocyclododecane and tetrabromobisphenol A on hepatic cytochrome P450 levels in rats[J]. Toxicology, 2006, 218: 229-236.
[3] Zhang X, Yang F, Zhang X, et al. Induction of hepatic enzymes and oxidative stress in Chinese rare minnow (Gobiocyprisrarus) exposed to waterborne hexabromocyclododecane (HBCD)[J]. Aquatic Toxicology, 2008, 86(1): 4-11.
[4] 高永飞. 氯化石蜡和六溴环十二烷暴露对斑马鱼胚胎发育的毒性效应研究[D]. 武汉: 华中农业大学, 2012. Gao Y F. Toxicity Effects on Zebrafish Larvae Following Embryonic Exposure to Chlorinated Paraffins and Hexabromocyclododecane[D]. Wuhan: Huazhong Agricultural University, 2012.
[5] Nyholm J R, Norman A, Norrgren L, et al. Maternal transfer of brominated flame retardants in zebrafish (Daniorerio)[J]. Chemosphere, 2008, 3(2): 203-208.
[6] Law R J, Kohler M, Heeb N V, et al. Hexabromocyclododecane challenges scientists and regulators[J]. Environmental Science and Technology, 2005, 39(13): 282-287.
[7] 朱丽岩, 徐培培, 张天文, 等. 胶州湾拟长腹剑水蚤时空分布变化的研究[J]. 中国海洋大学学报(自然科学版), 2009, 39: 83-88. Zhu L Y, Xu P P, Zhang W T, et al. The spatial and temporal distribution ofOithonasimilisin Jiaozhou Bay[J]. Periodical of Ocean University of China, 2009, 39: 83-88.
[8] 张武昌, 王克, 高尚武, 等. 渤海春季和秋季的浮游动物[J]. 海洋与湖沼, 2002, 33(6): 630-639. Zhang W C, Wang K, Gao S W, et al. Zooplankton in the Bohai Sea in spring and autumn[J]. Oceanologia Et Limnologia Sinica, 2002, 33(6): 630-639.
[9] 黄瑛. 火腿许水蚤的繁殖生物学研究和在三丁基氧化锡毒性评价中的应用[D]. 青岛: 中国海洋大学, 2008: 1-121. Huang Y. Reproductive Biology ofSchmackeriapoplesiaand Its Use in Ecotoxicological Study of Bis(Tributyltin) Oxide[D]. Qingdao: Ocean University of China, 2008: 1-121.
[10] Li H H, Zhang Q H, Wang P, et al. Levels and distribution of Hexabromocyclododecane (HBCD) in environmental samples near manufacturing facilities in Laizhou Bay area, East China[J]. Environmental Chemistry, 2012, 14(10): 2591-2597.
[11] 吴限, 祖国仁, 高会, 等. 黄海北部近岸多环境介质中六溴环十二烷的分布特征及生物富集[J]. 环境化学, 2014, 33(1): 125-130. Wu X, Zu G R, Gao H, et al. Distribution characteristic and bioaccumulation of hexabromocyclododecanes(HBCDs) in multimedia environment in the coast of northern Yellow Sea[J]. Environmental Chemistry, 2014, 33(1): 125-130.
[12] 胡小钟, 徐盈, 胡德聪. 六溴环十二烷异构体在鮰鱼体内的浓度分布与生物累积特征[J].分析科学学报, 2008, 24(2): 142-147. Hu X Z, Xu Y, Hu D C. Distribution and biomagnification characteristics of hexabromocyclododecanes (HBCDs) inChannelCatfish[J]. Journal of Analytical Science, 2008, 24(2): 142-147.
[13] Tanabe S. Temporal trends of brominated flame retardants in coastal waters of Japan and South China: Retrospective monitoring study using archived samples fromes-Bank, Ehime University, Japan[J]. Marine Pollution Bulletin, 2008, 57: 267-274.
[14] 王晓敏. 六溴环十二烷(HBCD)对两种海洋桡足类的毒性影响[D]. 青岛: 中国海洋大学, 2016: 1-45. Wang X M. Toxic Effects of HBCD on Two Marine Copepods[D]. Qingdao: Ocean University of China, 2016: 1-45.
[15] Willis K J, Ling N. The toxicity of emamectin benzoate, an aquacultur epesticide, to planktonic marine copepods[J]. Aquaculture, 2003, 221: 289-297.
[16] Castellani C X, Irigoien R P, Harris and R S Lampitt. Feeding and egg production ofOithonasimilesin the North Atlantic[J]. Marine Ecology Progress Series. 2005, 288: 173-182.
[17] 王玲, 郑明刚, 仝艳丽, 等. 六溴环十二烷(hexabromocyclododecane, HBCD)暴露对生长阶段文昌鱼的毒性及其几种重要酶活性的影响[J]. 环境科学学报, 2011, 31(5): 1086-1091. Wang L, Zheng M G, Tong Y L, et al. Effect of immune-related enzymes in amphioxus exposed to waterborne hexabromocyclododecane (HBCD)[J]. Acta Scientiae Circumstantiae, 2011, 31(5): 1086-1091.
[18] Siu W H L, Hung C L H, Wong H L, et al. Exposure and time dependent DNA strand breakage inhepatopancreas of green-lipped mussels (Pernaviridis) exposed to Aroclor 1254, and mixtures of B[a]P and Aroclor 1254[J]. Marine Pollution Bulletin, 2003, 46(10): 1285-1293.
[19] Deng J, Yu L Q, Liu C S, et al. Hexabromocyclododecane-induced developmental toxicity and apoptosis in zebrafish embryos[J]. Aquatic Toxicology, 2009, 93(1): 29-36.
[20] 徐东晖, 刘光兴. 多环芳烃(萘)对火腿许水蚤(Schmackeriapoplesia)急性和慢性毒性效应的研究[J]. 生态毒理学报, 2010, 5(4): 543-548. Xu D H, Liu G X. A study on the acute and chronic effects of NAPH onSchmackeriapoplesia[J]. Asian Journal of Ecotoxicology, 2010, 5(4): 543-548.
[21] 徐东晖, 刘光兴. 多氯联苯对海洋桡足类火腿伪镖水蚤的毒性效应[C]//中国环境科学学会学术年会论文集, 2011: 402-407. Xu D H, Liu G X. Toxic effects of Polychlorinated biphenyls on the marine copepodPseudodiaptomuspoplesia[C]// Proceedings of the Annual Conference of the Chinese Academy of Environmental Science, 2011: 402-407.
[22] 徐东晖, 刘光兴. DDT对火腿伪镖水蚤(Pseudodiaptomuspoplesia)急性和慢性毒性效应[J]. 生态学杂志, 2012, 31(4): 882-887. Xu D H, Liu G X. Acute and chronic effects of DDT onPseudodiaptomuspoplesia[J]. Chinese Journal of Ecology, 2012, 31(4): 882-887.
[23] Forget-Leray J, Landriau I, Minier C, et al. Impact of endocrine toxicants on survival, development, and reproduction of the estuarine copepodEurytemoraaffinis(Poppe)[J]. Ecotoxicology and Environmental Safety, 2005, 60: 288-294.
[24] 徐风风. 四溴联苯醚(BDE-47)对两种海洋桡足类动物的毒性效应[D]. 青岛: 中国海洋大学, 2013: 1-63. Xu F F. Toxic Effects of BDE-47 on Two Marine Copepods[D]. Qingdao: Ocean University of China, 2013: 1-63.
[25] Han J, Won E J, Lee M C, et al. Developmental retardation, reduced fecundity, and modulated expression of the defensome in the intertidal copepodTigriopusjaponicusexposed to BDE-47 and PFOS[J]. Aquctic Toxicology, 2015, 165: 136-143.
[26] Andersen H R, Halling-Sorensen B, Kusk K O. A parameter for detecting estrogenic exposure in the copepodAcartiatonsa[J]. Ecotoxicology and Environmental Safety, 1999, 44: 56-61.
[27] Marcial H S, Hagiwara A, Snell T W. Estrogenic compounds affect development of harpacticoid copepodTigriopusjaponicus[J]. Environmental Toxicology and Chenistry, 2003, 22(12): 3025-3030.
[28] Zou E, Fingerman M. Effects of estrogenic xenobiotics on molting of the water flea,Daphniamagna[J]. Ecotoxicology and Environmental Safety, 1997, 38: 281-285.
[29] Wollenberger L, Dinan L, Breitholtz M. Brominated flame retardants: Activities in a crustacean development test and in an ecdysteroid screening assay[J]. Environmental Toxicology and Chemistry, 2005, 24(2): 400-407.
[30] Davies R, Zou E. Polybrominated diphenyl ethers disrupt molting in neonatalDaphniamagna[J]. Ecotoxicology, 2012, 21(5): 1371-1380.
[31] Zou E, Fingerman M. Effects of Estrogenic Agents on chitobiase activity in the epidermis and hepatopancreas of the fiddler crab,Ucapugilator[J]. Ecotoxicology and Environmental Safety, 1999, 42: 185-190.
[32] Zou E, Fingerman M. Effects of exposure to diethyl phthalate, 4-(tert)-octylphenol, and 2,4,5-trichlorobiphenyl on activity of chitobiase in the epidermis and hepatopancreas of the fiddler crab,Ucapugilator[J]. Comparative Biochemistry and Physiology, 1999, 122: 115-120.
[33] Titelman J, Varpe O, Eliassen S, et al. Copepod mating: chance or choice?[J]. Plankton Research, 2007, 29(12): 1023-1030.
[34] Michalek-Wagner K, Willis B L. Impacts of bleaching on the soft coral Lobophytum compactum. I. Fecundity, fertilization and offspring viability[J]. Coral Reefs, 2001, 19(3): 231-239.
[35] 林汝榕, 李少菁. 铜、镉对中华哲水蚤氨基酸含量影响的实验研究[J]. 海洋与湖沼, 1991, 22(3): 242-248. Lin R R, Li S J. Effects of Cu and Cd on amino acids ofCalanussinicus[J]. Oceanologia Et Limnologia Sinica, 1991, 22(3): 242-248.
责任编辑 高 蓓
Toxic Effects of HBCD on the Acute Toxicity, Development and Reproduction ofOithonasimiles
WANG Xiao-Min, ZHU Li-Yan, CHEN Xue-Chao, JIANG Tian-Tian
(College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China)
HBCD is a type of brominated flame retardants which is widely used. At the same time, it is a kind of persistent organic pollutants with highly biological accumulated toxicity. It can accumulate, migrate and transformate in the environment for a long time, and now it has become a kind of widespread pollutant. To explore the toxic effects of Hexabromocyclododecane (HBCD) on marine copepods, this research studyed the effects of HBCD exposure on the acute toxicity, metamorphosis rate, metamorphosis time, maturation time and fecundity ofOithonasimilis. Acute toxicity determined the mortality rate directly. Metamorphosis rate, metamorphosis time and maturation time are normally known that reveal the propagation rate of species. The results showed that 96 h-LC50of HBCD toO.similiswas 1.752 mg·L-1; The time required for metamorphosis, first spawning and oocyst development, the metamorphosis rate and the percentage of gravid females were affected significantly by HBCD; Different concentrations of HBCD did not cause a significant impact on the fecundity. Studies revealed that the acute toxic effect of HBCD was relatively low, but it showed a significant toxicity on the reproduction and development ofO.similiswhich means long term toxicity exist on this organism. HBCD can cause the reduce of copepods and accumulate in predator like salmon, tuna, jellyfish, maybe humans are harmed after the long term accumulation. This could provide a scientific basis for assessing the potential ecological risks caused by HBCD.
HBCD;Oithonasimilis; acute effect; development; reproduction
国家自然科学基金项目(31172412;31572621)资助 Supported by the Natural Science Foundation of China(31172412; 31572621)
2016-04-14;
2016-05-17
王晓敏(1990-),女,硕士,研究方向:生态毒理学。E-mail: 1422580155@qq.com.
❋❋ 通讯作者:E-mail: lyzhu@ouc.edu.cn
Q142.9
A
1672-5174(2017)01-082-07
10.16441/j.cnki.hdxb.20160119
王晓敏, 朱丽岩, 陈学超, 等. 六溴环十二烷对拟长腹剑水蚤的急性毒性和生殖发育毒性效应[J]. 中国海洋大学学报(自然科学版), 2017, 47(1): 82-88.
WANG Xiao-Min, ZHU Li-Yan, CHEN Xue-Chao, et al. Toxic Effects of HBCD on the acute toxicity, development and reproduction ofOithonasimiles[J]. Periodical of Ocean University of China, 2017, 47(1): 82-88.
——以“不同咖啡因饮料对水蚤心率的影响”为例

