罕见转移性前列腺导管腺癌的多学科综合诊治
——泌尿肿瘤MDT在临床诊治中的关键作用
束坤鹏,魏 强,李 响,刘继彦,李志平,姚 晋,陈 铌,黄 蕤,蔡迪明,沈朋飞,刘振华,龚 静,曾 浩
(四川大学华西医院:1.泌尿外科;2.腹部肿瘤科;3.放射科;4.病理科;5.核医学科;6.超声科,成都 610041)
·主编推荐——多学科病案讨论·
罕见转移性前列腺导管腺癌的多学科综合诊治
——泌尿肿瘤MDT在临床诊治中的关键作用
束坤鹏1,魏 强1,李 响1,刘继彦2,李志平2,姚 晋3,陈 铌4,黄 蕤5,蔡迪明6,沈朋飞1,刘振华1,龚 静4,曾 浩1
(四川大学华西医院:1.泌尿外科;2.腹部肿瘤科;3.放射科;4.病理科;5.核医学科;6.超声科,成都 610041)
转移性前列腺导管腺癌;前列腺导管腺癌;多学科诊疗模式(MDT);综合诊治
1 参加人员
主持人:泌尿外科 曾浩教授
病例汇报人:泌尿外科 束坤鹏
讨论嘉宾:
泌尿外科 魏强教授、李响教授、沈朋飞主治医师、刘振华主治医师
腹部肿瘤科 刘继彦教授、李志平教授
放射科 姚晋副教授
病理科 陈铌副教授、龚静讲师
核医学科 黄蕤副教授
超声科 蔡迪明副教授
前列腺导管腺癌(ductaladenocarcinomaoftheprostate,DA)是罕见的前列腺上皮源性恶性肿瘤,单纯性DA在所有前列腺恶性肿瘤中不足1%,混合性DA的比例亦不到5%[1]。DA在肿瘤分化程度上与Gleason评分为8分的前列腺腺泡腺癌(acinaradenocarcinomaoftheprostate,AC)相当,但与AC相比,DA具有更高的迁徙、侵袭和转移能力[2-3];晚期转移性DA甚至缺乏标准的治疗方案,其治疗经验仅见于不足50例的病例报告。对于此类少见肿瘤的诊治,肿瘤多学科诊疗模式(multidisciplinaryteam,MDT)可能是患者临床获益的最佳途径。现将经过我院泌尿肿瘤MDT团队讨论、多科协作诊治的1例前列腺导管腺癌病例诊治过程报道如下。
2 病案讨论
2.1 病例介绍 患者男性,45岁,因进行性加重排尿困难3个月伴会阴剧烈疼痛至我院门诊就诊。患者盆腔疼痛评分达9分。直肠指检发现:前列腺体积明显增大,质硬,呈结节状,向直肠腔面突出,与直肠前壁分界欠清。血清肿瘤标志物检查显示:前列腺特异性抗原(prostate-specificantigen,PSA)1.25ng/mL,fPSA0.06ng/mL,癌胚抗原(carcinoembryonicantigen,CEA)0.87ng/mL。前列腺MRI增强扫描显示:前列腺及双侧精囊腺形态不规则,信号不均匀,可见片状稍长T1、稍长T2信号,弥散受限,增强扫描见病变明显不均匀性强化,膀胱后壁与病变界限消失。盆腔未见淋巴结增大,未见积液。综上考虑前列腺恶性肿瘤,精囊腺、膀胱及左输尿管受累,癌可能性大(图1)。胸部增强CT扫描显示:双肺散在小结节影,约0.2~0.4cm,边界清楚,分布不均,考虑转移瘤?炎症?另肺门及纵膈淋巴结无肿大(图2)。
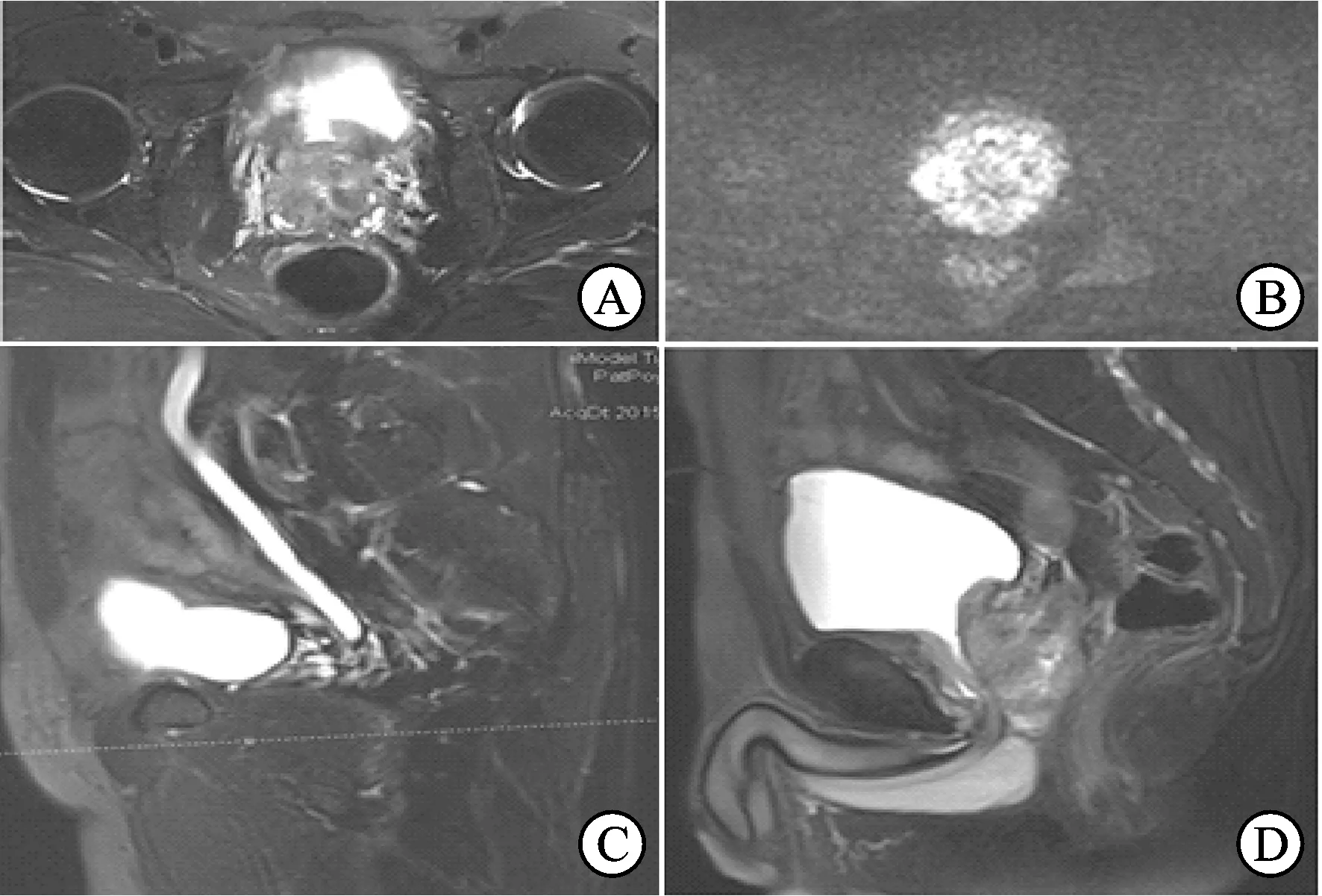
图1 患者前列腺MRI
A:MRIT2WI横断位显示前列腺内信号不均匀肿块,肿块向前上突入膀胱;B:弥散加权成像显示前列腺肿块弥散明显受限;C:MRIT2WI矢状面显示左侧输尿管积液,提示突入膀胱的前列腺肿块侵犯左侧输尿管开口;D:直肠前壁黑色基线连续完整,提示直肠壁无明显受累。
腹部增强CT显示:左肾盂扩张积水,肝脏、胰腺、脾脏、双侧肾上腺及肾脏未见异常,腹膜后淋巴结未见显示。全身骨显像未见异常。结直肠镜检:各段肠腔黏膜光滑,未见新生物及糜烂溃疡改变,距肛门7cm处可见直肠前壁黏膜面局部隆起,但黏膜面未见异常。患者随即在局麻下接受直肠B超引导下经会阴前列腺穿刺活检术。穿刺12针,除第7针外,其余各针均发现腺癌,免疫组织化学检查显示:PSA(+),PSAP(灶区+),AMACR(+),P63(-),HCK(-),AR(+),CK7(-),Gata3(-),PAX8(-),CDX-2(-)(图3)。综合上述病理改变,诊断考虑以导管腺癌为主要成分的前列腺癌。
前列腺及双侧精囊腺形态不规则,信号不均匀,可见片状稍长T1、稍长T2信号,弥散受限,增强扫描见病变明显不均匀性强化,膀胱后壁与病变界限消失。盆腔未见淋巴结增大,未见积液。综上考虑前列腺恶性肿瘤,精囊腺、膀胱及左输尿管受累,癌可能性大。
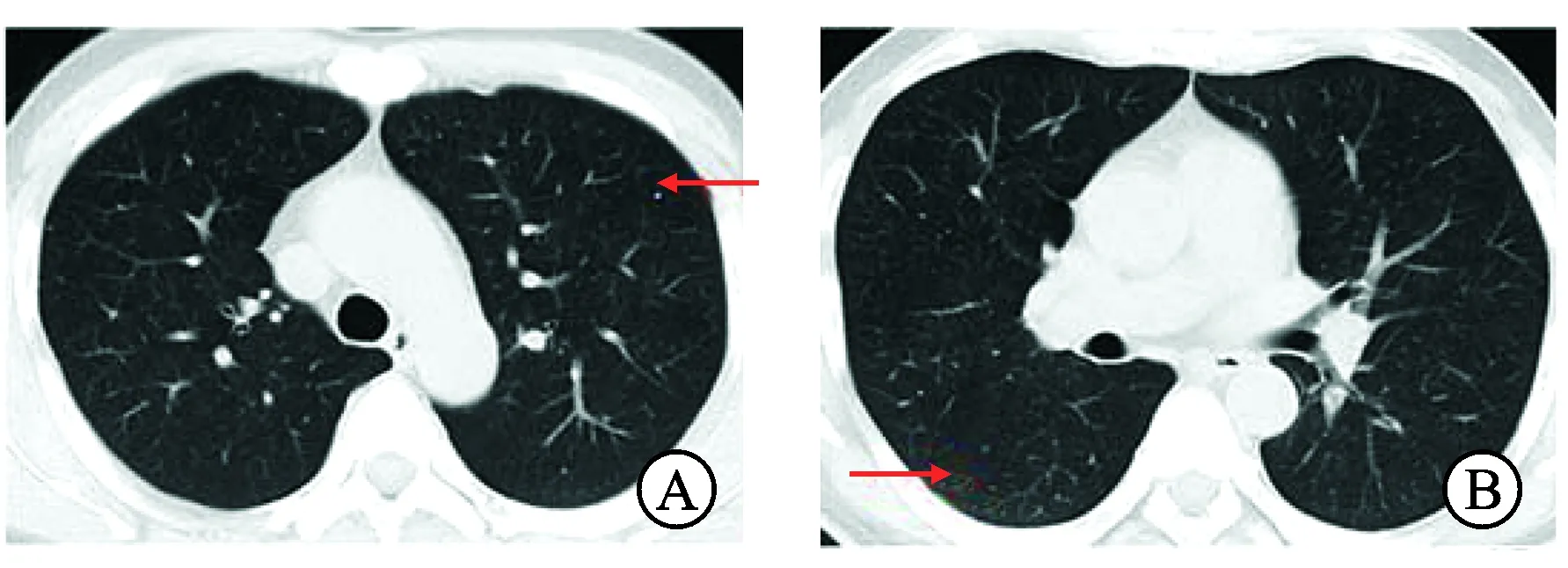
图2 患者胸部CT
A、B:胸廓对称,双肺散在小结节影,约0.2~0.4cm,分布不均,边界清楚。双肺透光度正常,纹理走行,分布正常,气管及叶、段支气管未见狭窄、闭塞及扩张,肺门大小位置未见异常。肺门及纵膈淋巴结未见肿大。双肺散在小结节影,转移瘤?炎症?请结合临床。
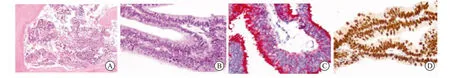
图3 患者前列腺穿刺组织病理
前列腺穿刺组织(第1~6,8~12针)查见腺癌。免疫组织化学检查显示:PSA(+),PSAP(灶区+),AMACR(+),P63(-),HCK(-),AR(+),CK7(-),Gata3(-),PAX8(-),CDX-2(-)。结合临床/影像资料,诊断考虑以导管腺癌为主要成分的前列腺癌。A、B:低倍和高倍镜下前列腺导管腺癌HE切片;C:Cocktail免疫组化(AMACR(+),P63(-),HCK(-));D:导管腺癌组织中AR阳性表达。
3 MDT讨论
3.1DA的病理学特征及预后的相关研究 前列腺导管腺癌是一种起源于前列腺大导管的罕见恶性肿瘤,分为单纯性和混合性(与经典腺泡腺癌混合)两种,其中单纯性前列腺导管腺癌在前列腺恶性肿瘤总发病率中不足1%;混合性DA的发病率也仅占0.5%~5%[4-6]。尽管DA组织过表达AR,但通常情况下多数患者血清PSA升高不明显,同时由于DA常发生于前列腺大导管,极易造成患者出现排尿障碍。因此,除前列腺穿刺活检外,经尿道前列腺电切术(transurethralresectionofprostate,TURP)可能是诊断DA另一手段。DA在组织病理学上具有特征性表现:细胞典型形态结构以乳头状为主(59%),亦或呈筛孔状、高柱状复层上皮、PIN样以及实体状改变;细胞质和细胞核特征性改变仅见于2%~11%病例[7]。
AYDIN等[8]曾于2010年报道部分早期局限性DA患者可能仅通过TURP手术即可治愈。但更多的临床证据则显示:与肿瘤分化程度相似(GS=8)的前列腺腺泡腺癌相比,局限性DA具有更高的包膜侵犯和远处转移几率,患者总体预后更差。与AC患者易出现骨转移不同的是,DA患者更易出现肺、肝等内脏转移[2,3,9]。TU等[10]针对DA的不同组织病理亚型进行分层分析发现,接受前列腺癌根治术(radicalprostatectomy,RP)治疗患者中,单纯性DA患者较混合性DA患者具有相对更好的预后(中位无疾病进展生存时间:6.9 vs. 5.8年,P=0.977;中位总生存时间:13.8 vs.8.9年,P=0.054)。由于DA预后较差,患者易出现尿路梗阻症状,早前1991年,STEINBERG[11]就报道了RP在DA患者治疗中的价值。随后,JOHNSHOPKINS医院的回顾性研究显示,接受RP治疗的DA患者2年无疾病进展生存率明显高于接受其他治疗的DA患者(52% vs.34%,P<0.05)[5]。SEER(SurveillanceEpidemiologyandEndResult)和NCDB(NationalCancerDataBase)的大宗临床数据显示:接受根治性治疗的DA患者比例明显高于恶性程度相似的AC患者(39%~55% vs. 30%~36%),长期随访结果显示DA患者似乎更能从RP或根治性放疗联合内分泌治疗(RT+ADT)等积极治疗措施中获益[2,3,9]。
3.2MDT初步讨论意见及本例患者所接受的治疗方案 总体来说,前列腺导管腺癌对放化疗及内分泌治疗反应较腺泡腺癌差。回顾性研究发现积极的治疗方案(RP或RT联合ADT)可能具有更好的生存获益。本病例患者前列腺肿瘤体积较大,已经造成排尿梗阻,并伴有严重的盆腔刺激症状;同时肿瘤对膀胱三角区局部侵犯并造成左侧上尿路扩张积水,有减瘤和解除梗阻的必要性,减瘤后适时辅助放疗更为合适。尽管患者出现可疑肺转移,但转移病灶小,减瘤手术可能如转移性肾癌或乳腺癌患者一样,为后续治疗创造条件并提供保障。仔细阅片可见肿瘤累及膀胱,同时切除膀胱可能性大;直肠前壁脂肪线完整清晰,直肠受累可能性较小,完整切除肿瘤且不损伤肠道的可能性较大(图1A、1B)。结合患者年龄较轻,一般情况良好,治疗愿望强烈,依从性佳,建议首先尝试行根治性膀胱前列腺全切术,术后适时辅助治疗。

图4 前列腺导管腺癌患者各转移病灶治疗反应
①列和②列:患者不同时间段双肺多发转移病灶治疗后变化情况;③列:患者不同时间段肝右前叶转移病灶治疗后变化情况;④列:患者不同时间段右侧股骨头骨转移病灶治疗情况;⑤列:患者不同时间段盆腔及会阴部局部复发病灶治疗情况。A①~A⑤:术后3个月复查CT提示肺部结节增多增大,盆腔肿瘤局部复发;B①~B⑤:术后6个月复查CT提示肺部转移灶持续增大增多,同时发现肝和右侧股骨的新发转移病灶;C①~C⑤和D①~D⑤:术后10个月和术后16个月,评估患者病情,肺转移灶肿瘤评价为部分缓解(PR),肝转移灶为完全缓解(CR),骨转移灶为PR,盆腔复发转移灶CR,总体评价PR。
根据MDT讨论推荐意见,患者接受前列腺膀胱根治性切除术+回肠膀胱术+扩大盆腔淋巴结清扫术。术中见:前列腺与周围组织粘连、质硬、表面不平;前列腺和膀胱颈部与直肠前壁分界欠清、僵硬;完整游离肿瘤并保留直肠壁的完整性,可疑直肠前壁组织术中送冰冻活检,可疑区域以钛夹标记,双侧输尿管残端、尿道残端、直肠前壁切缘分别送检。术中未见确切肿大淋巴结,行双侧髂外/内血管、闭孔淋巴结清扫。术后病理报告示:(前列腺)腺癌(Gleason评分:4+5=9分)(含导管腺癌成分)。免疫组化:PCK(+),AR(+),PSAP(小灶弱+),PSA(-),P504S(+),HCK(-),P63(-),CDX-2(-),CK7(-),Gata3(-),PAX8(-),CD34(-),PR(-),CgA(-)。膀胱查见癌累及,免疫组化:PSA(-),PSAP(小灶弱+),P63(-),Gata3(-)。直肠前壁、输尿管残端、尿道残端、闭孔及髂血管淋巴结均未见癌累及。患者术后盆腔疼痛明显缓解,疼痛评分仅3分。
3.3DA术后辅助治疗的相关研究 根据患者最终病检结果,考虑诊断为混合性前列腺导管腺癌(T4N0Mx)。患者肿瘤临床分期较晚,尽管手术切除完整且各切缘均为阴性,仍然具有较高复发转移风险。同时,患者肺部结节尚不能排除转移可能性,有必要进行适当术后辅助治疗。目前,没有充分临床证据显示辅助内分泌治疗、辅助放疗,甚至辅助化疗在前列腺导管腺癌外科手术治疗后的疗效。导管腺癌本身尽管对抗雄治疗疗效有限[5,12-13],但研究证实导管腺癌和腺泡腺癌成分具有相近的高雄激素受体的表达[14-16],提示其作为基础辅助治疗的必要性和可能性。3.4MDT进一步讨论意见及本例患者所接受的辅助治疗 最终病检结果提示患者为混合型前列腺导管腺癌,肿瘤具有高度侵袭性,且不能排除肺转移,IHC显示AR(+),建议术后早期使用内分泌治疗(maximalandrogenblockade,MAB)作为基础辅助治疗;患者肿瘤切除术中冰冻及术后病检提示切缘阴性,患者盆腔疼痛症状明显缓解,目前建议暂不行辅助放疗;密切监测肺部可疑病灶变化,必要时考虑化疗(化疗方案的制定需慎重);患者肿瘤侵袭性强、分期晚、预后较差,目前尚没有针对导管腺癌的标准治疗方案,但综合治疗应该是延缓病情的最佳方式。
患者于术后1月开始进行MAB治疗(醋酸戈舍瑞林 3.6mg皮下植入,1次/月 + 比卡鲁胺 50mg1次/d),血清PSA迅速降低至0.003ng/mL。但术后3个月复查发现,患者肺部结节明显增大增多,患者盆腔疼痛再次加重,同时出现阴茎及会阴部痛性结节,复查盆腔CT提示肿瘤局部复发(图4A①~A⑤)。患者随即接受盆腔包块及阴茎结节穿刺活检并证实为DA局部复发伴阴茎转移。
3.5 转移性DA治疗方案选择的相关研究 与AC易出现骨转移有所不同,前列腺导管腺癌发生其他部位转移(内脏和阴茎等)的可能性更大。JOHNSHOPKINS医院的ELLIS和EPSTEIN两位医生[17]总结了前列腺导管腺癌伴阴茎转移的治疗和预后。结果发现:29例患者,主要治疗方案包括原发病灶的根治性切除/根治性放疗,联合内分泌治疗及阴茎转移灶局部放疗。患者症状明显缓解,且中位总生存时间可达1.7年。全身化疗是目前治疗转移性前列腺导管腺癌的另一主要治疗方案,但此类型患者对以多西他赛(docetaxel,DOC)为基础的化疗方案疗效不一,且仅有个案报道。PATERSON等[18]报道1例前列腺导管腺癌伴多器官转移患者接受DOC化疗后病情一度稳定,但最终在治疗后10个月病情进展。FUJIWARA等[19]则在2015年报道1例DA伴骨转移患者在接受以DOC为基础的化疗后病情稳定长达3年。但另外一些个案报道则提示DA似乎存在对DOC原发耐药,患者接受该治疗后不敏感,发现转移至死亡时间仅4~12个月[13,20-21]。早在2007年就有报道吉西他滨联合顺铂(Gemcitabine+Cisplatin,GC)方案治疗转移性DA的疗效[22]。最近,KAMIYAMA等[23]报道2例转移性DA接受DOC方案治疗失败后,更换为GC方案后,肿瘤出现部分缓解。由此看来,转移性DA患者肿瘤细胞对不同治疗方案敏感性有差异,如何寻找适合患者个体的个性化治疗方案值得临床医生深入探讨。
3.6MDT最终讨论意见及患者出现肿瘤复发、转移后的治疗方案 胸部CT连续观察提示患者肺部结节为转移病灶,诊断DA伴肺转移。依据现有治疗经验和既往数据,建议首先尝试以DOC为基础的全身化疗。由于DA患者对DOC反应不一,某些耐药相关基因的SNP检测可能帮助医生选择合适化疗药物,预测治疗反应。建议患者可以在接受DOC化疗同期进行相关血样检测。另外,患者发现盆腔局部复发、阴茎及会阴转移病灶并导致盆腔症状再次加重,补救性放疗可能减小肿瘤负荷、缓解症状。
患者于术后3个月肺部转移病灶增大即开始接受DOC联合强的松化疗方案(Docetaxel75mg/m2静脉滴注1次/3周 +强的松5mg,2次/d),同期行盆腔放疗(总剂量66Gy)。患者接受局部放疗后,盆腔疼痛症状缓解,盆腔和会阴部转移病灶完全消失。但遗憾的是,在化疗3个周期后(即术后6个月),患者胸部CT显示肺部转移病灶持续增大增多,同时发现新发转移病灶(肝转移和右侧股骨转移病灶)(图4:B①~B⑤)。化疗同期,利用患者血液样本,我们检测了与Docetaxel、Gemcitabine、Cisplatin耐药相关的基因序列中11个位点的SNP改变。结果显示:患者与DOC敏感性相关的ABCB1 3 435C>T改变[24]。这一结果可能部分解释患者对DOC较差的治疗反应。患者自术后6个月,开始尝试更换为GC化疗方案(Gemcitabine1 000mg/m2d1、d8+Cisplatin25mg/m2d1~2,1次/3周),患者已完成6个周期的GC方案治疗。术后10个月(图4:C①~C⑤)和术后16个月(图4:D①~D⑤)两次评估病情,各转移病灶复查后按RECIST标准评估如下:肝转移病灶为完全缓解(completeremission,CR),骨转移病灶为部分缓解(partialremission,PR),盆腔复发及阴茎转移病灶CR,肺转移灶肿瘤评价为PR,总体评价为PR。患者治疗后,PSA变化不明显,一直维持在不可检测的较低水平,疼痛评分维持在3分左右(图5),生活质量明显改善,生存期超过16个月。
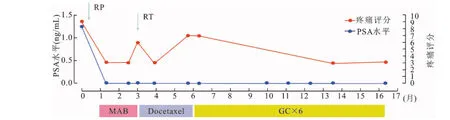
图5 前列腺导管腺癌患者全程治疗、PSA及疼痛评分示意图
RP:radicaloperation,根治性膀胱前列腺全切术;RT,radiotherapy,补救性放疗;MAB,maximalandrogenblockade,最大雄激素阻断治疗;GC,gemcitabineandcisplatinchemotherapyschedule,吉西他滨联合顺铂的化疗方案。
4 总 结
多学科诊疗模式(multidisciplinaryteam,MDT)源于上世纪90年代,由至少2位以上科室专家组成工作组,针对某一疾病,通过定期会议形式,提出适合患者的最佳治疗方案,继而由相关学科单独或多学科联合执行该治疗方案。在欧美国家,多学科诊疗模式(MDT)已成常态,英国甚至已经立法,每一位癌症患者都需经过MDT综合治疗。在恶性肿瘤治疗方法的历史发展与演变过程中,肿瘤外科、肿瘤放疗、肿瘤化疗(包括分子靶向治疗)构成了肿瘤治疗的三大支柱。手术、放疗、化疗三种手段互有特点,互为补充。恶性肿瘤,尤其是晚期恶性肿瘤,单一治疗无法治愈;而多种治疗手段联合的综合治疗可能给患者带来意想不到的疗效,甚至延长患者生存和改善生活质量,MDT可能是实现恶性肿瘤综合治疗方案系统化和个体化的最佳诊疗模式。
我院于2013年建立泌尿肿瘤MDT团队,定期开展疑难泌尿肿瘤病例讨论。本个案报道系转移性前列腺导管腺癌病例,肿瘤恶性程度高、预后差、病情复杂且变化快,临床缺乏有效的诊疗方案。但通过泌尿肿瘤MDT多次讨论后制定的针对性多学科综合治疗方案,患者目前病情稳定,生存期超过16个月(图5)。该病例的诊治过程就是肿瘤MDT价值的完美体现。MDT团队通过讨论首先实际建议患者接受了肿瘤减瘤手术,术后针对患者先后出现的多器官转移病灶,采取内分泌治疗、局部放疗及化疗等系统化和个体化治疗方案,最终使患者在肿瘤控制的基础上,维持较好的生活质量。
前列腺导管腺癌是一种罕见的前列腺恶性实体肿瘤。与前列腺腺泡腺癌相比,其发病隐蔽,极易出现内脏器官转移,缺乏行之有效的治疗方案,预后极差。因此,该病的早期临床诊断显得尤为重要。通过本病例可以发现,在缺乏PSA升高证据的情况下,DRE对前列腺癌的独立检出非常关键,临床医师需重视DRE。早期发现前列腺导管腺癌,甚至可能通过TURP手术取得良好的治疗效果[8]。尽管目前缺乏证据,但已有报道显示:转移性前列腺癌的减瘤手术可能显著延缓患者病情进展[25]。对于接受减瘤手术的前列腺癌患者,单纯的减瘤手术是不够的,后续综合治疗可能对进一步延缓患者病情进展有效[5]。以多西他赛为基础的化疗已成为高负荷转移性前列腺腺泡腺癌以及mCRPC的标准治疗方案,但其对前列腺导管腺癌、神经内分泌癌及小细胞癌等特殊类型肿瘤疗效不确切。NCCN指南甚至建议在确诊前列腺小细胞癌后参照小细胞肺癌的化疗方案。转移性前列腺导管腺癌的化疗方案不确定,利用药代相关基因的SNP改变个体化选择化疗药物可能是保证化疗效果的可选办法。前列腺导管腺癌,尤其是转移性导管腺癌有效的治疗方案,需要建立在对这种病理类型肿瘤发病及演进分子机制的更深入研究,在肿瘤MDT的协助下,累积更多病例的治疗经验,甚至开展相关前瞻性临床研究可能帮助我们尽快找到最佳治疗方法。
[1]MAZZUCCHELLIR,LOPEZ-BELTRANA,CHENGL,etal.Rareandunusualhistologicalvariantsofprostaticcarcinoma:clinicalsignificance[J].BJUInt,2008,102(10):1369-1374.
[2]MORGANTM,JWELTYCJ,VAKAR-LOPEZF,etal.Ductaladenocarcinomaoftheprostate:increasedmortalityriskanddecreasedPSAsecretion[J].JUrol,2010,184(6):2303-2307.
[3]MEEKSJJ,ZHAOLC,CASHYJ,etal.IncidenceandoutcomesofductalcarcinomaoftheprostateintheUSA:analysisofdatafromtheSurveillance,Epidemiology,andEndResultsprogram[J].BJUInt,2012,109(6):831-834.
[4]EPSTEINJI,ALGABAF,YANGXJ,etal.Tumoursoftheprostate∥EbleJN,SauterG,EpsteinJI,SesterhennIAeds,Tumoursoftheurinarysystemandmalegenitalorgans,Chapter3 [M].Lyon:IARCPress,2004,160-208.
[5]BRINKERDA,POTTERSR,EPSTEINJI.Ductaladenocarcinomaoftheprostatediagnosedonneedlebiopsy.Correlationwithclinicalandradicalprostatectomyfindingsandprogression[J].AmJSurgPathol,1999,23(12):1471-1479.
[6]EPSTEINJI,WOODRUFFJM.Adenocarcinomaoftheprostatewithendometrioidfeatures.Alightmicroscopicandimmunnohistochemicalstudyoftencases[J].Cancer,1986,57(1):111-119.
[7]SEIPELAM,DELAHUNTB,SAMARATUNGAH,etal.Diagnosticcriteriaforductaladenocarcinomaoftheprostate:interobservervariabilityamong20experturopathologists[J].Histopathology,2014,65(2):216-227.
[8]AYDINH,ZHANGJ,SAMARATUNGAH,etal.Ductaladenocarcinomaoftheprostatediagnosedontransurethralbiopsyorresectionisnotalwaysindicativeofaggressivedisease:implicationsforclinicalmanagement[J].BJUInt,2010,105(4):476-480.
[9]PACKIAMVT,PATELSG,PARISERJJ,etal.Contemporarypopulation-basedcomparisonoflocalizedductaladenocarcinomaandhigh-riskacinaradenocarcinomaoftheprostate[J].Urology,2015,86(4):777-782.
[10]TUSM,LOPEZA,LEIBOVICID,etal.Ductaladenocarcinomaoftheprostate:clinicalfeaturesandimplicationsafterlocaltherapy[J].Cancer,2009,115(13):2872-2880.
[11]STEINBERGG,WALSHPC,EPSTEINJI.Prostaticductadenocarcinoma.Findingsatradicalprostatectomy[J].Cancer,1991,67(8):2118-2124.
[12]MILLAREK,SHARMANK,LESSELLSAM.Ductal(endometrioid)adenocarcinomaoftheprostate:aclinicopathologicalstudyof16cases[J].Histopathology,1996,29(1):11-19.
[13]ORIHUELAE,GREENJM.Ductalprostatecancer:contemporarymanagementandoutcomes[J].UrolOncol,2008,26(4):368-371.
[14]OXLEYJD,ABBOTTCD,GILLATTDA,etal.Ductalcarcinomasoftheprostate:aclinicopathologicalandimmunohistochemicalstudy[J].BrJUrol,1998,81(1):109-15.
[15]SANATIS,WATSONMA,SALAVAGGIONEAL,etal.Geneexpressionprofilesofductalversusacinaradenocarcinomaoftheprostate[J].ModernPathol,2009,22(10):1273-1279.
[16]SEIPELAH,SAMARATUNGAH,DELAHUNTB,etal.Immunohistochemicalprofileofductaladenocarcinomaoftheprostate[J].VirchowsArch,2014,465(5):559-565.
[17]ELLISCL,EPSTEINJI.Metastaticprostateadenocarcinomatothepenis:aseriesof29caseswithpredilectionforductaladenocarcinoma[J].AmJSurgPathol,2015,39(1):67-74.
[18]PATERSONC,CORREAPD,RUSSELLJM.Ductalvariantofadenocarcinomaprostaterespondingtodocetaxel--acasereport[J].ClinOncol(RCollRadiol),2010,22(7):617
[19]FUJIWARAR,KAGEYAMAS,TOMITAK,etal.Metastaticprostaticductaladenocarcinomasuccessfullytreatedwithdocetaxelchemotherapy:Acasereport[J].CaseRepOncol,2015,8(2):339-344.
[20]KUMARA,MUKHERJEESD.Metastaticductalcarcinomaoftheprostate:ararevariantrespondingtoacommontreatment[J].CanUrolAssocJ,2010,4(2):E50-54.
[21]HIRAMATSUK,TSUZAKAY,KANEKOT,etal.Ductaladenocarcinomaoftheprostate:areportof7cases[J].[ArticleinJapanese]NihonHinyokikaGakkaiZasshi,2012,103(5):671-674.
[22]KATOT,HASHIMOTOY,OKADAS,etal.Carbohydrateantigen19-9-positiveprostaticductaladenocarcinomaeffectivelytreatedwithcisplatinandgemcitabine[J].IntJUrol,2007;14(12):1103-1106.
[23]KAMIYAMAY,MITSUZUKAK,WATANABEM,etal.Chemotherapywithgemcitabineandcisplatinforadvancedductaladenocarcinomaoftheprostate:clinicalcoursesoftwopatients[J].TohokuJExpMed,2015,237(4):317-321.
[24]KIMHJ,IMSA,KEAMB,etal.ABCB1polymorphismasprognosticfactorinbreastcancerpatientstreatedwithdocetaxelanddoxorubicinneoadjuvantchemotherapy[J].CancerSci,2015,106(1):86-93.
[25]HEIDENREICHA,PFISTERD,PORRESD.Cytoreductiveradicalprostatectomyinpatientswithprostatecancerandlowvolumeskeletalmetastases-resultsofafeasibilityandcase-controlstudy[J].JUrol,2015,193(3):832-838.
(编辑 王 玮)
2016-07-13
2016-08-04
国家自然科学基金(No.NSFC81172439、NSFC81402110、NSFC81672547);四川省科技厅科技支撑项目(No.2015SZ0230-3)
曾浩,教授.E-mail:kucaizeng@163.com
束坤鹏(1990-),男(汉族),学士.研究方向:泌尿系肿瘤.E-mail:xingzhe20102010@126.com
R
A
10.3969/j.issn.1009-8291.2016.12.014

