厄洛替尼引起皮肤不良反应的小鼠模型建立
宋亚中,徐央波,邓 博, 崔慧娟*,彭艳梅,刘戴维,王垲涵, 刘 凡,段 桦,邱钰芹,李 嫱
(1.北京中医药大学,北京 100029;2.中日友好医院,北京 100029)
厄洛替尼引起皮肤不良反应的小鼠模型建立
宋亚中1,徐央波1,邓 博2, 崔慧娟2*,彭艳梅1,刘戴维1,王垲涵1, 刘 凡1,段 桦1,邱钰芹1,李 嫱1
(1.北京中医药大学,北京 100029;2.中日友好医院,北京 100029)
目的 厄洛替尼(商品名:特罗凯)是治疗非小细胞肺癌的一种新型靶向药物,近些年来临床应用甚广,但副作用较多,其中以皮疹最为多见,且最令患者难以接受。本研究旨在观察应用特罗凯前后小鼠在表皮、病理、免疫组化等方面的改变,复制特罗凯所致皮疹的动物模型,为临床外用药物治疗皮疹提供模型。方法 使用BALB/c雌性小鼠 20只,随机分成4组。实验组(Ⅱ、Ⅲ、Ⅳ组)用浓度为10 g/L的特罗凯溶液按100 mg/kg灌胃,对照组(Ⅰ组)以等体积去离子水灌胃,每天1次。于给药前24 h在小鼠头颈、背、腰处脱毛,实验结束后剪取颈部、背部、腰部皮肤并观察实验组、对照组小鼠在肉眼皮肤、病理切片、免疫组化等方面的改变。结果 (1)四组小鼠之间在毛发再生天数、毛发完全再生天数、脱屑时间、出现皮疹时间、毛孔扩张数等5方面的差异存在统计学意义(P< 0.01或P< 0.05);(2)Ki67:四组间差异无统计学意义(P> 0.05)。结论 (1)此次实验印证了许多研究者关于“EGFRIs导致的皮疹为一种炎症反应”的观点;(2)该皮疹模型可靠实用,具有可重复性,适用于“EGFRIs所致皮疹动物模型”的大批建立,可推广以供临床、试验、研究所用。
厄洛替尼;皮疹;皮肤;病理;免疫组化
肺癌的死亡率占全球肿瘤相关死亡的首位,而非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总数的 80%~85%,目前的治疗主要包括手术、化疗、放疗、分子靶向治疗及生物免疫治疗等[1]。分子靶向药物主要为表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitors,EGFRIs),包括单克隆抗体和EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)等,其中TKI类药物使用范围甚广。厄洛替尼(商品名:特罗凯)、吉非替尼(商品名:易瑞沙)是较早在中国上市的TKI类药物,也是表皮生长因子受体抑制剂(Epidermal growth factor receptor inhibitors EGFRIs)的代表药物。但其诸多不良反应不容忽视。50%以上接受治疗的患者会发生皮肤毒性[2]。其中,痤疮样皮疹是最常见的EGFRIs皮肤毒性反应[3]。虽然Perez-Soler R等[4]认为:出现皮疹的患者(75%)的生存期显著优于未出现皮疹的患者,且一项Meta分析也显示:患者皮疹越严重,疗效会越好[5]。但皮疹会继发瘙痒、疼痛、皮肤受损等不适症状,严重影响患者生活质量,甚至有些患者因此而停药,影响靶向药物的继续治疗。所以如何减少或治疗靶向药所致的皮疹等皮肤不良反应,是临床亟待解决的问题。目前仍缺乏行之有效、机制明确的应对药物,因此本实验望有效复制EGFRIs类药物所致的皮疹动物模型,为临床尽早研发治疗此类皮疹的药物提供动物模型基础。鉴于目前主要的TKI类药物为特罗凯、易瑞沙等,且二者的抗瘤机制基本相同,主要通过抑制多种上皮细胞肿瘤中过度表达的EGFR受体来抑制肿瘤增殖、血管生成、转移来促进肿瘤细胞凋亡[6],而特罗凯导致的皮疹等不良反应均高于易瑞沙[7],所以本实验将特罗凯定为实验用药。
1 材料和方法
1.1 动物实验基础
参考David Surguladze等[8]在2009年报道的方法进行了模型复制,2013年4月至2015年1月进行了以下动物实验研究。
1.2 实验动物
SPF级BALB/c雌性小鼠20只,5周龄,体重17~23 g,购自北京维通利华实验动物公司[SCXK(京)2012-0001]。饲养、无菌手术环境为中日友好医院SPF动物房[SYXK(京)2008-0019]。温度为20~26℃,相对湿度为50%~60%,并按照实验动物的3R原则给予人道关怀。
1.3 药物和试剂
1.4 实验方法
1.4.1 动物分组
将BALB/c雌性小鼠按随机法分成Ⅰ、Ⅱ、Ⅲ、Ⅳ4组,每组5只。
1.4.2 饲养
将特罗凯片用灭菌去离子水配置成10 g/L的溶液,按100 mg/kg对实验组(Ⅱ、Ⅲ、Ⅳ组)进行灌胃,每天1次;对照组(Ⅰ组)用等体积去离子水按100 mg/kg每天灌胃。
1.4.3 取材
于给药前24 h 对每只小鼠头颈、背、腰等处进行脱毛。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组小鼠分别于连续灌胃21 d、7 d、14 d、21 d后取颈部、背部、腰部等处皮肤。
1.5 主要检测指标
当采用集中外售的方式时,由于需要用车辆进行运输,增加了运输成本,且外售需委托有资质的固废处置公司进行处理,需交付一定处置费用,这无疑给公司带来了一定的处置成本;当采用回炉处理时,由于砷滤饼含硫较高,会造成放热,影响炉温、渣温以及烟气温度,而且会使闪速炉的冰铜品位有小范围的波动,与此同时,回炉处理时,造成砷的循环,致使废酸中砷含量增长较快。
1.5.1 皮肤肉眼改变
实验开始后每日观测小鼠日常活动情况及皮毛改变。包括:背部剃毛部位红肿、皮疹和鼠毛重新生长、鼠毛质地等情况;未剃毛部位鼠毛卷曲、脱落等情况。
1.5.2 皮肤病理改变
四组小鼠(共20只)分别取材后,苏木精-伊红(HE)染色及油红O染色观察颈、肩背、腰部皮肤组织。包括毛囊扩张、堵塞,嗜中性脓液簇等情况。
1.5.3 免疫组化检测Ki67
标本经4%甲醛溶液固定> 6 h,脱水、石蜡包埋,采用免疫组化法检测Ki67的表达。参考Olaussen KA等[9]的方法,根据染色程度和染色细胞百分数进行评判。已知阳性的乳腺癌组织切片作为阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照。Ki67阳性染色定位于细胞核,随机计数5个高倍视野的阳性细胞百分比,以其平均值作为评定依据。
1.6 统计学方法

2 结果
2.1 皮肤肉眼改变
观察发现:对照组(Ⅰ组)小鼠剃毛后鼠毛生长较快,在2周时完全恢复,颈、肩部未出现皮疹。实验组(Ⅱ、Ⅲ、Ⅳ组)小鼠平均第4天见皮肤脱屑,第8天可见背部散在红色皮疹,第13天皮疹消失,毛发生长缓慢,3周时仍未完全恢复(参见图1)。与文献报道[8,10]相符。四组小鼠在毛发再生天数(其中Ⅱ与Ⅳ差异显著(P < 0.01))、毛发完全再生天数(其中Ⅱ与Ⅳ、Ⅲ与Ⅳ P < 0.05)、出现脱屑时间(其中:Ⅰ与Ⅱ、Ⅰ与Ⅲ P < 0.05)、出现皮疹时间(其中,Ⅰ与Ⅲ、Ⅰ与Ⅳ P < 0.05)等四个方面有差异,总体上有统计学意义(P < 0.05或P < 0.01)(参见表1)
2.2 皮肤病理改变结果
与对照组相比,实验组苏木精-伊红(HE)染色可见毛囊周围中性粒细胞增多伴堵塞、脓样嗜中性粒细胞在毛囊管外面集群所致的毛囊炎症(参见图2D、d)。与文献报道[8,11,12]相符。
与对照组相比,实验组油红O染色可见扩张、膨胀的的卵泡明显增多(参见图2E、e)。与文献报道[8,11,12]相符。毛孔扩张数:四组间有差异,总体上有统计学意义(P < 0.01)(其中:Ⅰ与Ⅱ、Ⅲ、Ⅳ差异显著 P < 0.01)(参见表2)。
2.3 免疫组化检测Ki67
Ki67:实验组Ki67稍高于对照组[13,14](参见图2F、f)。四组间无明显差异,无统计学意义(P > 0.05)(参见表2)。
3 讨论
EGFRIs所致皮肤毒性反应众多,其中痤疮样皮疹最为常见、严重。其机制尚未明确,目前相关研究如下:LacoutureME等[15]认为厄洛替尼(特罗凯)所致皮疹病理表现可分成4个阶段:(1)皮红肿和皮肤敏感性增加;(2)炎性细胞因子分泌和局部浸润;(3)T淋巴细胞增多的丘疹脓疱;(4)硬皮症。病理表现主要为:(1)表皮炎性细胞浸润并包绕过度角化和扩张的毛囊管;(2)表皮层化脓性毛囊炎伴上皮细胞层破裂。LenzHJ等[16]通过皮疹活检发现:病理多表现为毛囊周围炎和化脓性毛囊炎。钱军等[17]通过对患者皮肤组织活检发现 ,EGFRI相关皮疹表现为真皮上层、卵泡破裂层和上皮棘层松解层的一种混合性炎性反应。CunninghamD等[18]认为:EGFRI引起基底角质细胞生长停滞和过早成熟分化,并伴有中性粒细胞的释放。LacoutureME等[19]认为中性粒细胞释放的某些酶导致角质细胞凋亡,凋亡的细胞积聚在真皮下导致皮肤进一步的损伤, 最终形成触痛、丘疹脓疱和甲沟炎。Guttman-YasskyE等[20]在EGFRI患者的皮肤组织中检测到单核细胞,树突状细胞,巨噬细胞,T淋巴细胞的浸润,提示EGFRIs相关的皮疹最终可能与炎症相关。
此次实验用鼠为BALB/c雌性小鼠,主要考虑雄性小鼠之间通常有打斗、抓挠,不易于饲养、管理,且易出现抓痕等难于与皮疹等皮肤不良反应相鉴别,而雌性小鼠则较少出现上述现象,故本次实验暂用雌性小鼠,但我们将在后续研究中进一步比较探究不同性别小鼠的实验结果。实验组用药后在表皮出现毛发生长缓慢甚至脱落、脱屑、红疹等,在病理上表现为毛囊周围中性粒细胞群集伴堵塞而形成的毛囊炎、毛囊扩张,且对照组、实验组之间在毛发再生天数、毛发完全再生天数、脱屑时间、出现皮疹时间、毛孔扩张数等5方面的差异存在统计学意义(P < 0.01或P < 0.05),结合上述研究,本实验用浓度为10g/L的特罗凯溶液按100mg/kg对小鼠灌胃致其出现皮疹等不良反应,此模型在表皮组织、病理切片上的表现与DavidSurguladze等的文献报道基本相符,且可靠实用、具有可重复性,提示“EGFRIs所致皮疹”的动物模型建立基本成功,同时也印证了许多研究者关于“EGFRIs导致的皮疹为一种炎症反应”的观点。但四组小鼠在Ki67测试方面无统计学意义(P > 0.05)。结合既往研究:

表1 四组小鼠用特罗凯(Ⅱ、Ⅲ、Ⅳ组)、去离子水(Ⅰ组)干预前后毛发、皮肤变化出现的时间(±s,n=5)
注:与对照组(Ⅰ组)相比,*P< 0.05;与实验组(Ⅳ组)相比:△P< 0.05,■P< 0.01。
Note. Compared with control group(Ⅰ组),*P< 0.05. Compared with experimental group(Ⅳ组),△P< 0.05,■P< 0.01.

注:(A)对照7 d组;(B)对照12 d组;(C)对照16 d组;(a)实验7 d组;(b)实验12 d组;(c)实验16 d组图1 对照组和实验组小鼠在毛发和皮肤的变化Note.(A)Control group at 7 days.(B)Control group at 12 days.(C)Control group at 16 days.(a)Experimantal group at 7 days.(b)Experimantal group at 12 days.(c)Experimantal group at 16 days.Fig.1 Control group and experimantal group mice′s change in hairs and skins
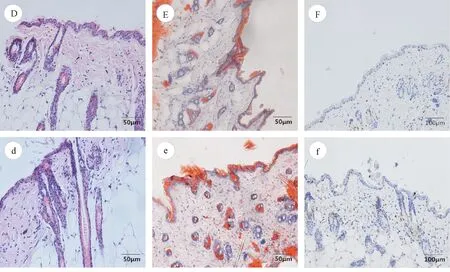
注:(D)对照组;(d)实验组(HE染色,×100)。(E)对照组;(e)实验组(油红O染色,×100)。(F)对照组;(f)实验组(免疫组化,×40)。图2 对照组、实验组小鼠皮肤组织在病理切片和免疫组化等方面的变化Note.(D)Control group.(d)Experimantal group ( HE staining,×100).(E)Control group.(e)Experimantal group( Oil Red O staining,×100).(F)Control group.(f)Experimantal group( Immunohistochemical staining,×40).Fig.3 Pathological and immunohistochemical changes of the skin tissue of mice in control group and experimantal group

组别Groups毛囊扩张ThenumberofporeexpansionKi67Ⅰ组ⅠGroup220±084025±014Ⅱ组ⅡGroup1940±152#025±061Ⅲ组ⅢGroup2080±148#026±002Ⅳ组ⅣGroup2280±228#026±006
注:与对照组(Ⅰ组)相比#P< 0.01。
Note. Compared with control group(Ⅰ组),#P< 0.01.
Mario.E在2006年阐明:基底层中角质形成细胞的EGFR受抑制会导致生长受限和过早分化,表现为细胞核相关抗原(Ki67)下调。吴萍等[13]的研究也表明:EGFR和Ki67在肿瘤发生、发展过程中呈协同作用。正常表皮中Ki67仅在基底层有弱阳性表达[14],该指标可以反应皮肤角质形成细胞的增殖是否受到影响。Ki67表达于所有活跃的细胞周期阶段,并随细胞周期改变[21]。Ki67单克隆抗体只标记G1后期、S期和G2期、M期细胞核抗原,且Ki67抗原半衰期短,这些特点使Ki67 成为优质的细胞增殖标记物[22]。此次动物实验并未得出特罗凯用药前后Ki67有统计学上的差异,可能与样本量稍小、小鼠取材前剃毛等因素存在相关性,抑或二者之间本无联系,临床有待进一步研究及验证。
随着靶向药物在临床中的应用逐渐增多,其导致的皮疹等不良反应在临床中也越发常见。但目前我们对特罗凯等靶向药物所致皮疹的原因、发病机制尚未明确,故无有效的、针对性强的药物。本文参考国内外相关文献,复制TKI类药物所致的皮疹动物模型,并通过观察小鼠用特罗凯前后在肉眼皮肤、病理切片、免疫组化等方面的改变对其进行验证,同时,进一步探讨了特罗凯的发病机制,为评价外用药、特别是中成药的有效性及作用机理提供动物模型。
(致谢:本实验由中日友好医院提供实验室、资金及设备,在此向中日友好医院表示感谢。并向提供部分资金资助的北京市科学技术委员会表示感谢。感谢导师崔慧娟教授的悉心指导,感谢邓博、徐央波、彭艳梅师姐及其他同门在实验过程中的帮助)
[1] Syrigos KN, Saif MW, Karapanagiotou EM,etal. The need for third-line treatment in non-small cell lung cancer: an overview of new options.[J]. Anticancer Res, 2011, 31(2):649-659.[2] Segaert S, Chiritescu G, Lemmens L,etal. Skin toxicities of targeted therapies.[J]. Eur J Cancer, 2009, 45(Sup 1):295-308.[3] Pérez-Soler R, Delord J P, Halpern A,etal. HER1/EGFR inhibitor-associated rash: future directions for management and investigation outcomes from the HER1/EGFR inhibitor rash management forum.[J]. Oncologist, 2005, 10(5):345-356.
[4] Pérez-Soler R, Chachoua A, Hammond LA,etal. Determinants of tumor response and survival with erlotinib in patients with non—small-cell lung cancer[J]. J Clin Oncol, 2004, 22(16):3238-3247.
[5] Saltz LB,Kies MS,Abbruzzese JL,etal. The presence and intensity of the cetuximab-induced acne-like rash predicts increased survival in studies across multiple malignancies[J].Proc Am Soc Clin Oncol, 2003,22(abstr817):204.
[6] 赵洪云, 张阳, 黄河,等. 厄罗替尼治疗晚期非小细胞肺癌患者的临床疗效[J]. 癌症, 2008, 27(4):393-399.
[7] Kim ST, Uhm JE, Lee J,etal. Randomized phase II study of gefitinib versus erlotinib in patients with advanced non-small cell lung cancer who failed previous chemotherapy[J].Lung Cancer, 2012, 75(1):82-88.
[8] Surguladze D, Deevi D, Claros N,etal. Tumor necrosis factor-alpha and interleukin-1 antagonists alleviate inflammatory skin changes associated with epidermal growth factor receptor antibody therapy in mice[J]. Cancer Res, 2009, 69(14):5643-5647.
[9] Olaussen K A,Dunant A, Fouret P,etal.DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J]. N Engl J Med, 2006, 355(10):983-991.
[10] Mak KK, Chan SY. Epidermal growth factor as a biologic switch in hair growth cycle[J]. J Biol Chem, 2003, 278(28):26120-6.[11] Lacouture ME. Mechanisms of cutaneous toxicities to EGFR inhibitors[J]. Nat Rev Cancer, 2006, 6(10):803-812.
[12] Busam KJ, Capodieci P, Motzer R,etal. Cutaneous side-effects in cancer patients treated with the antiepidermal growth factor receptor antibody C225[J]. Br J Dermatol, 2001, 144(6):1169-1176.
[13] 吴萍, 张锦, 李蓉,等. 表皮生长因子受体EGFR和Ki67在非小细胞肺癌中的表达及其相关性研究[J]. 中华肿瘤防治杂志, 2004, 11(9):913-918.
[14] 张敏, 张谊之, 李俸媛. 银屑病皮损区c-myc、c-jun、Ki-67、PCNA、VEGF的表达[J]. 四川大学学报(医学版), 2002, 33(3):427-430.
[15] Lacouture ME.Mechanisms of cutaneous toxicities to EGFR inhibitors [J].Nat Rev Cancer, 2006,6(10):803-812.
[16] Lenz HJ. Anti-EGFR mechanism of action: antitumor effect and underlying cause of adverse events[J].Oncology(Williston Park) ,2006,20(5 Suppl2):5-13.
[17] 钱军, 李慧, 秦叔逵. EGFRI皮肤毒性的发生机制和处理策略[J]. 现代肿瘤医学, 2009, 17(6):1186-1191.
[18] Cunningham D, Humblet Y, Siena S,etal.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J]. N Engl J Med, 2004, 351(4):337-345.
[19] Lacouture ME, Lai SE. The PRIDE (Papulopustules and/or paronychia, Regulatory abnormalities of hair growth, Itching, and Dryness due to Epidermal growth factor receptor inhibitors) syndrome[J]. Br J Dermatol, 2006, 155(4):852-854.
[20] Guttman-Yassky E, Mita A, De Jonge M,etal. Characterisation of the cutaneous pathology in non-small cell lung cancer (NSCLC) patients treated with the EGFR tyrosine kinase inhibitor erlotinib[J]. Eur J Cancer, 2010, 46(11):2010-2019.[21] Romero Q, Bendahl PO, Klintman M,etal. Ki67 proliferation in core biopsies versus surgical samples-a model for neo-adjuvant breast cancer studies[J].BMC Cancer,2011,11(1):341.
[22] Yerushalmi R, Woods R, Ravdin PM,etal. Ki67 in breast cancer: prognostic and predictive potential[J]. Lancet Oncol, 2010, 11(2):174-183.
The establishment of mouse model of Erlotinib-induced skin adverse reactions
SONG Ya-zhong1, XU Yang-bo1, DENG Bo2, CUI Hui-juan2*, PENG Yan-mei1, LIU Dai-wei1, WANG Kai-han1,LIU Fan1,DUAN Hua1,QIU Yu-qin1,LI Qiang1
(1.Beijing University Of Chinese Medicine,Beijing 100029,China;2.China-Japan Friendship Hospital,Beijing 100029,China)
Objective Erlotinib (Trade Name: Tarceva) is a new targeted drug for the treatment of non-small cell lung cancer (NSCLC) that has a wide clinical application in recent years, but commonly carries many side effects, among which the most common and unbearable one is rash. The aim of this study is to observe the changes of epidermis, pathology, immunohistochemistry and other aspects before and after the application of Tarceva in mice and try to copy the rash animal models caused by Tarceva and thus to provide models for the clinical topical medications of rash. Methods 20BALB/c female mice were randomly divided into four groups.The experimental group(Ⅱ、Ⅲ、Ⅳ group) was given 100 mg/kg dosage with the concentration of 10 g/L erlotinib solution by gavage, and the control group (I group)with an equal volume of deionized water by gavage once daily. The hairs from the head,neck and back of each mouse were removed 24 hours prior to the administration,and at the end of the experiment, clipping the skin in the neck, back and waist ,then observed differences between the experimental group and the control group in mice skin, biopsy, immunohistochemistry and the like. Results (1)There were statistically significance (P< 0.01 orP< 0.05) in the four groups of mice in five aspects as hair regrowth days, days of the complete regrowth of hair, desquamation time , the time of appearance of rash and the number of pore expansion;(2)Ki67:There were no statistically significant differences among the four groups(P> 0.05).Conclusions (1)This experiment confirms many researchers’ point of view that “the rash induced by EGFRIs is an inflammatory response”(2)A mouse model of rash induced by FGFRIs is successfully established,and this is a reliable,practical and reproducible model which applies to a large number of establishment of "EGFRIs drug-induced rash in animal models",and can be popularized for clinical,experimental and institutional uses.
Erlotinib;Rash;Skin;Pathology;Immunohistochemistry
中日友好医院院内课题(2013-MS-42);北京市科技计划首都临床特色应用研究专项(Z151100004015168)。
宋亚中(1989-),男,硕士研究生,专业:中西医结合肿瘤内科。E-mail:18800100355@163.com
崔慧娟(1963-),女,教授,博士生导师,研究方向:中西医结合肿瘤内科及靶向药物所致皮疹等不良反应。E-mail: cuihj1963@163.com
研究报告
R-332
A
1671-7856(2017) 01-0016-06
10.3969.j.issn.1671-7856.2017.01.004
2016-06-13

