Aire对巨噬细胞极化影响的研究①
朱武飞 罗亚东 赵 博 王艳玲 杨 巍
(吉林大学基础医学院免疫学系,长春130021)
·基础免疫学·
Aire对巨噬细胞极化影响的研究①
朱武飞 罗亚东 赵 博 王艳玲②杨 巍③
(吉林大学基础医学院免疫学系,长春130021)
目的:研究自身免疫调节因子(Aire)对巨噬细胞极化的影响。方法:分别用LPS、IL-4以及LPS联合免疫复合物刺激小鼠单核巨噬细胞系RAW264.7细胞、稳定表达GFP-Aire的RAW264.7细胞(A33-3)细胞和稳定表达GFP的RAW264.7细胞(C1-6),使其向M1(LPS)、M2a(IL-4)和M2b(LPS联合免疫复合物)型巨噬细胞极化。通过Real-time PCR检测各组细胞中M1型巨噬细胞特征分子IL-1α、iNOS和IL-6,M2a型特征分子Arg-1和M2b型特征分子IL-10的表达水平,研究Aire对各种类型巨噬细胞极化的影响。结果:LPS在 0.5 μg/ml浓度时,RAW264.7细胞中M1型巨噬细胞产物IL-1α、iNOS和IL-6基因表达量最高;而IL-4以及LPS联合免疫复合物的刺激作用有显著的剂量依赖性,都在浓度最高时RAW264.7细胞中Arg1(M2a)和IL-10(M2b)基因表达量最高。LPS刺激后,A33-3细胞中IL-1α和iNOS表达水平明显高于C1-6细胞,IL-6则相反;IL-4及LPS联合免疫复合物刺激后,A33-3细胞中Arg1和IL-10的表达水平明显低于C1-6细胞。结论:Aire可能促进巨噬细胞向M1极化,同时抑制其向M2a和M2b极化。
自身免疫调节因子;巨噬细胞;极化
自身免疫调节因子(Aire)是一种转录因子,人类Aire基因的突变将导致由自身免疫应答所介导的、以多器官损伤为特征的一种常染色体隐性遗传病(Autoimmune polyendocrinopathy candidiasis ectoderm-al dystrophy,APECED),也称为自身免疫性多腺体综合征 Ⅰ(Autoimmune polyendocrine syndrome type Ⅰ,APS-Ⅰ)。APECED其典型临床表现为甲状旁腺功能减退、Addison′s病和慢性皮肤黏膜念珠菌感染的三联征[1]。现有的研究证实Aire主要表达在胸腺上皮细胞,起到维持中枢耐受的作用。然而,对APECED病人易患慢性皮肤黏膜念珠菌感染仍然没有合理的解释。有研究发现Aire也表达于外周巨噬细胞,但其具体功能作用以及与念珠菌感染之间是否存在联系尚不清楚。我们前期的研究发现TLR1、TLR3和TLR8在过表达Aire的小鼠的巨噬细胞系RAW264.7细胞中是上调的[2,3],提示Aire可能在抗原提呈细胞针对病原体的应答中发挥重要作用。
巨噬细胞作为一类重要的抗原提呈细胞,广泛分布于机体,最近研究表明巨噬细胞具有明显的异质性,表现为针对不同微环境应答可使其功能状态发生改变。目前认为巨噬细胞可以功能性地极化为M1型(经典激活的巨噬细胞)或M2型(非经典激活的巨噬细胞)。M1型巨噬细胞由Ⅰ型干扰素(IFN-γ)和微生物代谢产物(LPS)激活,通过产生大量促炎细胞因子如白介素1(IL-1)、IL-6、IL-23、超氧化物阴离子和NO[4,5],具有杀灭细菌、真菌等多种病原体的潜能和介导宿主防御的功能。根据表达的活化标志不同M2型巨噬细胞又可分成三个亚群:M2a、M2b和M2c。Th2细胞产生的细胞因子IL-4/IL-13可促进M2a巨噬细胞极化,通过产生精氨酸1(Arg1)和细胞外基质(ECM)参与组织重构。用免疫复合物或Toll样受体(TLR)激动剂可诱导M2b极化。M2c则被抗炎物质所诱导,如糖皮质激素或IL-10[6,7]。目前,大多数研究都集中在巨噬细胞的异质性以及M1和M2巨噬细胞的产生条件。然而,调控M1和M2巨噬细胞极化的分子机制还没有得到深入的研究。
鉴于Aire突变可导致机体易感染念珠菌,而M1型巨噬细胞又具有抵抗真菌的作用,那么Aire是否可通过参与不同类型巨噬细胞的极化过程,从而在抗真菌感染中发挥作用有待探究。因此本研究试图通过观察Aire对巨噬细胞极化类型的影响,探讨其在外周免疫系统如抗真菌感染中的作用。
1 材料与方法
1.1 细胞系 RAW264.7细胞从上海细胞研究所获得。课题组前期已完成稳定转染pEGFPC1/Aire 和pEGFPC1质粒至RAW264.7细胞中,分别得到A33-3和C1-6细胞[6],用含10%胎牛血清的RPMI-1640(Gibco,USA)进行培养。
1.2 方法
1.2.1 巨噬细胞亚群的极化 RAW264.7细胞调浓度至1×106ml-1,吸取细胞悬液加至6孔细胞培养板,每孔2 ml含 10%NCS的RPMI1640,置于37℃、5% CO2培养箱中培养过夜。RPMI1640洗一遍细胞,然后用LPS(Sigma,USA),IL-4(R&D Systems, minneapoils,MN)和LPS联合免疫复合物(OVA和抗OVA IgG)(Sigma,USA)刺激24 h后收细胞。
1.2.2 RT-PCR 从细胞中提取总RNA(如上所述)用TRIzol(Invitrogen,USA)裂解,溶解于DEPC水中。用紫外分光光度计检测总RNA的A260/A280的比值和浓度。取1 μg RNA为模板,加入随机引物和AMV逆转录酶(TaKaRa,Japan)逆转录成cDNA,反应条件:30℃ 10 min,45℃ 30 min,5℃ 5 min,1循环。cDNA用表1中的引物进行PCR。应用ImageMaster VDS(Pharmacia Biotech,China)图像分析软件分析光密度值,各种基因的mRNA表达水平均表示为目的基因/β-actin光密度值。
表1 RT-PCR和Real-time PCR所用引物及其扩增片段大小
Tab.1 Primers for RT-PCR and quantitative Real-time PCR and their amplification size

GenePrimer(5′→3′)Amplificationsize(bp)GAPDH5′⁃GACTTCAACAGCAACTCCCACTC⁃3′1075′⁃TAGCCGTATTCATTGTCATACCAG⁃3′IL⁃1α5′⁃ACAGTTCTGCCATTGACCATCTC⁃3′1945′⁃CTTCAGAATCTTCCCGTTGCTTG⁃3′IL⁃65′⁃GAAACCGCTATGAAGTTCCTCTCTG⁃3′1255′⁃GTATCCTCTGTGAAGTCTCCTCTCC⁃3′iNOS5′⁃TGGAGCGAGTTGTGGATTGTC⁃3′1465′⁃GGTCGTAATGTCCAGGAAGTAG⁃3′IL⁃105′⁃GCTCTTACTGACTGGCATGAGGA⁃3′1795′⁃AGGAGTCGGTTAGCAGTATGTTG⁃3′LIGHT5′⁃GAGAAGCTGATACAAGATCAACGA⁃3′1035′⁃CCCATAACAGAGGTCCACCAATA⁃3′Arg15′⁃GCATATCTGCCAAAGACATCGT⁃3′1235′⁃CAATCCCCAGCTTGTCTACTTCA⁃3′
1.2.3 Real-time PCR 取上述cDNA为模板,以表1中的引物,采用SYBR Premix Ex Taq试剂盒(TaKaRa,Japan)和ABI7300仪器(Life Technol-ogies,USA)进行实时定量PCR反应,条件为:95℃ 30 s,95℃ 5 s和60℃ 30 s,40循环。结果用公式 2-ΔΔCt计算。
2 结果
2.1 不同的刺激物刺激巨噬细胞的极化 为了确定RAW264.7细胞是否能够极化为不同类型的巨噬细胞,并明确激活巨噬细胞亚群的各种刺激物的有效浓度,分别采用不同浓度LPS、IL-4和LPS联合免疫复合物来刺激RAW264.7细胞。结果显示,LPS浓度在 0.5 μg/ml时,M1的产物IL-1α、IL-6和诱导的一氧化氮合成酶(iNOS)的水平在RAW264.7细胞中明显地上调(图1)。经IL-4和LPS联合免疫复合物刺激后,RAW264.7细胞中Arg1和IL-10基因表达呈剂量依赖的方式增加(图2)。因此确定IL-4在200 pg/ml和0.5 μg/ml LPS联合IC3(150 μg/ml OVA和15 μl anti-OVA IgG)分别为M2a和M2b极化的最佳浓度,用于后续实验。结果表明不同刺激物可激活RAW264.7细胞分化为M1或M2型巨噬细胞。
2.2 Aire促进M1型巨噬细胞极化 为了研究Aire是否影响M1型巨噬细胞的极化,采用0.5 μg/ml LPS刺激C1- 6和A33-3细胞, Real-time PCR检测特异的M1型巨噬细胞相关标志的表达。结果显示LPS刺激后,与C1-6细胞相比,A33-3细胞中iNOS和IL-1α表达增加,而IL-6表达水平降低(图3)。这些数据表明Aire可能促进M1的极化。

图1 不同浓度的LPS刺激下RAW264.7细胞产生的 IL-1α、IL-6 和 iNOS的表达量Fig.1 Dose effects of IL-1α,IL-6 and iNOS produced by RAW264.7 cells in response to LPSNote:A.The expression of different genes in RAW264.7 cells stimulated with 0,0.5,5.0 or 50 μg/ml LPS (Lanes 1-4);B.The gene/β-actin optical density values from the top electrophoregram were calculated and plotted. All data were obtained from three independent experiments and expressed as the ±s.

图2 RAW264.7 细胞中Arg-1和IL-10各自对不同刺激物的剂量反应Fig.2 Dose effects of Arg-1 and IL-10 produced by RAW264.7 cells in response to different stimuliNote: A. RAW264.7 cells were stimulated with different doses of IL-4:0,10,50,100 or 200 pg/ml (Lanes 1-5);B.RAW264.7 cells were stimulated with 0.5 μg/ml LPS with different doses of immune complexes. Lanes 1-6 represent normal saline,150 μg/ml OVA,LPS+150 μg/ml OVA,LPS+IC.1 (150 μg/ml OVA+2.5 μl anti-OVA IgG),LPS+IC.2 (150 μg/ml OVA+5 μl anti-OVA IgG),LPS+IC.3 (150 μg/ml OVA+15 μl anti-OVA IgG).The bottom graphs were plotted with the gene/β-actin optical density values from the top electropherogram. All data were obtained from three independent experiments and expressed as the ±s.

图3 LPS刺激对C1-6和A33-3细胞中IL-1α、IL-6和iNOS表达水平的影响Fig.3 Stimulation with LPS affects expression levels of iNOS,IL-1α and IL-6 in C1-6 and A33-3 cellsNote: A. The expression levels of iNOS and IL-1α in C1-6 and A33-3 stimulated with LPS;B. The expression levels of IL-6 in C1-6 and A33-3 stimulated with LPS. All data were obtained from three independent experiments and expressed as the ±s. a,b and c represent comparisons of stimulated C1-6,unstimulated A33-3 and stimulated A33-3 cells,respectively,with unstimulated C1-6 cells.**.P< 0.01.
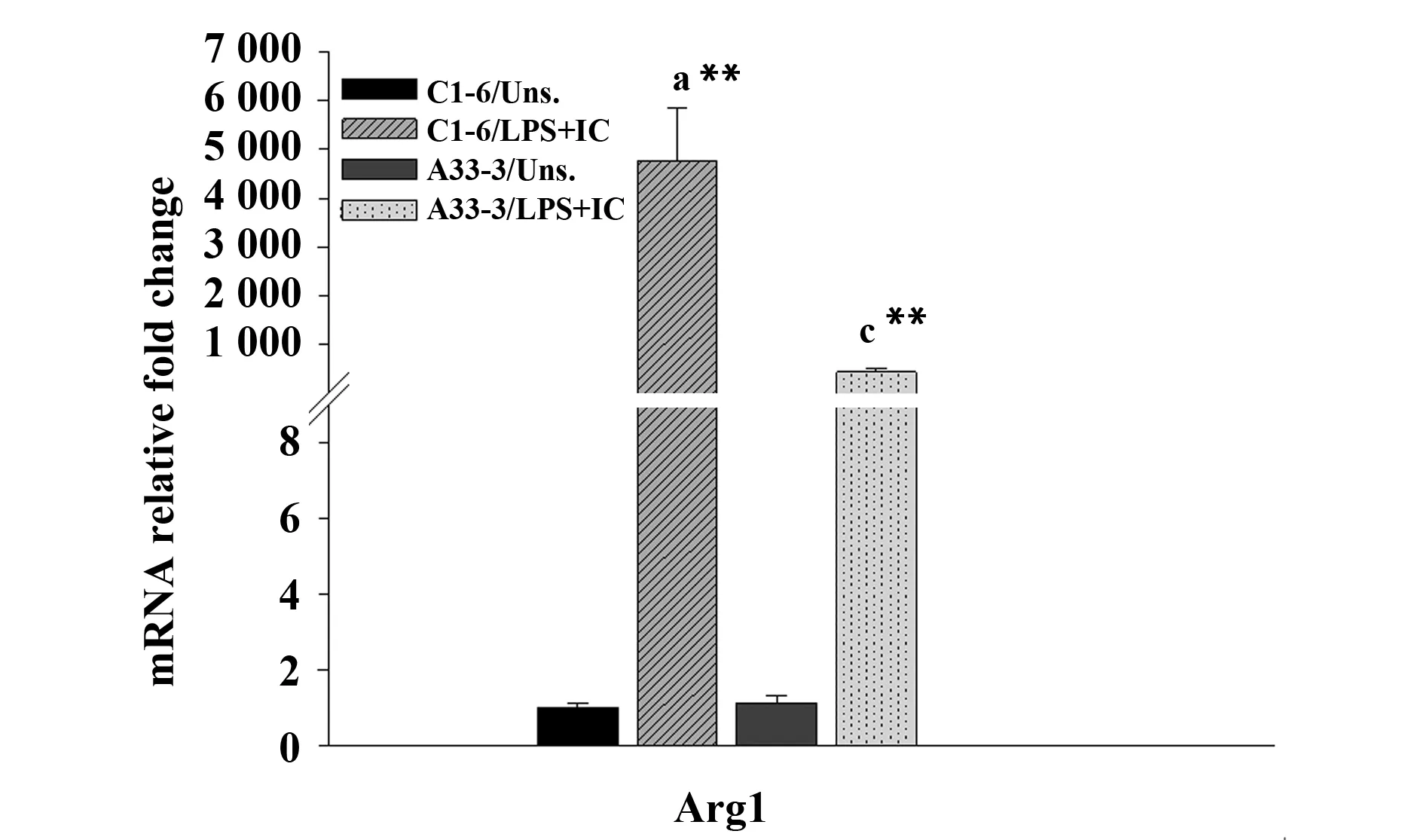
图4 IL-4刺激对C1-6和A33-3细胞中Arg1表达水平的影响Fig.4 Stimulation with IL-4 affects expression levels of Arg1 in C1-6 and A33-3 cellsNote: All data were obtained from three independent experiments and expressed as the ±s. a and c represent comparisons of stimulated C1-6 and stimulated A33-3 cells,respectively,with unstimulated C1-6 cells. **.P<0.01.
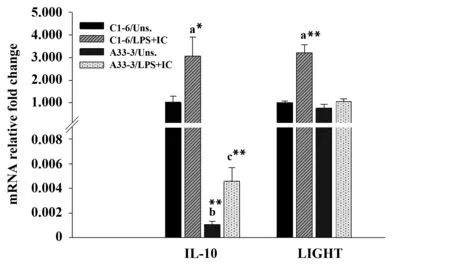
图5 LPS联合免疫复合物刺激对C1-6和A33-3细胞中IL-10和LIGHT表达水平的影响Fig.5 Stimulation of LPS along with IC effects on expression levels of IL-10 and LIGHT in C1-6 and A33-3 cellsNote: All data were obtained from three independent experiments and expressed as the ±s. a,b and c represent comparisons of stimulated C1-6,unstimulated A33-3 and stimulated A33-3 cells,respectively,with unstimulated C1-6 cells. *.P< 0.05,**.P< 0.01.
2.3 Aire抑制M2a型巨噬细胞极化 为进一步研究Aire对M2a巨噬细胞极化的影响。采用200 pg/ml IL-4刺激后,Real-time PCR检测结果发现相比于C1-6细胞,A33-3细胞中Arg-1基因表达较低(图4)。说明Aire可能抑制M2a极化。
2.4 Aire抑制M2b型巨噬细胞极化 为明确Aire是否也影响另一种M2型巨噬细胞——M2b的极化。采用0.5 μg/ml LPS联合IC3分别刺激A33-3和C1-6细胞,Real-time PCR检测M2b相关分子的表达。结果显示在有或没有刺激物时,相比于C1-6细胞A33-3细胞中IL-10的表达均显著降低。然而,在刺激后A33-3细胞中LIGHT基因的表达并未发生变化(图5)。表明Aire可能抑制M2b极化。
3 讨论
本研究中,我们发现不同的诱导剂刺激可使RAW264.7细胞分别极化为M1、M2a和M2b型巨噬细胞。并且相比于C1-6细胞,A33-3细胞中M1型巨噬细胞特异的下游分子IL-1α和iNOS的表达增加,而M2a和M2b型巨噬细胞特异的下游分子表达降低。说明AIRE可能促进M1极化,抑制M2极化。
M1型巨噬细胞的极化发生在Th1细胞介导的免疫应答过程中[8],在清除胞内病原体中发挥重要作用。在感染早期,激活的NK细胞和Th1细胞分泌大量的IFN-γ,为促进M1极化的重要物质。其他的细菌产物如LPS或某些细胞因子(TNF和GM-CSF)也可以诱导M1极化。活化的M1型巨噬细胞分泌大量促炎细胞因子(IL-1、IL-6和IL-23)和大量的NO和超氧阴离子,从而增强细胞的杀伤能力和抗感染能力。本研究表明在LPS刺激M1巨噬细胞极化过程中,A33-3细胞中IL-1α和iNOS的mRNA的表达水平显著高于C1-6细胞,而IL-6的表达水平降低。iNOS可以促进瓜氨酸形成NO,增加巨噬细胞的杀伤和抗感染能力。IL-1在免疫防御中也具有重要作用。另外,过多分泌的IL-6和IL-23也可以引起组织损伤。IL-6和IL-23与Th17细胞的分化和增殖有关[9-11]。Th17分泌的IL-17可以引起组织中大量多形核白细胞的募集,导致一种炎症性自身反应,因此Aire可能通过促进巨噬细胞极化为M1发挥抗感染作用,同时抑制IL-6分泌所诱导的自身反应性炎症。
M2a巨噬细胞的极化可以被Th2型细胞分泌的IL-4和IL-13所诱导[8]。这些巨噬细胞有较弱的杀伤病原体的能力且不具有提呈外来抗原的能力[12]。然而,它可以产生大量的Arg-1,催化精氨酸变为鸟氨酸,鸟氨酸是一种多胺和胶原的前体,有助于形成细胞外基质(ECM)[13],这些复合物都具有促进伤口愈合的功能。我们研究发现IL-4刺激后,A33-3细胞中Arg1的上调水平较C1-6细胞低,证明Aire可抑制M2a的极化。M2b和M2c都具有免疫调节作用,经常被称为调节型巨噬细胞。在体外试验中,IgG免疫复合物或TLR激动剂刺激下,会产生M2b[14],M2b巨噬细胞高表达免疫抑制性细胞因子IL-10。本研究结果表明,LPS联合OVA和anti-OVA IgG免疫复合物可以促进巨噬细胞的极化,并且相比于未刺激的细胞,刺激后A33-3和C1-6细胞中IL-10的表达水平明显增加,但A33-3细胞中IL-10的表达明显低于C1-6细胞(无论刺激前或刺激后)。表明Aire可能通过降低IL-10的表达抑制M2b巨噬细胞极化。
然而,Aire调节巨噬细胞极化的机制尚不明确。最近一项研究证明Micro RNA 155(miR-155)是调控M1型巨噬细胞极化的关键分子[15]。过表达miR-155可以将抗炎的M2型巨噬细胞转变为促炎的M1型巨噬细胞。相反,沉默M1中miR-155可使M1型巨噬细胞重新极化为M2型[15]。此外,Macedo等[16]发现胸腺髓质上皮细胞中的Aire可调控miR-155的表达。因此,我们推测miR-155可能在Aire诱导M1极化过程中发挥重要作用,但还需要进一步研究证实。
综上,在巨噬细胞极化为不同亚群的过程中,Aire可促进M1极化,同时抑制M2的极化,有助于机体形成抗感染能力,参与某些病原体(包括真菌)的清除,这也为APECED病人出现的真菌易感提供了一个新的解释。
[1] Perheentupa J.Autoimmune polyendocrinopathy--candidiasis--ectodermal dystrophy (APECED)[J].Horm Metab Res,1996,28(7):353-356.
[2] Zhu W,Yang W,He Z,etal.Overexpressing autoimmune regulator regulates the expression of toll-like receptors by interacting with their promoters in RAW264.7 cells[J].Cell Immunol,2011,270(2):156-163.
[3] Wu J,Zhu W,Fu H,etal.DNA-PKcs interacts with Aire and regulates the expression of Toll-like receptors in RAW264.7 cells[J].Scand J Immunol,2012,75(5):479-488.
[4] Gordon S,Taylor PR.Monocyte and macrophage heterogeneity[J].Nat Rev Immunol,2005,5 (12):953-964.
[5] Gordon S.The macrophage:past,present and future[J].Eur J Immunol,2007,37(S1):S9-S17.
[6] Gordon S.Alternative activation of macrophages[J].Nat Rev Immunol,2003,3(1):23-35.
[7] Martinez FO,Hel ming L,Gordon S.Alternative activation of macrophages:an immunologic functional perspective[J].Annu Rev Immunol,2009,27:451-483.
[8] Mills CD,Kincaid K,Alt JM,etal.M-1/M-2 macrophages and the Th1/Th2 paradigm[J].J Immunol,2000,164(12):6166-6173.
[9] Bettelli E,Carrier Y,Gao W,etal.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[10] Zheng SG,Wang J,Horwitz DA.Cutting edge:Foxp3+CD4+CD25+regulatory T cells induced by IL-2 and TGF-beta are resistant to Th17 conversion by IL-6[J].J Immunol,2008,180(11):7112-7116.
[11] Lee Y,Awasthi A,Yosef N,etal.Induction and molecular signature of pathogenic TH17 cells[J].Nat Immunol,2012,13(10):991-999.
[12] Edwards JP,Zhang X,Frauwirth KA,etal.Biochemical and functional characterization of three activated macrophage populations[J].J Leukoc Biol,2006,80(6):1298-1307.
[13] Shiraishi M,Shintani Y,Shintani Y,etal.Alternatively activated macrophages deter mine repair of the infarcted adult murine heart[J].Curr Opin Immunol,2016,126(6):2151-2166.
[14] Gerber JS,Mosser DM.Reversing lipopolysaccharide toxicity by ligating the macrophage Fc gamma receptors[J].J Immunol,2001,166(11):6861-6868.
[15] Cai X,Yin Y,Li N,etal.Re-polarization of tumor-associated macrophages to pro-inflammatory M1 macrophages by microRNA-155[J].J Mol Cell Biol,2012,4(5):341-343.
[16] Macedo C,Evangelista AF,Marques MM,etal.Autoimmune regulator (Aire) controls the expression of microRNAs in medullary thymic epithelial cells[J].Immunobiology,2013,218(4):554-560.
[收稿2016-08-01]
(编辑 张晓舟)
Effects of Aire on macrophage polarization
ZHUWu-Fei,LUOYa-Dong,ZHAOBo,WANGYan-Ling,YANGWei.
DepartmentofImmunology,CollegeofBasicMedicalSciences,JilinUniversity,Changchun130021,China
Objective:To study whether autoimmune regulator (Aire) affects macrophage polarization.Methods: The mouse mononuclear macrophage cell line RAW264.7 cells,stable expressing GFP-Aire protein RAW264.7 cells (A33-3) and stable expressing GFP protein RAW264.7 cells (C1-6) were stimulated with LPS,IL-4 and LPS combined with immune complex respectively to make the macrophage polarize to M1 (LPS),M2a (IL-4) and M2b (LPS with immune complex).To investigate the effects of Aire on the various types of macrophages polarization,the M1 related molecules (IL-1α,iNOS and IL-6),M2a related molecules (Arg-1) and M2b related molecule (IL-10) were detected by Real-time PCR.Results: The expression of IL-1α,IL-6 and inducible nitric oxide synthase (iNOS),the products of M1 macrophages,were significantly upregulated in RAW264.7 cells treated with LPS at 0.5 μg/ml.The expression of Arg-1 and IL-10 mRNA in RAW264.7 cells increased in a dose-dependent manner after stimulation with IL-4 or LPS combined with immune complexes,respectively.M1 macrophage-related marker iNOS and IL-1 increased,whereas IL-6 levels decreased in A33-3 cells compared with C1-6 cells after treatment with LPS.The expression of Arg1 and IL-10 were downregulated in A33-3 cells compared with C1-6 cells after IL-4 and LPS combined with immune complexes stimulation,respectively.Conclusion: Aire may promote M1 macrophage polarization while inhibit M2a and M2b macrophage polarization.
Autoimmune regulator;Macrophage;Polarization
10.3969/j.issn.1000-484X.2017.01.002
①本文受国家自然科学基金项目(81373127)和吉林省科技厅项目(20160414038GH)资助。
朱武飞(1981年- ),男,博士,主要从事免疫耐受方面的研究。
R392
A
1000-484X(2017)01-0011-05
②吉林大学基础医学院病原免疫细胞遗传学实验中心,长春130021。
③通讯作者,E-mail:ywei@jlu.edu.cn。