原头蚴体外刺激巨噬细胞高表达PPARα/γ并调节其极化①
陈聪哲 董 丹 方海瑞 蒋红群 侯 隽 杨 琨 郭 峰 陈雪玲
(石河子大学医学院免疫学教研室,石河子832000)
原头蚴体外刺激巨噬细胞高表达PPARα/γ并调节其极化①
陈聪哲 董 丹 方海瑞 蒋红群 侯 隽 杨 琨 郭 峰 陈雪玲
(石河子大学医学院免疫学教研室,石河子832000)
目的:探讨原头蚴与RAW264.7共培养后PPARα/γ的表达水平以及对巨噬细胞极化的作用。方法:原头蚴与RAW264.7共培养12、 24、 36、 48、72 h取细胞。用qRT-PCR的方法检测RAW264.7细胞PPARα/γ的表达水平,用qRT-PCR的方法检测巨噬细胞M1型相关因子TNF-α、MCP-1、IL-1β和M2型相关因子Arg-1、TGF-β、Fizz-1的水平,ELISA的方法检测Arg-1和MR的表达量。结果:RAW264.7细胞PPARα/γ的表达水平和M2型相关因子Arg-1、TGF-β、Fizz-1和MR均逐渐升高,72 h表达最高(P<0.05);巨噬细胞M1型相关因子TNF-α、MCP-1、IL-1β先升高后降低(P<0.05),Arg-1和MR的蛋白水平也逐渐增高。结论:原头蚴与RAW264.7共培养后PPARα/γ的表达逐渐升高,可能促进巨噬细胞由M1型向M2型极化,从而在虫体免疫逃逸中发挥一定作用。
原头蚴;巨噬细胞;PPARα/γ;极化
棘球蚴病(Hydatid disease)又称包虫病是由棘球蚴绦虫幼虫寄生于人畜体内而导致感染的人畜共患病,主要分布于牧区。其中由细粒棘球蚴绦虫(Echinococcus granulosus,Eg)引起的囊性包虫病多见。人类是其中间宿主[1]。人类感染包虫病的主要部位为肝(65%),其次为肺(25%)[2]。细粒棘球蚴病是慢性感染性疾病,虫体之所以能长期寄生在宿主体内并对宿主各器官造成不同伤害,可能与宿主的免疫逃逸功能有关[3]。
过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptors,PPARs),是一种类固醇受体,属于由配体激活的Ⅱ型核受体超家族成员[4],分为三个亚型即α、β和γ。 PPAR-α主要分布于肝、肾、褐色脂肪组织(BAT),在脂肪酸氧化、应激、炎症反应以及肝脏的纤维化中起重要作用[5]。 PPAR-γ主要在脂肪组织、肝、肾、单核巨噬细胞、平滑肌细胞等表面表达[6]。有研究显示,PPAR-γ的功能复杂多样,它参与抗炎反应,调节糖脂代谢,诱导肿瘤细胞的凋亡和分化,抑制肿瘤血管生成,抗动脉粥样硬化,改善心功能和参与心室重构等。然而包虫病作为一种感染性疾病,对于PPAR-γ和PPAR-α的表达研究尚未见报道。故本文主要研究包虫病感染早期PPAR-γ和PPAR-α的表达水平。
巨噬细胞在不同的微环境下有不同表型,分为促炎的M1型和抗炎的M2型[7]。TNF-α、单核细胞趋化蛋白-1(MCP-1)和IL-1β是巨噬细胞M1型相关因子,精氨酸酶-1(Arg-1)、TGF-β、MR(甘露糖受体)和Fizz-1(与M2型巨噬细胞相关)。Th1型细胞因子如LPS可以促使巨噬细胞向M1型极化,相反Th2型细胞因子如IL-4可以促使巨噬细胞向M2型极化[8]。有文献证明PPARα/γ参与调节巨噬细胞极化,抑制巨噬细胞向M1型极化,促使巨噬细胞向M2型极化[9]。巨噬细胞在天然免疫中发挥重要作用,故本文还将研究包虫病时PPARα/γ对巨噬细胞极化的调节,为进一步研究包虫病早期免疫逃逸机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验材料 RAW264.7细胞,购自中科院上海细胞库。
1.1.2 主要试剂和仪器 DMEM培养基,RPMI-1640培养基,胎牛血清(FBS)均购自Hyclone公司;总RNA提取试剂盒,逆转录试剂盒,荧光染料(SYBR Green Ⅰ)均购自QIAGEN公司,荧光定量PCR仪购自美国Bio-Rad公司;MR和Arg-1 ELISA检测试剂盒购自武汉优尔生生物科技有限公司。
1.1.3 内参引物 根据Genebank中小鼠PPAR-γ,MCP-1,Arg-1及内参β-actin的基因序列,应用primer 5软件进行分析和比较,选取适当的区域合成引物,并由上海生工公司合成,引物序列见表1。
1.2 方法
1.2.1 细粒棘球蚴原头蚴的采集及制备悬液 从昌吉屠宰场购买感染细粒棘球蚴病的羊肝,酒精消毒,清洗。选取无钙化的,无感染的,囊泡完整的单囊型包囊内容物(囊液清澈),置于无菌容器中,待原头节(Protoscole,PSC)自然沉淀,用含1%双抗(100 U/ml青霉素和链霉素)的无菌PBS(pH7.3)清洗3次,去除活性较差的原头蚴以及育囊碎片,用含双抗的PBS重悬头节,取10 μl悬液用0.5%的伊红染色5 min,显微镜下鉴定虫体活性(活性>90%),用含双抗的PBS将悬液稀释成浓度10 000个/ml,备用。
1.2.2 RAW264.7细胞体外培养 将RAW264.7细胞培养至对数期,以每孔浓度为1×106接种于6孔板上,每孔1 ml,进行下面处理。
表1 RT-PCR引物
Tab.1 Primer of RT-PCR

PrimernameNucleotidesequenceβ⁃actinF5′⁃AATTCCATCATGAAGTGTGA⁃3′R5′⁃ACTCCTGCTTGCTGATCCAC⁃3′PPAR⁃αF5′⁃GCTGGTGTACGACAAGTG⁃3′R5′⁃GTGTGACATCCCGACAGAC⁃3′PPAR⁃γF5′⁃TACCACAGTTGATTTCTCCAGC⁃3′R5′⁃CCACAGACTCGGCACTCAAT⁃3′TNF⁃αF5′⁃GAGAGGCAGAGGACACTCAATG⁃3′R5′⁃GCTCAGGTTGTGGCGGATG⁃3′MCP⁃1F5′⁃ATGCAGGTCCCTGTCATG⁃3′R5′⁃GCTTGAGGTGGTTGTGGA⁃3IL⁃1βF5′⁃CGCTCAGGGTCACAAGAAAC⁃3′R5′⁃AGAGAGTGCTGCCTAATGTCC⁃3′Arg⁃1F5′⁃CAGAAGAATGGAAGAGTCAG⁃⁃3′R5′⁃CAGATATGCAGGGAGTCACC⁃3′TGF⁃βF5′⁃TGACGTCACTGGAGTTGTACGG⁃3′R5′⁃GGTTCATGTCATGGATGGTGC⁃3′Fizz⁃1F5′⁃ACTCGTTGACTGGACCACTG⁃3′R5′⁃AAGAAGCAGGGTAAATGGGCA⁃3′
1.2.3 细粒棘球蚴与RAW264.7细胞共培养 对照组:加1 ml DMEM培养基;实验组:原头蚴浓度1 000个/ml,取1 ml与细胞共培养。在37℃ 5% CO2培养箱内培养,分别在0、12、24、36、48、72 h(各设3个复孔),收集细胞,取上清离心备用。
1.2.4 荧光定量PCR检测PPAR-γ、PPAR-α、TNF-α、MCP-1、IL-1β、Arg-1、TGF-β、Fizz-1的表达 按照总RNA提取试剂盒提取RAW264.7细胞的RNA,用反转录试剂盒进行反转录得到cDNA。上机进行荧光定定量检测,体系20 μl,其中cDNA 2 μl,上游引物0.5 μl,下游引物0.5 μl,SYBR Green Ⅰ 10 μl,ddH2O 7 μl,共40个循环。
1.2.5 ELISA方法检测上清液中相关细胞因子的含量。
1.3 统计学方法 用SPSS17.0软件进行统计学分析,组间的显著性差异采用One-way ANOVA检验,组内采用两样本均数t检验。
2 结果
2.1 细粒棘球蚴与RAW264.7细胞共培养,RAW264.7巨噬细胞PPAR-γ表达逐渐升高 通过荧光定量PCR技术检测RAW264.7细胞PPAR-γ表达水平。结果显示:细粒棘球蚴与RAW264.7细胞共培养在12、24、36、48、72 h时,巨噬细胞PPAR-γ表达逐渐升高(P<0.05),见图1。
2.2 细粒棘球蚴与RAW264.7细胞共培养,RAW264.7巨噬细胞PPAR-α表达逐渐升高 通过荧光定量PCR技术检测RAW264.7细胞PPAR-α表达水平。结果显示:细粒棘球蚴与RAW264.7细胞共培养在12、24、36、48、72 h时,巨噬细胞PPAR-α表达逐渐升高(P<0.05),见图2。
2.3 细粒棘球蚴与RAW264.7细胞共培养,RAW264.7细胞M1型相关因子表达先升高后降低 通过荧光定量PCR检测细粒棘球蚴感染早期,RAW264.7细胞M1型相关细胞因子TNF-α、MCP-1、 IL-1β表达水平。结果显示:共培养后TNF-α、MCP-1在12、24、36、48 h时表达逐渐升高,48 h达最高,以后逐渐降低(P<0.05);IL-1β在36 h达最高,以后逐渐降低(P<0.05),见图3。
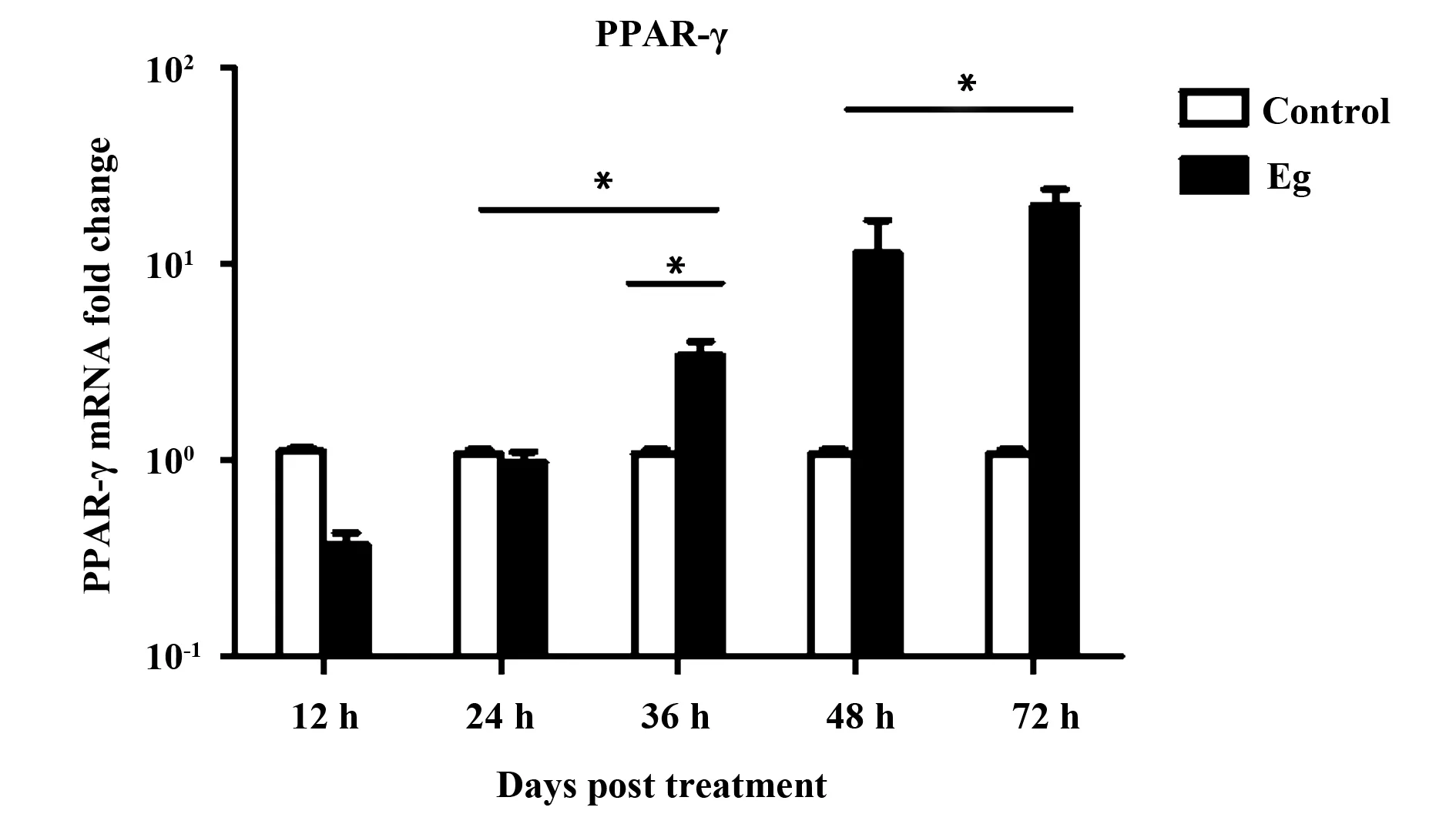
图1 qRT-PCR技术检测原头蚴与RAW264.7细胞共培养巨噬细胞PPAR-γ的含量Fig.1 PPAR-γ level in RAW264.7 cells treated with protoscolices were analyzed by qRT-PCRNote: The expression of PPAR-γ from RAW264.7cells treated with protoscolices were increased at different time points;Statistic analysis of the expression of PPAR-γ from RAW264.7 cells treated with protoscolices at different time points.*.P<0.05.
2.4 细粒棘球蚴与RAW264.7细胞共培养,RAW264.7细胞M2型相关因子mRNA水平和蛋白水平表达均逐渐升高 通过荧光定量PCR检测细粒棘球蚴感染早期,RAW264.7细胞M2型相关细胞因子Arg-1、TGF-β、Fizz-1表达水平,用ELISA方法检测Arg-1和MR的表达水平。结果显示:共培养后Arg-1、TGF-β、Fizz-1在12、24、36、48、72 h时表达逐渐升高,72 h达最高(P<0.05),Arg-1和MR的ELISA结果也相同,见图4。

图2 qRT-PCR技术检测原头蚴与RAW264.7细胞共培养巨噬细胞PPAR-α的含量Fig.2 PPAR-α level in RAW264.7 cells treated with protoscolices were analyzed by qRT-PCRNote: The expression of PPAR-α from RAW264.7cells treated with protoscolices were increased at different time points;Statistic analysis of the expression of PPAR-α from RAW264.7 cells treated with protoscolices at different time points.*.P<0.05.
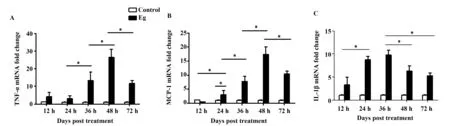
图3 qRT-PCR技术检测原头蚴与RAW264.7细胞共培养TNF-α、MCP-1、IL-1β的含量Fig.3 TNF-α,MCP-1,IL-1β levels in RAW264.7 cells detected with protoscolices were analyzed by qRT-PCR Note: A .The TNF-α levels in protoscolices and RAW264.7 cells co-cultured were detected by qRT-PCR;B.The MCP-1 levels in protoscolices and RAW264.7 cells co-cultured were detected by qRT-PCR;C.The IL-1β levels in protoscolices and RAW264.7 cells co-cultured were detected by qRT-PCR.*.P<0.05.

图4 qRT-PCR技术检测原头蚴与RAW264.7细胞共培养Arg-1、TGF-β、Fizz-1的含量,ELISA检测Arg-1和MR的蛋白量Fig.4 Arg-1,TGF-β and Fizz-1 levels in RAW264.7 cells treated with protoscolices were analyzed by qRT-PCR,Arg-1 and MR were detected by ELISA Note: A .Detected by qRT-PCR;B.The TGF-β levels in protoscolices and RAW264.7 cells co-cultured were detected by qRT-PCR;C.The Arg-1 levels in protoscolices and RAW264.7 cells co-cultured were detected by qRT-PCR;D.The Arg-1 levels in protoscolices and RAW264.7 cells co-cultured were detected by ELISA;E.The MR levels in protoscolices and RAW264.7 cells co-cultured were detected by ELISA ,*.P<0.05.
3 讨论
宿主抵抗包虫病感染的免疫应答是一个复杂的过程,不同的抗原进入机体先激活的细胞不同其对抗原免疫的方向和结果也不同[10]。巨噬细胞是一类具有异质性的免疫细胞,能吞噬杀伤病原体,清除损伤和衰老的细胞,是机体非特异性免疫的重要组成部分。成熟的巨噬细胞在各种因素诱导下可以产生不同的功能表型即为巨噬细胞极化[11]。有研究发现核转录因子对巨噬细胞极化起重要作用。PPARα/γ属于Ⅱ型核激素受体家族成员,在转录水平上对靶基因进行调控,由此来实现不同的生物学作用[12]。PPARα/γ在肿瘤中发挥作用可能与其抑制血管生成有关[13],在抑制动脉粥样硬化方面PPARα/γ增高主要通过抑制炎症反应调节细胞迁移和增生[14],在神经系统疾病中PPARα/γ表达增高可以增加抗炎因子的表达,从而延迟神经损害来发挥神经保护作用[15]。
本实验中细粒棘球蚴与RAW264.7细胞共培养后PPAR-γ和PPAR-α的表达量从第12 h开始到72 h都是逐渐升高,72 h表达最高; 巨噬细胞M1型相关因子TNF-α、MCP-1、IL-1β、的mRNA水平先升高后降低,而M2型巨噬细胞相关因子Arg-1、TGF-β、Fizz-1的mRNA水平逐渐升高,Arg-1和MR的蛋白水平也相同,与PPARα/γ的趋势相一致,有文献报道PPARα/γ与M2型巨噬细胞成熟相关[16]。我们猜测PPARα/γ的表达增高可能影响了巨噬细胞的极化,使其由促炎的M1型变为抗炎的M2型,表型发生了变化,功能也发生改变,从而使虫体产生免疫逃逸,导致原头蚴能够在体内长期存活。
综上所述,细粒棘球蚴与RAW264.7细胞共培养后PPAR-γ和PPAR-α的表达量逐渐增高。巨噬细胞M1型相关因子先增高后降低,M2型相关因子逐渐增高,巨噬细胞表型的改变可能与PPARα/γ表达增加相关,从而影响了巨噬细胞的功能,抑制宿主的免疫杀伤,引起了虫体的免疫逃逸。
[1] Tasdemir K,Akcali Y,Gunebakmaz O,etal.Surgical approach to the management of cardiovascular echinococcosis[J].J Cardiac Surg,2009,24(3):281-284.
[2] zer N,Aytemir K,Kuru G,etal.Hydatid cyst of the heart as a rare cause of embolization:Report of 5 cases and review of published reports-Journal of the American society of echocardiography[J].J Am Soc Echocardiogr,2001,14(4):299-302.
[3] Siracusano A,Delunardo F,Teggi A,etal.Host-parasite relationship in cystic echinococcosis:an evolving story[J].Clin Developmental Immunol,2012,2012(1740-2522):579-590.
[4] Vamecq J,Latruffe N.Medical significance of peroxisome proliferator-activated receptors[J].Lancet,1999,354(9173):141-148.
[5] 赵 洁,雷金艳.酒精性肝病的研究进展[J].北京中医药,2009,28(11):907-908.
[6] Clark RB,Bishopbailey D,Estradahernandez T,etal.The nuclear receptor PPARγ and immunoregulation:PPARγ mediates inhibition of helper T cell responses1[J].J Immunol,2000,164(3):1364-1371.
[7] Mills CD,Kincaid K,Alt JM,etal.M-1M-2 macrophages and the Th1Th2 paradigm[J].J Immunol,2000,164(12):6166-6173.
[8] Stein M,Keshav S,Harris N,etal.Interleukin 4 potently enhances murine macrophage mannose receptor activity:a marker of alternative immunologic macrophage activation[J].J Experimental Med,1992,176(1):287-292.
[9] Bouhlel MA,Derudas B,Rigamonti E,etal.PPARgamma activation primes human monocytes into alternative M2 macrophages with anti-inflammatory properties[J].Cell Metabolism,2007,6(2):137-143.
[10] 方海瑞,蒋红群,徐芳洁,等.原头蚴对体外培养小鼠脾细胞中Th细胞亚群的影响[J].中国免疫学杂志,2016,32(2):174-177.
[11] Jun Y,Shen B,Chu ESH,etal.Inhibitory role of peroxisome proliferator-activated receptor gamma in hepatocarcinogenesis in mice and in vitro ?[J].Hepatology,2010,51(6):2008-2019.
[12] Waldo SW,Li Y,Buono C,etal.Heterogeneity of human macrophages in culture and in atherosclerotic plaques[J].Am J Pathol,2008,172(4):1112-1126.
[13] 章 涛,余华荣,杨贵忠,等.罗格列酮对人乳腺癌——细胞的体外抗肿瘤作用[J].医学争鸣,2007,28(11):971-974.
[14] Wan Y,Evans RM.Rosiglitazone activation of PPARgamma suppresses fractalkine signaling[J].J Mol Endocrinol,2010,44(2):135-142.
[15] Lee CH,Park OK,Yoo KY,etal.The role of peroxisome proliferator-activated receptor γ,and effects of its agonist,rosiglitazone,on transient cerebral ischemic damage[J].J Neurological Sci,2011,300(1-2):120-129.
[16] Choi JM,Bothwell ALM.The nuclear receptor PPARs as important regulators of T-cell functions and autoimmune diseases[J].Molecules Cells,2012,33(3):217-222.
[收稿2016-07-15 修回2016-09-05]
(编辑 许四平)
Echinococcus granulosus stimulates high PPARα/γ expression and drives polarization of macrophages in vitro
CHENCong-Zhe,DONGDan,FANGHai-Rui,JIANGHong-Qun,HOUJun,YANGKun,GUOFeng,CHENXue-Ling.
DepartmentofImmunology,ShiheziUniversitySchoolofMedicine,Shihezi832000,China
Objective:To investigate the expression levels of PPARα/γ in RAW264.7 cells in the early stages of co-cultivation with Echinococcus granulosus in vitro.Methods: RAW264.7 cells were co-cultured with E.granulosus and collected at 12,24,36,48,72 h.The mRNA levels of PPAR-γ,PPAR-α,M1 macrophages-associated cytokines including TNF-α,MCP-1 and IL-1β,and M2 macrophages-associated cytokines including Arg-1,TGF-β and Fizz-1 were detected by qRT-PCR.The protein levels of Arg-1 and MR were analyzed by ELISA.Results: The expression levels of PPAR-γ, PPAR-α and the M2 macrophages-associated cytokines including Arg-1,TGF-β,Fizz-1 and MR were significantly increased,especially at 72 h (P<0.05).M1 macrophages-associated cytokines including TNF-α,MCP-1 and IL-1β were decreased at 72h although increased at first.Conclusion: During the early stages of co-cultivation with Echinococcus granulosus in vitro,the levels of PPAR-γ/α are up-regulated in RAW264.7 cells,which may drive macrophage polarization and play a role in the immune escape.
Echinococcus granulosus;Macrophage;PPAR-γ/α;Polarization
10.3969/j.issn.1000-484X.2017.01.003
①本文为国家自然科学基金(81360453,81260412)和兵团博士基金(2011BB018)。
陈聪哲(1989年-),女,在读硕士,主要从事地方感染性疾病的研究,E-mail:13150405937@163.com。
及指导教师:陈雪玲(1971年-),女,博士,教授,硕士生导师,主要从事感染免疫方面的研究,E-mail:xuelingch@hotmail.com。
R383.33
A
1000-484X(2017)01-0016-05