细菌性软腐菌对人参根系分泌物中糖类和氨基酸类的化学趋向性响应
张爱华+安宁波+雷锋杰+马文丽+匙坤+张连学

[摘要]采用毛细管法测定了人参细菌性软腐菌在4种趋化参数(浓度、时间、温度和pH)下对不同氨基酸和糖的趋向性响应。与对照组结果显示,赖氨酸趋化率为2.509 7(pH 8,质量浓度为0.025 mg· L-1、培养温度为25 ℃、培养时间为60 min),精氨酸趋化率为2.218 8(pH 6、质量浓度为0.25 mg· L-1、培养温度为25 ℃、培养时间为60 min),L-鼠李糖趋化率为3.091 2(pH 7、质量浓度为0.25 mg· L-1、培养温度为30 ℃、培养时间为60 min)和D-阿拉伯糖趋化率为3.026 3 (pH 6、质量浓度为0.25 mg· L-1、培养温度为30 ℃、培养时间为45 min)。糖类和氨基酸类对人参细菌性软腐菌有明显的趋化作用,且高浓度的氨基酸和糖对人参细菌性软腐菌的化学趋向性有抑制作用,但趋化作用随浓度的减弱反而增加。
[关键词]人参; 氨基酸; 糖; 细菌性软腐菌; 化学趋向性
[Abstract]The chemotaxis response ofErwinia carotovora to different sugars and amino acids in four kinds of chemotactic parameters (concentration, time, temperature and pH ) was determined by capillary method. The results showed that when pH was 8, concentration was 0.025 mg·L-1, culture temperature was 25 ℃ and the duration was 60 minutes, the optimal chemotaxis rate of lysine was 2.509,when pH was 6, concentration was 0.25 mg·L-1, culture temperature was 25 ℃ and the duration was 60 minutes, the optimal chemotaxis rate of arginine was 2.218 8,when pH was 7, concentration was 0.25 mg·L-1, culture temperature was 30 ℃ and the duration was 60 minutes, the optimal chemotaxis rate of L-rhamnose was 3.091 2, when pH was 6, concentration was 0.25 mg·L-1, culture temperature was 30 ℃ and the duration was 45 minutes, the optimal chemotaxis rate of D-arabinose was 3.026 3. Sugars and amino acids had obvious chemotaxis withE. carotovora,the high concentration of carbohydrate and amino acid exited an inhibitory effect on chemotaxis response ofE. carotovora, and the chemotaxis response decreased with the increase of concentration of carbohydrates and amino acids.
[Key words]Panax ginseng; amino acid; sugars;Erwinia carotovora; chemotaxis
doi:10.4268/cjcmm20162109
人參Panax ginseng C. A. Mey. 为五加科多年生宿根植物,是传统名贵中药材。人参病害是影响人参产量与质量的一个重要因素。人参细菌性软腐菌作为人参生长过程中的重要病害,长期危害着人参的根或茎基部,且防治困难[1-2]。人参根系分泌的某些次生代谢物质被视为根际微生物的基质,作为化感因子调节植物与细菌不同种间的互作关系,在植物与环境互相作用中具有一定现实意义[3]。根系分泌物中含有诸如糖、氨基酸等初生代谢物质,其中至少有 10种糖和 25种氨基酸已得到鉴定[4-5],并对根际微生物的选择性促进发挥着重要作用[6-7]。甄文超等[8]在研究草莓根系分泌物和腐解物中8种氨基酸的含量时发现,不同氨基酸对尖孢镰刀菌Fusarium oxysporum和立枯丝核菌Rhizoctonia solani表现抑制或促进作用。韩丽梅等[9]研究大豆连作土壤中有机物对大豆根腐病菌的影响时发现,土壤中糖类物质对半裸镰刀菌、粉红粘帚菌、尖孢镰刀菌的生长多表现低促高抑,而氨基酸和有机酸组分对3种病菌的生长多表现显著的促进作用。陈子英等[10]研究小麦根系分泌物中,含有14种氨基酸。杨靖春等[11]首次从人参根系分泌物中发现人参十多种氨基酸和可溶性糖的存在,从人参根系分泌物对人参根际霉菌作用试验中,发现当在10×10-6或10 mL时,分泌物对人参根际微生物中的各类霉菌,均表现出明显地刺激作用,但这种作用并非依着分泌物浓度的增加而表现为等量的增加。
由人参根系分泌物产生的糖和氨基酸是否能引起人参病原微生物的化学趋向性响应与之的相关因素以及作用机制等,尤其是在细菌方面目前未见相关报道。前期实验室从人参根系分泌物中测得含有人参皂苷,天冬氨酸、赖氨酸、甘氨酸、异亮氨酸等15种氨基酸,鼠李糖、木糖、甘露糖、岩澡糖等7种糖,并以人参皂苷为化学驱动因子得出其对人参绣腐菌、人参黑霉菌等真菌有明显的化学趋向性[12],细菌方面以及糖和氨基酸等驱动因子没有进一步进行研究。作者前期以外源性糖类和氨基酸类选取赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖4种物质,采用改进的毛细管法测定了人参细菌性软腐菌对其化学趋向性响应,以期为人参细菌性病害的深入研究以及药用植物连作现象提供理论基础。后续对木糖、甘露糖等糖类以及异亮氨酸、苯丙氨酸、甘氨酸和半胱氨酸氨酸等氨基酸类进行研究。
1 材料
1.1 供试菌种 人参细菌性软腐菌Erwinia carotovora subsp.carotovora (Jones) Bergey et al.取自吉林省人参工程技术研究中心,经吉林农业大学高洁教授鉴定。
1.2 供试药品 赖氨酸(BR,纯度99%);精氨酸(BR,纯度99%);L-鼠李糖(High,纯度98%);D-阿拉伯糖(BR,纯度98%);氯化钠(AR,上海源叶生物有限公司北京化工厂);牛肉膏(BR);蛋白胨(BR,北京奥博星生物技术有限责任公司);琼脂粉(H8145,上海稼丰园艺用品有限公司)。
1.3 培养基:牛肉膏-蛋白胨培养基 液体培养基(g·L-1):牛肉膏 5.0,蛋白胨 10.0,NaCl 5.0,pH 7.2~7.4;固体培养基(g·L-1):牛肉膏 5.0,蛋白胨 10.0,NaCl 5.0,琼脂15~20,pH 7.2~7.4。
2 方法
2.1 菌液的制备 将-70 ℃保存的菌种接种到牛肉膏-蛋白胨固体培养基上,于25 ℃条件下培养24 h。挑取单菌落于适量稀释液(0.90% NaCl,pH 7.2)中,充分振荡混匀后制成一定浓度的菌液(1×108 CFU·mL-1),通过稀释得到1×106 CFU·mL-1的菌液,备用。
2.2 不同氨基酸和糖溶液的制备 对照组为无菌水;配制赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖溶液的质量浓度分别为0.025,0.25,2.5,25 mg·L-1,用0.22 μm微孔滤膜过滤除菌,备用。
2.3 化学趋向性反应试验 采用改进的毛细管法进行化学趋向性反应试验[13],玻璃毛细管(内径为0.5 mm)一端吸入待测趋化液,另一端用热熔胶封闭。将毛细管插入到含 500 μL 菌液的1 mL 注射器中,25 ℃下水平孵育 60 min。用无菌水冲毛细管外壁再用滤纸擦拭以去除附着的菌液,折断毛细管后将内含物转入 EP 管中,加入 50 μL无菌水稀释3倍,再将溶液吸出均匀涂抹在固体平板上,反复操作5次。平板于25 ℃下培养24 h,统计5次重复试验单菌落的平均个数。以毛细管中的细菌菌数来衡量人参细菌性软腐菌化学趋向性响应的大小。
2.4 不同浓度氨基酸和糖对人参细菌性软腐菌化学趋向性的影响 将配制好的不同浓度的氨基酸和糖溶液按2.3的方法进行趋化试验。
2.5 时间对人参细菌性软腐菌化学趋向性的影响 在不同时间 (0,30,45,60,75 min) 下按2.3的方法进行趋化试验(其中,赖氨酸为0.025 mg·L-1,精氨酸、L-鼠李糖和D-阿拉伯糖為0.25 mg·L-1)。
2.6 温度对人参细菌性软腐菌化学趋向性的影响 按2.3的方法测定不同温度(15,20,25,30 ℃)下细菌对赖氨酸(质量浓度0.025 mg·L-1、培养时间 60 min)、精氨酸(质量浓度为0.25 mg·L-1、培养时间 60 min)、L-鼠李糖(质量浓度为0.25 mg·L-1、培养时间 60 min)、D-阿拉伯糖(质量浓度0.25 mg·L-1、培养时间 45 min)。
2.7 pH对人参细菌性软腐菌化学趋向性的影响 按2.3的方法测定在不同pH(5,6,7,8)下按2.3的方法进行趋化实验,其中赖氨酸(质量浓度0.025 mg·L-1、培养时间 60 min、培养温度 25 ℃);精氨酸(质量浓度 0.25 mg· L-1、培养时间 45 min、培养温度 25 ℃);L-鼠李糖(质量浓度 0.25 mg·L-1、培养时间 60 min、培养温度 30 ℃);D-阿拉伯糖(质量浓度为0.25 mg·L-1、培养时间 45 min、培养温度 30 ℃)。
2.8 人参细菌性软腐菌在最优趋化参数下对4种成分化学趋向性的响应 综合筛选出的上述4种条件下趋化现象最为明显的参数,按2.3的方法进行趋化试验。
2.9 数据分析 趋化作用强度以趋化率(Rche)表示,R=实验组的菌落数/对照组菌落数,趋化率R>2表示有正趋化作用。数据采用Excel(2016版)软件进行处理,利用SPSS 19.0中的单因素方差分析(One-Way ANOVA) 结合LSD法对统计结果进行显著性方差分析。不同英文字母表示不同处理间有显著性差异(P<0.05)。
3 结果与分析
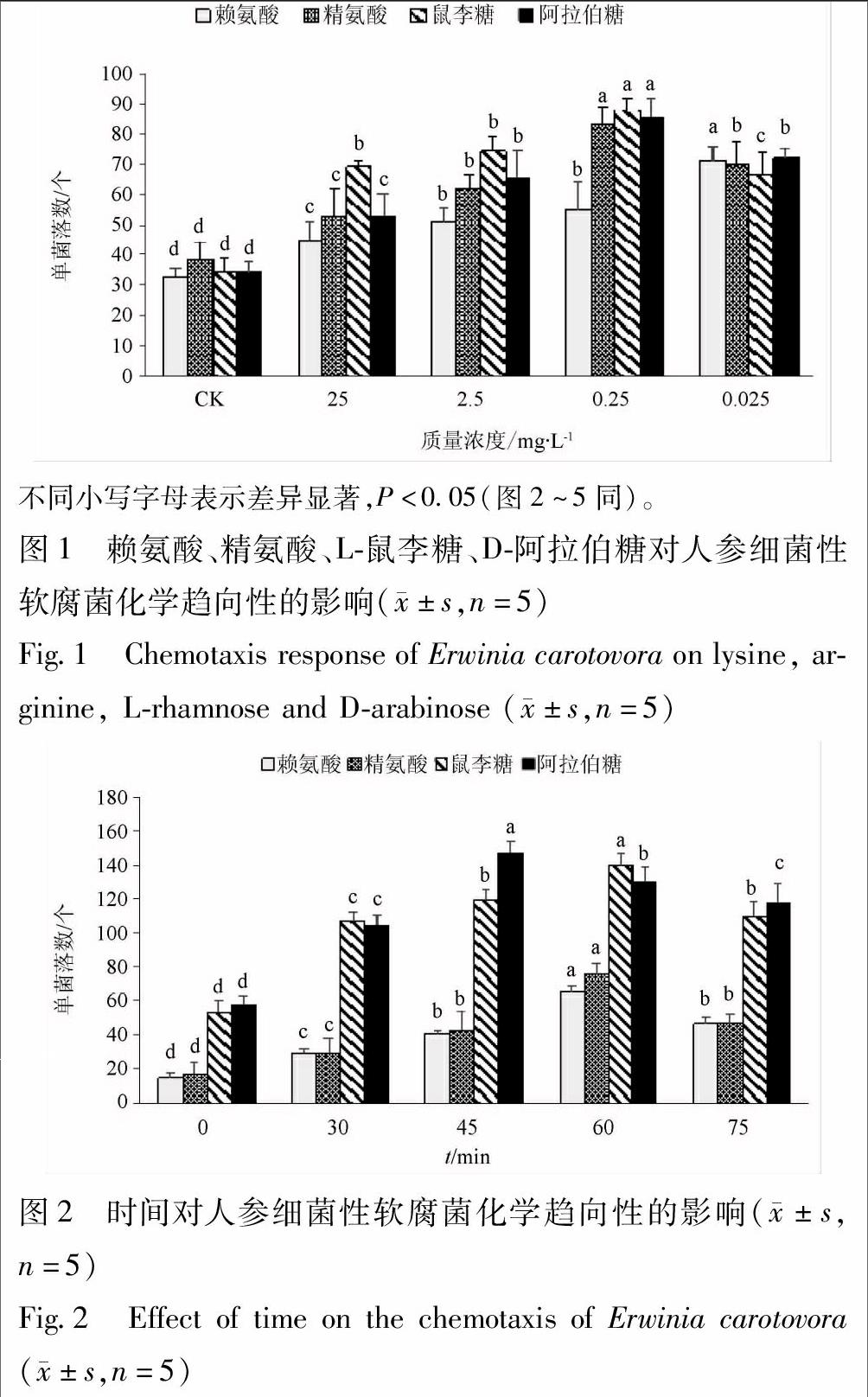
3.1 不同浓度的糖和氨基酸对人参细菌性软腐菌化学趋向性的影响 人参细菌性软腐菌分别对赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖表现出化学趋向性响应,实验组菌落数高于对照组(图1)。其中,人参细菌性软腐菌对赖氨酸表现出的化学趋向性随着浓度的逐渐减弱而升高,在质量浓度0.025 mg·L-1时的化学趋向性最强且显著高于同组试验(P<0.05),趋化率为2.131 3;人参细菌性软腐菌对精氨酸、L-鼠李糖、D-阿拉伯糖表现出的化学趋向性都随浓度的逐渐减小而呈现出由弱到强的变化趋势,都在质量浓度0.25 mg·L-1时的化学趋向性最强且显著高于同组试验(P<0.05),趋化率分别为2.143 5,2.579 2,2.495 1。
3.2 时间对人参细菌性软腐菌化学趋向性的影响 人参细菌性软腐菌对不同培养时间下的赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖均表现出化学趋向性响应,都明显高于0 min试验组,且都随着培养时间的增加出现由强到弱的变化(图2)。其中,人参细菌性软腐菌对赖氨酸、精氨酸、L-鼠李糖在培养到60 min时达到最大趋化值,对D-阿拉伯糖在培养到45 min时出现最大趋化值,且都显著高于同组试验(P<0.05)。在相同的培养时间里,人参细菌性软腐菌对2种糖的化学趋向性明显要强于2种氨基酸。
3.3 温度对人参细菌性软腐菌化学趋向性的影响 人参细菌性软腐菌在4种试验温度下分别对赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖表现出化学趋向性响应(图3)。其中,在25 ℃培养时,人参细菌性软腐菌对赖氨酸、精氨酸的化学趋向性最强,显著高于同组试验(P<0.05),且都随着温度的升高而减弱;然而人参细菌性软腐菌在30 ℃培养时,L-鼠李糖、D-阿拉伯糖的化学趋向性为最强,显著高于同组试验(P<0.05),随着温度的升高而加强。在相同的培养温度下,人参细菌性软腐菌对2种糖的化学趋向性要强于2种氨基酸。
3.4 pH对人参细菌性软腐菌化学趋向性的影响 人参细菌性软腐菌对不同pH的赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖均表现出化学趋向性响应(图4)。其中,赖氨酸随着pH的逐级递增呈现逐渐增加的变化趋势,pH 8时趋化性最强,显著高于同组试验(P<0.05);精氨酸、L-鼠李糖、D-阿拉伯糖随着pH的逐级递增呈现由强到弱的变化趋势,其pH分别6,7,6时化学趋向性最强,显著高于同组试验(P<0.05)。从整体来看,赖氨酸试验组的化学趋向性在碱性(pH 8)最强,L-鼠李糖试验组的化学趋向性在中性(pH 7)最强,精氨酸和D-阿拉伯糖的酸性试验组(pH 5,pH 6)的化学趋向性明显高于中性和碱性(pH 7,pH 8),且在中性与偏酸性条件下糖类趋化性明显高于氨基酸类。
3.5 人参细菌性软腐菌在最优趋化参数下对4种物质成分化学趋向性的响应 人参细菌性软腐菌在最优趋化参数下对赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖均表现出化学趋向性,实验组菌落数明显强于对照试验组(图5)。其中,人参细菌性软腐菌对pH 8、质量浓度0.025 mg·L-1的赖氨酸在25 ℃下培养60 min时达到最大趋化值,趋化率为2.509 7;
对pH 6、质量浓度 0.25 mg·L-1的精氨酸在25 ℃下培养60 min时达到最大趋化值,趋化率为2.218 8,对pH 7、质量浓度为0.25 mg·L-1的L-鼠李糖在30 ℃下培养60 min时达到最大趋化值,趋化率为3.091 2;对pH 6、质量浓度 0.25 mg·L-1的L-鼠李糖在30 ℃下培养45 min时达到最大趋化值,趋化率为3.026 3。且在最优参数下4种物质趋化率R>2,均表示有正趋化作用。
4 结论与讨论
化学趋向性(chemotaxis)作为微生物适应环境变化而生存的一种基本属性所引起的定向移动,它能够帮助微生物感知周围环境中化学物质的浓度梯度变化,寻找食源和躲避毒性环境,具有生存上的竞争优势。更为重要的是,它是许多病原菌感受寄主植物信号并成功入侵寄主的重要方式[14-15]。植物根分泌物如糖类、氨基酸类、维生素类、有机酸类等都是微生物生长繁殖所需要的C,N源及生长素,为根际微生物的繁殖提供了所需的能源,影响根际环境微生物种类和数量的分布。自然条件下,次生代谢物质的浓度效应对于阐明化学趋向性具有重要意义,许多报道已证实低浓度下的植物次生代谢产物促使其病原菌显示出较强的化学趋向性响应。有研究指出,桉树根系分泌的低浓度的次生代谢物质对野生型产酸克氏菌Klebsilla oxytoca具有强烈的吸引作用,极大地促进了野生菌株的正趋向性[16]。景贵成等[17]以原油为碳源的Pseudomonassp.菌化学趋向性研究中发现,在有效的营养物浓度梯度范围内,化学趋向性运移速度与细菌活动能力有关,受温度的影响很大。胡小加等[18]发现巨大芽孢杆菌 A6 对油菜根系分泌物有趋化性,油菜根系分泌物所测定出的 10种糖类中,A6 对 8种糖类有趋化性。匙坤等[19]研究发现人参根系分泌物中的人参皂苷在低浓度时对人参根腐菌和锈腐菌有明显的化学趋向性。这说明人参根系分泌低浓度的次生代谢物质有可能促进了趋化性病原细菌向人参根际的游动聚集和定植,最终完成侵染。本研究结果表明,人参细菌性软腐菌在不同时间、温度及pH条件下对实验所选赖氨酸、精氨酸、L-鼠李糖、D-阿拉伯糖4种物质都表现出较强的化学趋向性,且高浓度的氨基酸和糖对人参细菌性软腐菌的化学趋向性有抑制作用,但随浓度的减弱反而增加。Parkinson等[20]和Bourret等[21]发现细菌膜表面存在各种专一性的化学受体,它使得细菌能检测到细胞外环境中化学物质的浓度变化,并通过细胞内的传递系统将感受到的化学信息转变成细胞内的信号,进而由这种信号改变细菌鞭毛运动的方向,由此决定了细菌的化学趋向性运动行为。近10年来国内外学者对化学趋向性的机制进行了大量的研究,并详细阐明了有关的细节[22]。但对于人参细菌性软腐菌的化学趋向性具体机制还有待进一步研究。
[参考文献]
[1]傅俊范. 藥用植物病理学[M]. 北京: 中国农业出版社, 2007.
[2]Lee S G.Fusariumspecies associated with ginseng (Panax ginseng) and their role in the root-rot of ginseng plant [J]. Res Plant Dis, 2004, 10(2): 248.
[3]张爱华,雷锋杰,许永华,等.外源人参皂苷对人参种子萌发和幼根抗氧化酶活性的影响[J].生态学报,2009,29(9):4934.
[4]冯洁,陈其瑛.棉花幼苗根系分泌物与枯萎病关系的研究[J].棉花学报,1991(3):89.
[5]刘素萍,王汝贤,张荣,等.根系分泌物中糖和氨基酸对棉花枯萎菌的影响[J]. 西北农业大学学报,1998(6):30.
[6]陈宏宇,李晓鸣,王敬国.抗病性不同大豆品种根面及根际微生物区系的变化.Ⅱ.连作大豆(重茬) 根面及根际微生物区系的变化[J].植物营养与肥料学报,2006,12(1):104.
[7]Park S, Takano Y, Matsuura H, et al. Antifungal compounds from the root and root exudate ofZea mays[J].Biosci Biotech Biochem,2004,68(6): 1366.
[8]甄文超,王晓燕,曹克强,等.草莓根系分泌物和腐解物中氨基酸的检测及其化感作用研究[J].河北农业大学学报,2004,27(2):76.
[9]鞠会艳,韩丽梅,王树起,等.连作大豆根分泌物对根腐病病原菌的化感作用[J].应用生态学报,2002,13(6):723.
[10]陈子英, 吴观以,王涌清,等.植物根际微生物与根部分泌物的研究——Ⅰ.小麦、玉米、绿豆等作物的根际微生物数量与根部分泌物中的可溶性糖和氨基酸[J].微生物学报,1964,10(2):212.
[11]杨靖春, 李治平, 酒井斐子. 人参根系分泌物及其对人参根际微生物作用的研究[J]. 东北师大学报: 自然科学版, 1982, 12(1): 71.
[12]匙坤,雷锋杰,张爱华,等.人参灰霉菌和人参黑斑菌对人参总皂苷的化学趋向性响应研究[J].中国中药杂志,2015,40(19):3742.
[13]Toole R O,Lundberg S,Fredriksson S A,et al.The chemotactic response ofVibrio anguillarum to fish intestinal mucus is mediated by a combination of multiple mucus components[J].J Bacteriol, 1999, 181(14): 4308.
[14]李燕,牟伯中.细菌化学趋向性研究进展[J].应用与环境生物学报,2006(1):135.
[15]华辰雷,郑小波,王源超.大豆疫霉G蛋白α亚基调控游动孢子对大豆异黄酮的趋化性[C].广州:中国植物病理学会2008年学术年会, 2008:1.
[16]于晓宇,江绍锋,蓝运华,等.对菌根分泌物强趋性产酸克氏菌突变体的筛选[J].广西师范大学学报:自然科学版,2014,32(2):130.
[17]景贵成,郭尚平,俞理.一株以原油为碳源的Pseudomonassp.菌化学趋向性研究[J].中国科学院研究生院学报,2005,22(2):187.
[18]胡小加,谢立华,余常兵,等.巨大芽孢杆菌 A6 对油菜根系分泌物所含有机酸和糖类的趋化性[J].中国油料作物学报,2011,33(4) : 416.
[19]匙坤,雷锋杰,张爱华,等.根腐菌和锈腐菌对人参总皂苷的化学趋向性响应研究[J].中草药,2016(5):821.
[20]Parkinson J S. Protein phosphorylation in bacterial chemotaxis[J].Cell, 1988,53(1): 1.
[21]Bourret R B, Hess J F, Borkovich K A,et al. Protein phosphorylation in chemotaxis and two-component regulatory systems of bacteria[J].J Biol Chem, 1989,264(13): 7085.
[22]Zhang W W, Zhang Z. The development of molecular mechanism of bacterial chemotaxis[J].Microbiology, 1993,20(3):175.
[責任编辑 吕冬梅]