补骨脂乙醇提取物小鼠灌胃急性及亚急性毒性试验研究
阿卜杜米吉提·阿卜力孜+阿布都吉力力·阿布都艾尼+艾西木江·热甫卡提+尤力都孜·买买提+李治建+斯拉甫·艾白

[摘要] 目的 研究补骨脂乙醇提取物(EEPF)的急性毒性特点。 方法 急性毒性分对照组和EEPF组[12.0 g/(kg·d)],灌胃给药,亚急性毒性分对照组和EEPF 0.65、1.30 g/kg组,灌胃给药14 d,进行一般观察,检测体重、脏器重量及系数、血液学及血液生化学,并进行肝脏、肾脏组织病理学检查。 结果 急性毒性小鼠死亡14只,可见肝脏中央静脉扩张充血,部分肾小管扩张;亚急性毒性给药14 d未见明显反应,EEPF低剂量组雄性脾脏重量及系数明显降低、雌性胸腺重量及系数明显升高(P < 0.05),雌性高剂量组体重明显升高(P < 0.05)、肾脏系数显著降低(P < 0.01);血液学:EEPF组雄性中性粒细胞计数(NEUT)比例(%)、单核细胞(MONO)比例(%)明显降低(P < 0.05),红细胞(RBC)、血红蛋白(HGB)、血细胞比容(HCT)(%)、淋巴细胞(LYMPH)(%)明显升高(P < 0.05),雌性RBC明显升高(P < 0.05),血小板计数(PLT)和血小板压积(PCT)显著升高(P < 0.01);血液生化学:EEPF雄性低剂量组A/G显著升高(P < 0.01),尿素氮(BUN)明显升高(P < 0.05),高剂量组丙氨酸氨基转移酶(ALT)和三酰甘油(TG)显著降低(P < 0.01),雌性低、高剂量组总胆红素(TBIL)明显降低(P < 0.05),TG显著降低(P < 0.01),总胆汁酸(TBA)和ALT明显升高(P < 0.05),高剂量球蛋白(GLOB)明显降低(P < 0.05);EEPF组出现肝细胞坏死、肾小球萎缩。 结论 EEPF最大给药量12.0 g/kg可致部分小鼠70%死亡;亚急性毒性EEPF 0.65、1.30 g/kg对小鼠血液学、血液生化学有一定影响,肝脏、肾脏可见毒性病变。
[关键词] 补骨脂乙醇提取物;小鼠;急性;亚急性;毒性
[中图分类号] R285.5 [文献标识码] A [文章编号] 1674-4721(2016)11(a)-0020-05
补骨脂为豆科植物补骨脂Psoralea corylifolia L.的干燥成熟果实,是中医、维吾尔医常用药材[1],具有温肾助阳、纳气平喘、温脾止泻等作用,用于肾阳不足、阳痿遗精等,外用治白癜风、斑秃[2-3]。《卫生部药品标准——维吾尔药分册》收载的含补骨脂的白癜风治疗制剂有9种[4];《中国药典》(2015年版)中收载的含补骨脂的中成药就有40种[2],临床应用更广泛。有报道补骨脂及其复方具有肝毒性[5-11],其安全性值得关注。如不能阐明其毒性的特点,将会限制补骨脂的推广使用。本研究对补骨脂乙醇提取物(ethanol extract of Psoraleae Fructus,EEPF)小鼠灌胃急性及亚急性毒性进行研究,探讨其毒性作用及靶器官,为其重复给药毒性研究提供相关的信息,以及临床应用急性中毒解毒提供实验依据。
1 材料与方法
1.1 药品与试剂
1.1.1 药品
EEPF,批号:20160310,按高效液相色谱法测定[2],含补骨脂素5.22 mg/g、异补骨脂素3.78 mg/g和补骨脂酚231.15 mg/g。药材购自新疆齐康哈博维药有限责任公司(批号:20151027),由新疆维吾尔医药研究所希尔艾力主任药师鉴定为正品。提取方法:取药材10 kg,10倍量75%乙醇加热回流提取1 h,共3次,合并提取液浓缩干燥,出膏率为9.51%。
1.1.2 试剂
丙氨酸氨基转移酶(ALT)(批号:140215003);天门冬氨酸氨基转移酶(AST)(批号:140115002);碱性磷酸酶(ALP)(批号:140314022);尿素氮(BUN)(批号:141315001);肌酐(Cr)(批号:141315016);总蛋白(TP)(批号:140815002);白蛋白(ALB)(批号:140915013);总胆固醇(TC)(批号:141615013);血糖(GLU)(批号:141515012);总胆红素(TBIL)(批号:140615012);磷酸肌酸激酶(CK)(批号:142515012);三酰甘油(TG)(批号:141715014);谷氨酰转肽酶(GGT)(批号:141715032),均由深圳邁瑞生物医疗电子股份有限公司提供。血液学试剂,SYSMEX公司,批号:A2007。
1.2 动物
昆明小鼠,体重(20±2)g,购自新疆实验动物研究中心,SPF级,许可证号:SCXK(新)2011-0001。饲养于新疆维吾尔医药研究所SPF级动物房,自由饮水、摄食,室温20~26℃,湿度40%~70%,光照/黑暗12/12 h。
1.3 方法
1.3.1 EEPF急性毒性试验
1.3.1.1 分组及剂量 设对照组(0.5%CMC-Na)、EEPF [12.0 g/(kg·d)]组,每组20只,雌、雄各半。按补骨脂药材每天临床用量10 g[2]、出膏率为9.51%计算,相当于日服用提取物0.951 g,EEPF 12.0 g/(kg·d)相当于临床人(60 kg计算)每公斤体重用药量的约750倍。
1.3.1.2 给药方法 以EEPF最大配制浓度20%,每次灌胃给药0.3 mL/10 g(每次6.0 g/kg),2次/d,间隔4~5 h给药第2次,合计12.0 g/(kg·d)。进行常规指标观察。
1.3.2 EEPF亚急性毒性试验
1.3.2.1 分组及剂量 小鼠随机分组,每组20只,雌、雄各半,设对照组(Ⅰ组),EEPF 0.65 g/kg(Ⅱ组)、1.30 g/kg组(Ⅲ组),分别为临床剂量的40、80倍。
1.3.2.2 给药方法 以EEPF配制浓度3.4%(低剂量)、6.8%(高剂量),灌胃给药0.2 mL/10 g,1次/d,共14 d。
1.4 观察指标
给药前(D0)和给药第1、4、7、11、14天称取体重;末次给药后禁食过夜毛细管眼眶采血加入抗凝剂检测红细胞(RBC)、白细胞计数(WBC)、血小板(PLT)、血红蛋白(HGB)、血细胞比容(HCT)、平均红细胞体积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、网织红细胞(Ret)。另外眼眶采血1.5 mL不加抗凝剂测定血液生化学指标。取肝脏、肾脏、胸腺、脾脏称重计算脏器系数(脏器重量/体重×100%),肝脏、肾脏于15%甲醛溶液固定,HE染色,观察组织形态变化。
1.5 统计学方法
采用PEMS统计软件进行统计,组间比较时采用单因素方差分析,方差齐时用t检验,方差不齐时用秩和检验。结果以均数±标准差(x±s)表示,以P < 0.05为差异有统计学意义。
2 结果
2.1 EEPF急性毒性试验
第1次给药后小鼠出现活动减少、呼吸急促、倦怠、竖毛等症状,无死亡;第2次给药后1 h内死亡14只,其中雄性5只、雌性9只,解剖可见肝脏充血,剩余动物24 h后恢复正常,观察14 d未见明显症状。由图1~2可见,组织病理学检查EEPF组肝脏中央静脉扩张充血,部分肾小管扩张。
2.2 EEPF亚急性毒性试验
2.2.1 一般观察
与Ⅰ组比较,亚急性毒性试验EEPF组给药14 d未见明显反应,动物无死亡。
2.2.2 体重、脏器重量级系数
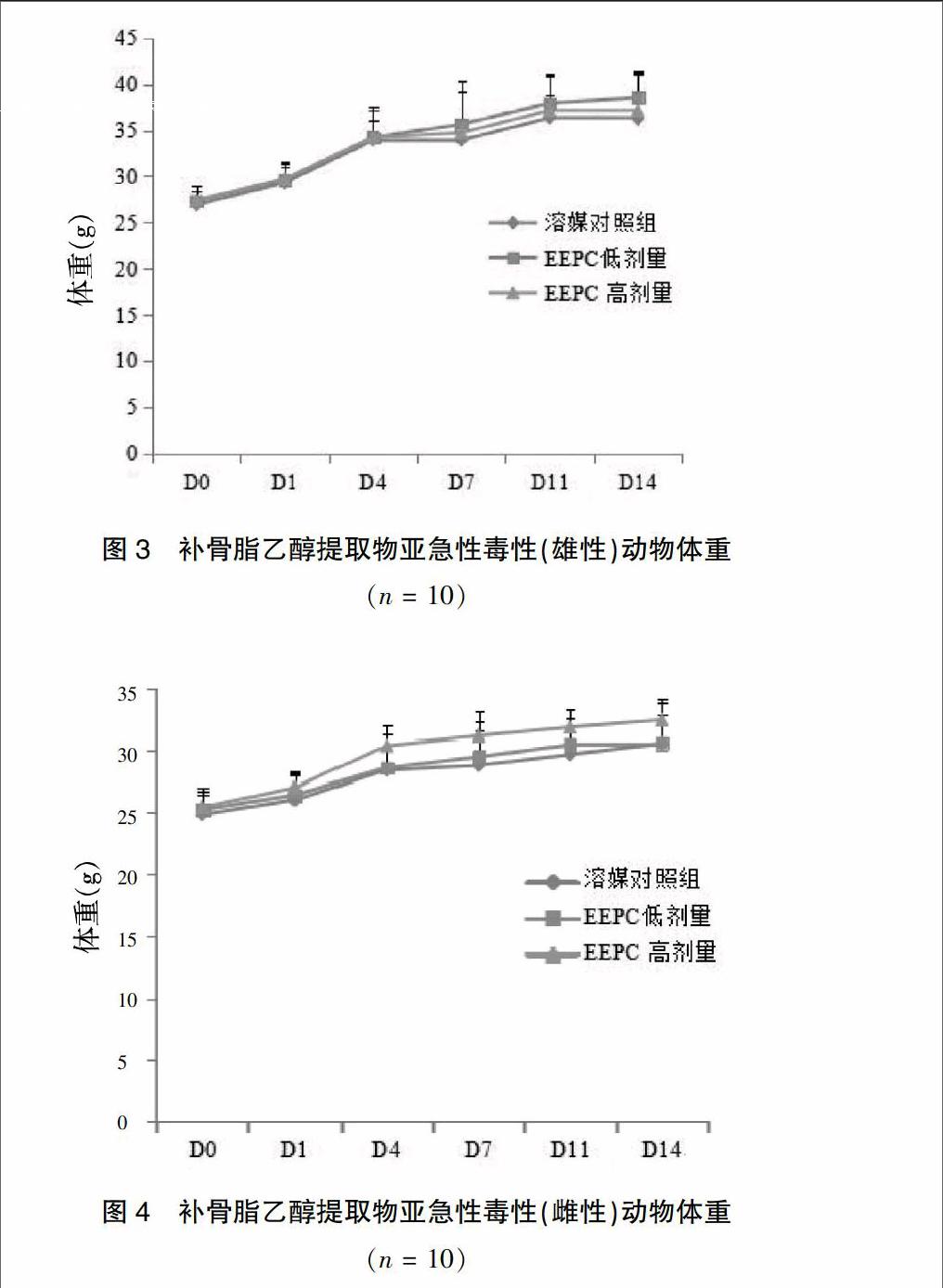
与Ⅰ组比较,Ⅲ组雌性给药第4~14天体重升高,雄性未见明显改变(图3~4);雄性低剂量组脾脏重量及系数明显降低(P < 0.05),雌性低剂量组胸腺重量及系数明显升高(P < 0.05),雌性高剂量组肾脏系数显著降低(P < 0.01)。
(n = 10)
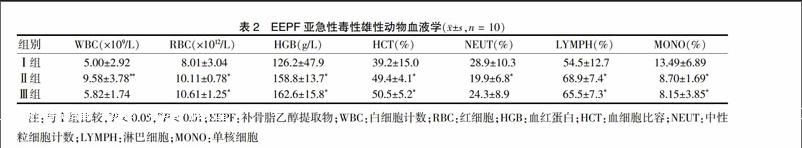
2.2.3 血液学
与Ⅰ组比较,EEPF组雄性RBC、HGB、HCT、LYMPH明显升高(P < 0.05),MONO明显降低(P < 0.05),Ⅱ组NEUT明显降低(P < 0.05),WBC显著升高(P < 0.01);雌性动物Ⅲ组PLT、PCT显著升高(P < 0.01),RBC明显升高(P < 0.05),其余指标与Ⅰ组比较未见明显改变,见表2~3。
2.2.4 血液生化学
与Ⅰ组比较,雄性动物Ⅲ组ALT、TG显著降低(P < 0.01),Ⅱ组A/G显著升高(P < 0.01),BUN明显升高(P < 0.05);雌性动物EEPF组TBIL明显降低(P < 0.05),TG显著降低(P < 0.01),Ⅲ组GLOB明显降低(P < 0.05),Ⅱ组ALT、TBA明显升高(P < 0.05),其余指标与Ⅰ组比较未见明显改变,见表4~5。
2.2.5 组织病理学检查
Ⅰ组肝肾组织未见明显改变。EEPF组可肝细胞坏死、肾小球萎缩。见图5~6。
3 讨论
急性毒性EEPF可致70%动物死亡,且雌性死亡多于雄性,死亡动物肝脏中央静脉扩张充血,部分肾小管扩张。亚急性毒性试验雌性高剂量组体重明显升高,雄性体重未见明显改变,EEPF组脾脏、胸腺重量及系数与对照组比较虽有统计学差异,但均为低剂量改变,无明显剂量效应关系,考虑非药物引起。血液生化学雄性ALT的降低、雌性TBIL的降低虽有统计学差异,无毒理学意义,雌雄小鼠TG均明显降低,雌性GLOB有一定降低,判断与影响肝脏脂质代谢相关,组织病理学检查可见EEPF组肝细胞坏死、肾小球萎缩,且雌性肾脏系数有一定降低,雌性ALT、TBA升高,临床报道其肝损伤特点多为女性ALT、TBA升高,与临床表现具有相似性[6,11],判断TG、GLOB的降低和LYMPH的升高与影响肝脏功能相关,考虑EEPF对雌性肝、肾有一定影响。
另外,EEPF可引起小鼠RBC、HGB、HCT、PCT升高,对小鼠血液学有一定影响。有文献报道补骨脂素具有提高小鼠造血功能的作用[12-13]。《中国药典》中含补骨脂的此类复方有“补肾养血丸”“再造生血片”等均作用于造血系统[14]。因此,判断EEPF对小鼠血液学的影响可能与其功能主治相关。
补骨脂要含香豆素、黄酮等化合物[15-18]。临床应用[5-6]和毒理学研究[7-9]发现补骨脂及复方对肝脏有一定的毒性作用[19-21]。韓国曾报道了与食用补骨脂有关的急性肝炎病例[5],部分含有补骨脂的中成药亦偶见肝毒性报道[10]。2009年香港报道3例肝损害病例,患者均使用补骨脂方剂[11]。本研究可见EEPF可致肝细胞坏死、肾小球萎缩,其毒性特点、毒性成分及机制有待进一步研究。
[参考文献]
[1] 阿不都热依木·卡地尔.中华本草维吾尔药卷[M].上海:上海科学技术出版社,2005:191-192.
[2] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2015:187-188.
[3] 张丹丹.胸腺肽联合复方补骨脂酊治疗白癜风的临床疗效观察[J].中国社区医师,2016,32(1):117-119.
[4] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准——维吾尔药分册[S].乌鲁木齐:新疆科技卫生出版社,1999:116-205.
[5] 张抗怀,王娜,蔡艳.驱白巴布期片致严重肝损伤[J].药物不良反应杂志,2013,15(4):235.
[6] Nam SW,Baek JT,Lee DS,et al. A case of acute cholestatic hepatitis associated with the seeds of Psoralea corylifolia(Boh-Gol-Zhee)[J]. Clin Toxicol,2005,43(6):589-591.
[7] 周昆,代志,柳占彪,等.补骨脂水提物引起的大鼠肝损害[J].天津中医药大学学报,2013,32(4):221-224.
[8] 江芳,周昕睿,王旗,等.补骨脂酚及其与补骨脂素合用对HK-2细胞的毒性及其机制[J].中国药理学与毒理学杂志,2010,24(1):50-58.
[9] Wang J,Jiang Z,Ji J,et al. Evaluation of hepatotoxicity and cholestasis in rats treated with EtOH extract of Fructus Psoraleae [J]. J Ethnopharmacol,2012,144(1):73-81.
[10] 周昆,代志,柳占彪,等.壮骨关节丸中肝毒性药材的筛选研究[J].中国药物警戒,2009,6(11):641-648.
[11] Cheung WI,Tse ML,Ngan T,et al. Liver injury associated with the use of Fructus Psoraleae(Bol-gol-zhee or Bu-gu-zhi)and its related proprietary medicine [J]. Clin Toxicol,2009,47(7):683-685.
[12] CFDA.药物单次给药毒性研究技术指导原则[S].2014-5-13. http://www.cde.org.cn/zdyz.do?method=largePage&id=189
[13] 孙玉雯,程艳玲,邹阳,等.大黄素补骨脂素对辐射损伤小鼠造血功能的影响[J].时珍国医国药,2014,25(10):2342-2344.
[14] 周建国,马双姣,黄玉龙,等.种子类药材补骨脂及其混伪品的ITS2条形码序列鉴定[J].世界中医药,2016,11(5):786-790.
[15] 刘国良,于英君,姚远,等.补骨脂二氢黄酮甲醚对A375细胞黑素合成及ER/MAPK信号通路的影响[J].中国医药导报,2015,12(36):4-8,20.
[16] 杨彤彤,李静,秦民坚,等.补骨脂中两个新的黄酮类化合物[J].药学学报,2009,44(12):1387-1390.
[17] 杨再波,钟才宁,邓维先,等.頂空气相色谱-质谱法分析补骨脂挥发油化学成分[J].分析实验室,2008,27(4):87-90.
[18] 陈业高,于丽丽.补骨脂化学成分的研究[J].云南师范大学学报,2005,25(4):52-54.
[19] 颜冬梅,高秀梅.补骨脂化学成分研究进展[J].辽宁中医药大学学报,2012,14(9):96-99.
[20] 张秋玲,杨佳,卢奕霞.白蚀丸致肝损害[J].药物不良反应杂志,2010,12(4):297-298.
[21] 李艳丰,程国印.临床药师参与中药补骨脂致肝损害的药学监护[J].中国医院用药评价与分析,2016,16(4):571-573.
(收稿日期:2016-07-11 本文编辑:张瑜杰)

