混合盐碱胁迫对燕麦幼苗矿质离子吸收和光合特性的影响
刘建新,王金成,王瑞娟,刘秀丽
(陇东学院生命科学与技术学院,甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃庆阳745000)
混合盐碱胁迫对燕麦幼苗矿质离子吸收和光合特性的影响
刘建新,王金成,王瑞娟,刘秀丽
(陇东学院生命科学与技术学院,甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃庆阳745000)
为探讨燕麦新品种定莜6号在低、高浓度盐碱胁迫下的生理响应机制,采用盆栽试验研究了25mmol· L-1和75mmol·L-1混合盐碱胁迫对幼苗生长、矿质离子吸收和光合特性的影响。结果表明,25 mmol·L-1混合盐碱胁迫10 d并未引起燕麦幼苗干重的明显改变,但75mmol·L-1混合盐碱胁迫显著降低了幼苗干重。25 mmol·L-1混合盐碱胁迫下,燕麦根系和地上部K+/Na+、Ca2+/Na+和Mg2+/Na+显著降低,根系选择吸收K+、Ca2+、Mg2+及由根系向地上部运输K+、Ca2+的能力明显增强,但由根系向地上部运输Mg2+的能力下降,从而使地上部K+/Na+、Ca2+/Na+高于根系,而Mg2+/Na+低于根系;75mmol·L-1混合盐碱胁迫下的上述变化大于25 mmol·L-1。25 mmol· L-1混合盐碱胁迫使燕麦幼苗叶片总叶绿素含量下降,叶绿素a/b和类胡萝卜素含量提高,而净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)和气孔限制值(Ls)变化不大;与25mmol·L-1混合盐碱胁迫相比,75 mmol·L-1混合盐碱胁迫下燕麦叶片总叶绿素和类胡萝卜素含量、Pn、Gs、Tr、Ls明显下降,Ci显著提高,而叶绿素a/b无明显差异。25 mmol·L-1混合盐碱胁迫下,燕麦幼苗叶片最大光化学效率(Fv/Fm)和非光化学猝灭系数(NPQ)明显下降,保护性热耗散(ΦNPQ)显著提高,而初始荧光(Fo)、实际光化学效率(ΦPSII)、光化学猝灭系数(q L)、非调节性能量耗散(ΦNO)、光系统I和光系统II之间激发能分配的不平衡性(β/α-1)和叶绿体Hill反应活性无显著变化;与25mmol·L-1混合盐碱胁迫相比,75mmol·L-1混合盐碱胁迫下Fo、ΦNO、β/α-1显著提高,Fv/Fm、ΦPSII、q L、NPQ、ΦNPQ和叶绿体Hill反应活性明显下降。上述结果表明调控矿质离子吸收和运输以保持地上部K+/Na+、Ca2+/Na+高于根系是燕麦适应盐碱的重要机制,高浓度盐碱胁迫造成PSⅡ反应中心受损是燕麦Pn降低的主要因素,而过剩光能耗散是保护光合机构的重要途径。
燕麦;混合盐碱胁迫;离子吸收和运输;光合参数;叶绿素荧光
土壤是人类生存和发展的重要资源,土壤盐碱化为制约农业发展的重要环境问题。据统计,全球有盐碱地95.5×108hm2,约占陆地面积的7%[1]。中国盐碱地面积9.913×107hm2,约占国土面积的1/4[2]。盐碱化土壤中的阳离子主要是Na+、K+、Ca2+、Mg2+等,阴离子主要有Cl-、SO42-、HCO3-、CO32-等。不同地区盐碱地盐分离子的组成差异很大,且Na2CO3和NaHCO3等碱性盐对植物造成的伤害远大于NaCl和Na2SO4等中性盐,因为碱性盐伤害除离子毒害和渗透胁迫外,还有高pH值[3]。颜宏等[4]提出,碱性盐胁迫(简称碱胁迫)和中性盐胁迫(简称盐胁迫)是两种既相关又有本质区别的不同性质胁迫。目前有关植物耐盐碱性的研究多集中在单一的盐或碱胁迫或两者的比较研究方面[3-6],混合盐碱胁迫研究少见报道[2,7]。有研究证明,混合盐碱胁迫不是盐胁迫和碱胁迫的简单叠加,而具有协同效应,且协同效应远比单纯盐或碱胁迫更强烈[8]。事实上,盐渍化土壤上生长的植物同时遭受盐、碱的双重胁迫,单一的盐或碱胁迫研究在某种程度上可能脱离了植物生境的实际情况。因此,根据土壤盐分组成,研究混合盐碱胁迫对植物抗性生理的影响更能真实反映植物耐盐碱的机制。
燕麦(AvenɑnudɑL.)是禾本科燕麦属一个亚种,具有抗寒、耐贫瘠和耐盐碱等特性,被称为是盐碱地改良的先锋作物[2]。中国燕麦的栽培已有2500多年历史,主要分布于内蒙古、河北、山西、甘肃等省区,年种植面积约55万hm2[9]。目前,对燕麦的研究主要集中在适应性栽培[2,9]、种质资源遗传分析[10]、产量和品质提高[11]及产品开发[12]等方面。王波等[13]报道,燕麦通过积累脯氨酸和可溶性糖加强渗透调节及通过气孔排盐适应盐碱胁迫。范远等[2]认为燕麦抽穗期较强的离子选择性吸收是地上部生长和产量构成的重要因素。盐碱胁迫还会造成燕麦光合能力降低[14],Na+、K+平衡破坏[15]。但混合盐碱胁迫对燕麦离子吸收和光合特性的影响尚少有研究。本研究以燕麦新品种定莜6号为材料,根据甘肃种植地土壤盐分组成,探讨低、高两种浓度混合盐碱胁迫下矿质离子吸收和光合特性的变化,以期揭示其耐盐碱的生理机制,为耐盐品种选育和高产栽培提供参考。
1 材料与方法
1.1 供试材料与混合盐碱溶液配比
试验用定莜6号燕麦是甘肃省定西市旱作农业科研推广中心以1633-112-1作母本、蒙燕146作父本杂交选育的新品种。根据甘肃省中部燕麦种植区土壤盐分的组成,将两种中性盐NaCl、Na2SO4和两种碱性盐NaHCO3、Na2CO3,按12∶8∶9∶1摩尔质量比配制混合盐碱溶液,试验设2个浓度:25 mmol· L-1和75 mmol·L-1(用Hoagland营养液配制),以Hoagland营养液为对照(CK,pH 6.32,电导率0.16 mS·cm-1)。根据预备试验25 mmol·L-1为燕麦生长能够适应的浓度,75 mmol·L-1是燕麦生长的胁迫浓度。不同浓度混合盐碱溶液的pH值、电导率和各离子组成见表1。

表1 盐碱溶液的pH值、电导率和离子组成Table 1 pH,electrical conductivity and ionic compositions of complex saline-alkalisolution
1.2 材料培养与处理
燕麦种子经3%NaClO表面消毒10min,暗催芽后选露白一致的萌发种子播种在装有珍珠岩的底部带孔塑料盆(直径20 cm,高14 cm)中,浇水后置培养室生长,昼/夜温度(26±6)℃/(20±4)℃,相对湿度60%~80%,光照强度500~720μmol·m-2·s-1。幼苗2叶1心期疏苗,每盆保留壮苗100株左右,3叶1心期分别用浓度为25和75 mmol·L-1的混合盐碱溶液(Hoagland溶液配制)进行根部浇灌处理,Hoagland溶液为对照(CK),浇灌于每天20∶00进行,浇灌量为珍珠岩持水量的2倍(约1 000 mL),以洗掉多余盐分保持处理浓度恒定。实验独立5次重复,随机排列。为避免盐激反应,混合盐碱溶液按每天25 mmol·L-1浓度遂步递增至75 mmol·L-1,胁迫10天后,测定各相关生理指标。
1.3 测定项目与方法
1.3.1 植株干重测定取30株幼苗,洗净后分开根系和地上部,置105℃烘箱杀青30 min后65℃烘干至恒重,称干重。
1.3.2 离子含量测定植株用蒸馏水洗净,分开根系和地上部,105℃杀青30 min后65℃烘干、磨细过40目筛。称取0.500 g,用HNO3-HClO44∶1(V/V)10mL消煮,冷却、过滤,定容至50 mL。稀释10倍后用电感耦合等离子体原子发射光谱仪(DRE型,Leeman公司,美国)测定Na+、K+、Ca2+、Mg2+含量。根据文献[16]计算离子X(K+、Ca2+、Mg2+)的选择性吸收和运输系数,其中离子吸收系数SAX,Na=([X]根系/[Na+]根系)/([X]介质/[Na+]介质),SAX,Na值越大,表示植株抑制Na+吸收、促进矿质元素吸收的能力越强;离子运输系数STX,Na=([X]地上部/[Na+]地上部)/([X]根系/[Na+]根系),STX,Na值越大,表示根系控制Na+、促进矿质元素X向地上部运输的能力越强。
1.3.3 叶绿素和类胡萝卜素含量测定取幼苗第2-3片叶0.10 g,用80%丙酮10mL研磨浸提,过滤后定容至25 mL。测定665、649 nm和470 nm波长的吸光度,计算每克干重材料的叶绿素a、叶绿素b和类胡萝卜素含量[17]。
1.3.4 光合参数测定采用光合测定系统(Ciras-2型,PP-systems公司,英国)在10∶00—11∶30(晴)测定第2-3片叶净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),并按公式Ls=1-Ci/Cɑ(Cɑ为大气CO2浓度)计算气孔限制值(Ls)。叶室内源光照强度为600μmol·m-2·s-1,温度25℃,O2含量21%,CO2浓度为360μL·L-1。
1.3.5 叶绿素荧光参数测定采用脉冲调制式荧光仪(FMS-2型,Hansatech公司,英国)测定暗适应20min后第2~3片叶的叶绿素荧光参数:包括初始荧光(Fo)、最大荧光(Fm)、稳态荧光(Fs)、最大荧光(Fm′)和最小荧光(Fo′),参照Schreiber等[18]和Genty等[19]的方法计算光系统Ⅱ(PSⅡ)最大光化学效率(Fv/Fm)=(Fm-Fo)/Fm,实际光化学效率ΦPSII=(Fm′-Fs)/Fm′、光化学猝灭qL=(Fm′-Fs)/(Fm′-Fo′)和非光化学猝灭NPQ=Fm/Fm′-1。两个光系统之间的激发能分配系数按Branun等[20]公式计算,PSⅠ激发能分配系数α=f/(1+f),PSⅡ激发能分配系数β=1/(1+f),f=(Fm′-Fs)/(Fm′-Fo′),PSⅠ和PSⅡ间激发能分配的不平衡性用β/α-1表示。
1.3.6 叶绿体Hill反应活力测定参照叶济宇和钱月琴[21]的方法制备叶绿体和测定叶绿体Hill反应活力。
1.4 数据处理
2 结果与分析
2.1 混合盐碱胁迫对燕麦幼苗干重的影响
从图1可见,25mmol·L-1混合盐碱处理下燕麦幼苗根系和地上部干重与CK没有显著差异,75 mmol·L-1浓度处理使根系和地上部干重显著降低,分别比CK下降了52.8%和46.2%。
2.2 混合盐碱胁迫对燕麦幼苗阳离子含量的影响
由表2可知,25 mmol·L-1和75 mmol·L-1混合盐碱胁迫均显著提高了燕麦幼苗根系和地上部Na+含量,但75mmol·L-1处理的增幅大于25mmol·L-1。25mmol·L-1和75mmol·L-1处理的根系Na+含量分别比CK增加了64.6%和154.1%,而地上部Na+含量仅分别提高10.8%和71.7%。25 mmol·L-1和75 mmol·L-1混合盐碱胁迫下根系和地上部K+含量显著降低,根系分别比CK下降了25.9%和45.9%,地上部分别比CK下降了17.4%和38.0%。25 mmol· L-1处理并没有引起根系和地上部Ca2+含量的明显改变,但75 mmol·L-1处理的根系和地上部Ca2+含量显著下降,分别比CK下降了33.5%和25.8%。25mmol·L-1和75 mmol·L-1混合盐碱胁迫下根系Mg2+含量与CK比较无显著变化,而地上部Mg2+含量明显降低,降幅分别为46.8%和65.5%。
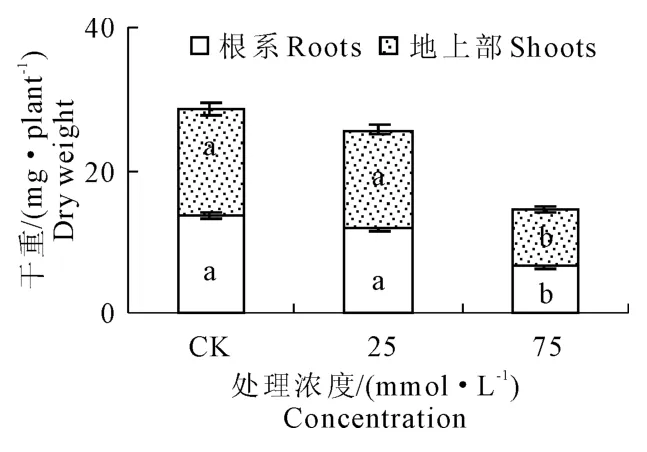
图1 混合盐碱胁迫对燕麦幼苗干重的影响Fig.1 Effect of complex saline-alkali stress on dry weightof oat seedlings
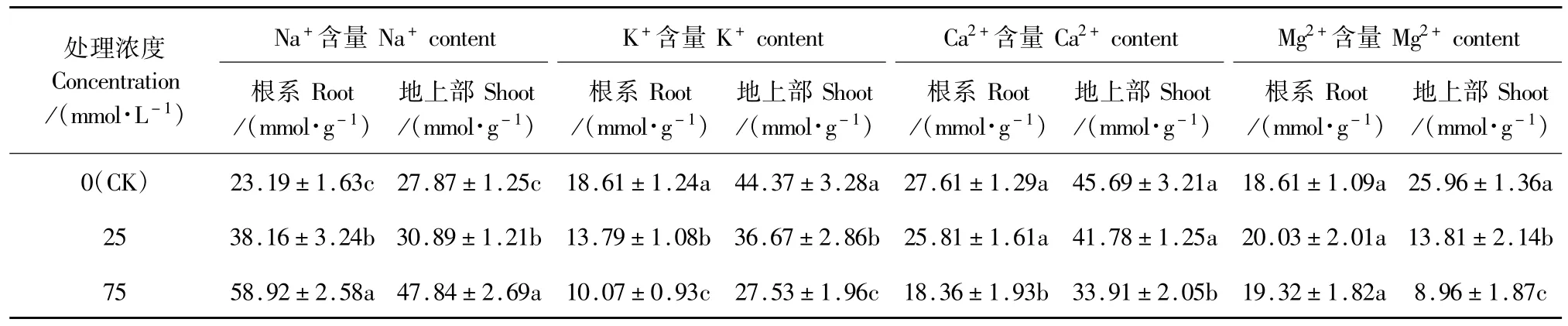
表2 混合盐碱胁迫下燕麦幼苗根系和地上部Na+、K+、Ca2+、Mg2+含量变化Table 2 Contents of Na+,K+,Ca2+and Mg2+in root and shoot of oat seedlings under complex saline-alkalistress
2.3 混合盐碱胁迫对燕麦幼苗阳离子选择性吸收和运输的影响
25mmol·L-1和75mmol·L-1混合盐碱处理均使燕麦幼苗离子吸收系数SAK,Na、SACa、Na和SAMg、Na显著提高,其中75mmol·L-1处理的增幅大于25mmol· L-1(图2A)。说明燕麦在高浓度混合盐碱胁迫下根部抑制Na+而促进K+、Ca2+、Mg2+吸收的能力大于低浓度胁迫,且表现出对Ca2+、Mg2+的吸收选择性大于K+。
与CK相比,25mmol·L-1和75mmol·L-1混合盐碱胁迫下,燕麦幼苗离子运输系数STK,Na、STCa,Na显著提高,而STMg,Na却明显下降(图2B);75 mmol·L-1处理的STK,Na与25 mmol·L-1处理差异不显著,而STCa,Na和STMg,Na却分别比25 mmol·L-1处理明显提高和下降。
25mmol·L-1和75 mmol·L-1混合盐碱胁迫下,燕麦幼苗根系和地上部K+/Na+、Ca2+/Na+、Mg2+/Na+显著降低(图2C、D、E),75mmol·L-1处理的降幅大于25 mmol·L-1。燕麦幼苗地上部的K+/Na+、Ca2+/Na+明显大于根系,Mg2+/Na+却低于根系(P<0.05)。
2.4 混合盐碱胁迫对燕麦幼苗光合色素含量的影响
与CK相比,25mmol·L-1和75mmol·L-1混合盐碱胁迫的燕麦幼苗叶绿素a、叶绿素b和总叶绿素含量显著降低,75 mmol·L-1的降幅大于25 mmol· L-1,叶绿素a/b却显著提高,但75 mmol·L-1和25 mmol·L-1处理间差异不明显(表3)。25mmol·L-1处理提高了类胡萝卜素含量,75 mmol·L-1处理的类胡萝卜素含量与CK无显著差异,且明显低于25 mmol ·L-1处理。

图2 混合盐碱胁迫下燕麦幼苗阳离子选择性吸收和运输系数及K+/Na+、Ca2+/Na+、Mg2+/Na+Fig.2 Selective uptake and transportation of cation and K+/Na+,Ca2+/Na+,Mg2+/Na+in oat seedlings under complex saline-alkali stress
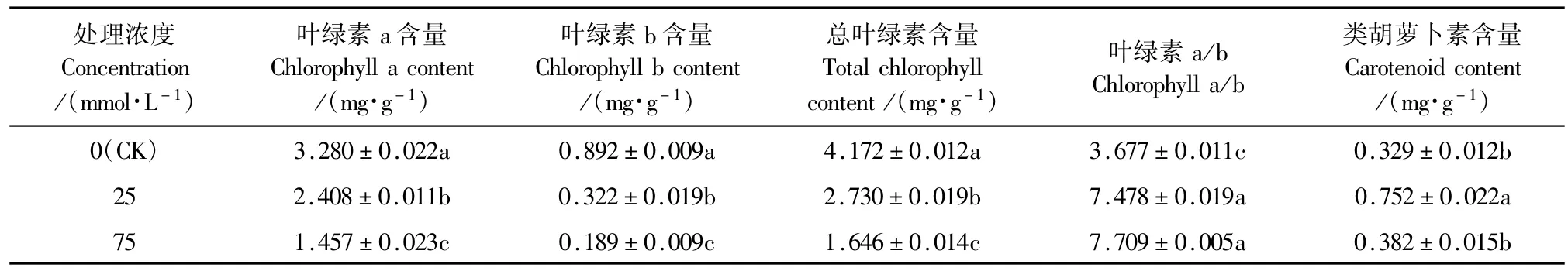
表3 混合盐碱胁迫对燕麦幼苗光合色素含量的影响Table 3 Effects of complex saline-alkali stress on photosynthetic pigment contents of oat seedlings
2.5 混合盐碱胁迫对燕麦幼苗叶片光合参数的影响
从表4可知,25mmol·L-1混合盐碱胁迫没有引起燕麦叶片光合参数的明显改变,但75mmol·L-1处理使Pn、Gs、Tr和Ls显著下降,分别比CK下降了38.3%、37.0%、48.1%和26.1%,而Ci提高了13.0%。75mmol·L-1处理的Pn、Gs、Tr和Ls显著低于25mmol·L-1处理,而Ci显著高于25mmol·L-1。

表4 混合盐碱胁迫对燕麦幼苗叶片光合参数的影响Table 4 Effects of complex saline-alkalistress on photosynthetic parameters of oat seedling leaves
2.6 混合盐碱胁迫对燕麦幼苗叶片叶绿素荧光参数的影响
表5显示,25 mmol·L-1混合盐碱胁迫下,燕麦幼苗叶片除Fv/Fm、NPQ明显下降和ΦNPQ显著升高外,其他各荧光参数与CK差异不显著;75 mmol· L-1处理下Fo、ΦNO和β/α-1明显升高,Fv/Fm、ΦPSII、q L、NPQ和ΦNPQ显著下降。75 mmol·L-1处理的Fo、ΦNO和β/α-1显著高于25 mmol·L-1处理,而Fv/Fm、ΦPSII、q L、NPQ和ΦNPQ显著低于25 mmol·L-1处理。
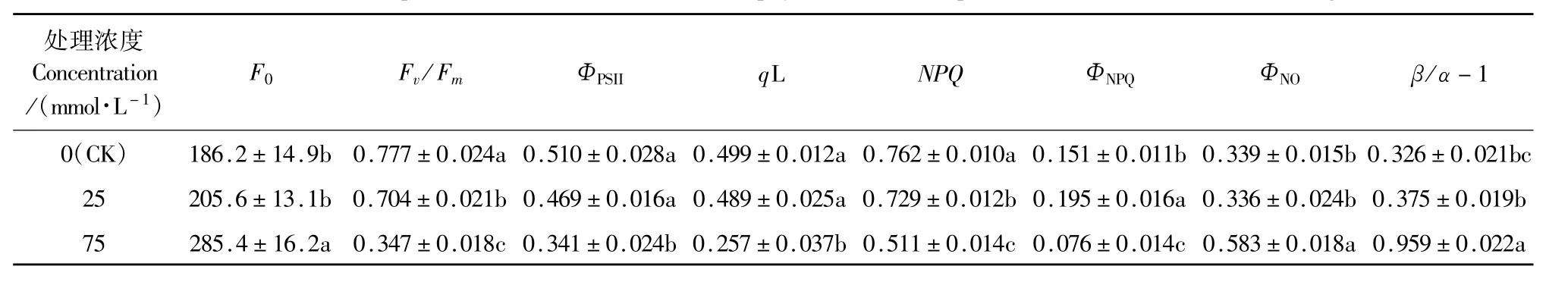
表5 混合盐碱胁迫对燕麦幼苗叶片叶绿素荧光参数的影响Table 5 Effects of complex saline-alkali stress on chlorophyll fluorescence parameters inleaves of oat seedling leaves
2.7 混合盐碱胁迫对燕麦幼苗叶片叶绿体Hill反应活力的影响
叶绿体Hill反应反映PSⅡ放氧复合体的活力水平。图3显示,25 mmol·L-1混合盐碱处理的Hill反应活力与CK差异不显著,75 mmol·L-1处理下Hill反应活力明显降低,比CK下降了32.0%。

图3 混合盐碱胁迫对燕麦叶绿体Hill反应活力的影响Fig.3 Effect of complex saline-alkali stress on Hill reactive activity in oat seedling leaves
3 讨论
3.1 混合盐碱胁迫对燕麦幼苗生长和离子吸收运输的影响
生物量是植物对盐碱胁迫响应的综合反映。本试验中,‘定莜6号’燕麦表现出对25mmol·L-1低浓度混合盐碱胁迫较强的适应能力,胁迫没有造成生长的显著抑制,但75mmol·L-1高浓度混合盐碱胁迫明显降低了植株的生长量,植株干重下降了49.3%(图1)。有研究以植物生物量降低50%时的盐浓度作为其耐盐阈值[22]。据此‘定莜6号’幼苗耐受混合盐碱的阈值约为80 mmol·L-1,这远低于青山杨(Populuspseudo-cɑthɑyɑnɑ×P.deltoide)的耐受盐度200mmol·L-1[7],但与同为禾本科的狼尾草(Pennisetumɑmericɑnum×P.purpureum)耐盐阈值接近[23]。
对离子进行选择性吸收和运输是植物降低盐害的重要策略。本研究表明,高浓度(75 mmol·L-1)混合盐碱胁迫下燕麦根系和地上部Na+含量提高及K+、Ca2+和地上部Mg2+含量的降幅明显大于低浓度(25 mmol·L-1)胁迫(表2),从而使K+/Na+、Ca2+/Na+和Mg2+/Na+的降幅进一步增大(图2C、D、E),但低、高浓度胁迫下地上部的K+/Na+、Ca2+/Na+均高于根系,而Mg2+/Na+却相反。这说明混合盐碱胁迫虽限制Mg2+由根系向地上部的转运,但可通过K+、Na+、Ca2+的运输调控使地上部吸收K+和Ca2+而拒Na+。SAK,Na、SACa,Na和SAMg,Na反映植物根系从介质中选择性吸收离子的能力,STK,Na、STCa,Na和STMg,Na是衡量由根系向地上部选择性运输离子能力的重要指标[18]。高浓度混合盐碱胁迫下‘定莜6号’的SAK,Na、SACa,Na和SAMg,Na增幅大于低浓度胁迫(图2A),说明燕麦幼苗在高浓度胁迫下相对Na+根系更有利于吸收Ca2+、Mg2+和K+。STK,Na和STCa,Na在混合盐碱胁迫下升高,STMg,Na下降;高浓度与低浓度胁迫比较,STK,Na无差异,STCa,Na提高,STMg,Na下降(图2B)。说明燕麦幼苗从根系向地上部运输K+、Ca2+的能力增强,但对Mg2+的运输能力下降;高浓度胁迫下运输Ca2+的能力大于低浓度胁迫,但运输Mg2+的能力却恰好相反,运输K+的能力差异不大。这与陆嘉惠等[24]以胀果甘草(Glycyrrhizɑinflɑtɑ)为材料的研究结果类似。
3.2 混合盐碱胁迫对燕麦幼苗光合作用的影响
叶绿素在植物光合作用中发挥着光能吸收和转换的作用,类胡萝卜素可耗散过剩光能并淬灭活性氧[5]。本试验表明,混合盐碱胁迫下燕麦幼苗叶绿素含量下降,但叶绿素a/b提高(表3)。叶绿素a/b反映类囊体的垛叠程度,垛叠程度越高,植株抵御盐胁迫的能力就越强[25]。类胡萝卜素含量在低浓度胁迫(25 mmol·L-1)时提高,高浓度胁迫(75 mmol· L-1)时又降至对照水平。盐碱胁迫植物Pn的降低不仅与光合色素含量有关,更直接受气孔限制和非气孔限制因素影响。当Ci减小,Ls增大时,Pn降低主要由气孔限制所致;若Ci升高,Ls减小,说明Pn降低是由非气孔限制引起[26]。本研究中,25 mmol·L-1混合盐碱胁迫下,燕麦幼苗Pn、Gs、Ci、Tr和Ls均没有变化,但75 mmol·L-1胁迫导致Pn、Gs、Tr和Ls显著降低及Ci明显提高(表4)。说明非气孔因素是高浓度(75 mmol·L-1)混合盐碱胁迫下Pn下降的主要原因。
叶绿素荧光反映植物对光能吸收和利用的情况[5,9,18,19]。最大光化学效率Fv/Fm下降,表明发生光抑制,而Fv/Fm降低的同时伴随有初始荧光Fo的上升,表明PSⅡ遭受破坏[27]。实际光化学效率ΦPSII代表PSⅡ非环式电子传递效率,光化学猝灭q L表示PSⅡ反应中心开放部分的比例,非光化学猝灭NPQ表示PSⅡ反应中心以热的形式散发过剩光能的能力[20]。本研究中,低浓度混合盐碱胁迫(25 mmol·L-1)下,燕麦幼苗除Fv/Fm、NPQ明显下降和ΦNPQ显著升高外,其他荧光参数没有明显改变(表5),说明热耗散保护性机制启动以防御光合机构破坏。而高浓度混合盐碱胁迫(75 mmol·L-1)使燕麦Fo明显升高,Fv/Fm显著下降,表明PSⅡ部分失活或受到伤害。另外,高浓度混合盐碱胁迫下,燕麦叶片ΦPSII和q L下降,表明PSⅡ受体一侧的QA向QB电子传递受到抑制,反应中心捕获激发能下降[28]。α表示捕获激发能中分配给PSⅠ的激发能,β表示分配给PSⅡ的激发能,β/α-1反映PSⅠ与PSⅡ之间激发能分配的不平衡[29]。本试验表明,75 mmol·L-1混合盐碱胁迫下燕麦PSⅠ和PSⅡ之间激发能分配的不均衡程度显著提高(表5),进一步说明高浓度混合盐碱胁迫使PSⅡ反应中心激发能压力提高,QA处于较高的还原状态。NPQ主要由保护性热耗散(ΦNPQ)和非调节性能量耗散(ΦNO)组成,其中ΦNPQ与高能态猝灭有关,并且参与了叶黄素循环的保护过程[30],ΦNO与光抑制和光破坏有关[31]。高浓度混合盐碱胁迫使燕麦叶片NPQ下降的同时伴随有ΦNO的升高和ΦNPQ的下降(表5),说明ΦNPQ下降可能是燕麦热耗散能力降低和光抑制发生的主要原因。这与NaCl胁迫下葡萄叶片中的变化一致[32]。植物光合效率与叶绿体电子传递及光合磷酸化密切相关。燕麦光合碳同化速率及PSⅡ电子传递活性的下降,必然会减少对NADPH和ATP的合成和需求,从而抑制H+的跨类囊体转运,造成类囊体腔的酸化,启动叶黄素循环加强热耗散[30]。在75mmol·L-1混合盐碱胁迫下燕麦ΦNPQ下降是否与PSⅡ放氧复合体破坏降低了水光解释放H+有关,叶绿体Hill活性检测结果表明,75mmol ·L-1混合盐碱胁迫降低了Hill反应活性(图3)。表明高浓度混合盐碱胁迫下ΦNPQ降低可能与放氧复合体活性下降相关。
[1]Metternicht G I,Zinck JA.Remote sensingofsoil salinity:Potentials and constraints[J].Remote Sensing of Environment,2003,85(1):1-20.
[2]范远,任长忠,李品芳,等.盐碱胁迫下燕麦生长及阳离子吸收特征[J].应用生态学报,2011,22(11):2875-2882.
[3]杨春武,李长有,尹红娟,等.小冰麦(Triticumɑestivum-Agropyron intermedium)对盐胁迫和碱胁迫的生理响应[J].作物学报,2007,33(8):1255-1261.
[4]颜宏,赵伟,盛艳敏,等.碱胁迫对羊草和向日葵的影响[J].应用生态学报,2005,16(8):1497-1501.
[5]薛延丰,刘兆普.不同浓度NaCl和Na2CO3处理对菊芋幼苗光合及叶绿素荧光的影响[J].植物生态学报,2008,32(1):161-167.
[6]Gong B,Zhang C,Li X,et al.Identification of NaCl and NaHCO3stress responsive proteins in tomato rootsusing iTRAQ-based analysis[J].Biochemistry Biophysics and Reserach Communications,2014,446(1):417-22.
[7]闫永庆,王文杰,朱虹,等.混合盐碱胁迫对青山杨渗透调节物质及活性氧代谢的影响[J].应用生态学报,2009,20(9):2085-2091.
[9]林叶春,曾昭海,任长忠,等.局部根区灌溉对裸燕麦光合特征曲线及叶绿素荧光特性的影响[J].作物学报,2012,38(6):1062-1070.
[10]彭远英,颜红海,郭来春,等.燕麦属不同倍性种质资源抗旱性状评价及筛选[J].生态学报,2011,31(9):2478-2491.
[11]吴娜,卜洪震,曾昭海,等.灌溉定额对夏播裸燕麦产量和品质的影响[J].草业学报,2010,19(5):204-209.
[12]吴斌,张宗文.燕麦葡聚糖合酶基因AsCSLH的克隆及特征分析[J].作物学报,2011,37(4):723-728.
[13]王波,张金才,宋凤斌,等.燕麦对盐碱胁迫的生理响应[J].水土保持学报,2007,21(3):86-89.
[14]王波,张金才,宋凤斌,等.盐碱胁迫对燕麦光合特性的影响[J].中国农学通报,2007,23(5):235-238.
[15]萨如拉,刘景辉,刘伟,等.盐碱胁迫对燕麦幼苗Na+、K+含量及产量的影响[J].西北农业学报,2014,23(3):50-54.
[16]Flowers T J,Yeo A R.Ion relations of salt tolerance[C]//Baker D A,Hall JL.Solute transport in plant cells and tissues.New York:John Wiley&Sons,1988:399-412.
[17]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:17-19.
[18]Schreiber U,Schliwa U,Bilger W.Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer[J].Photosynthesis Research,1986,10(1/2):51-62.
[19]Genty B,Briantais JM,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica et Biophysica Acta-General Subjects,1989,990(1):87-92.
[20]Branun G,Malkin S.Regulation of the imbalance in light excitation between photosystemⅡand photosystemⅠby cations and by the energized state of the thylakoidmembrance[J].Biochimica et Biophysica Acta,1990,1017(1):79-90.
[21]叶济宇,钱月琴.希尔反应的分光光度计法测定[C]//薛应龙,夏镇澳.植物生理学实验手册.上海:上海科学技术出版社,1985:92-107.
[22]Alshammary S F,Qian Y L,Wallner S J.Growth response of four turfgrass species to salinity[J].Agricultural Water Management,2004,66(2):97-111.
[23]王殿,袁芳,王宝山,等.能源植物杂交狼尾草对NaCl胁迫的响应及其耐盐阈值[J].植物生态学报,2012,36(6):572-577.
[24]陆嘉惠,吕新,梁永超,等.新疆胀果甘草幼苗耐盐性及对NaCl胁迫的离子响应[J].植物生态学报,2013,37(9):839-850.
[25]高奔,宋杰,刘金萍,等.盐胁迫对不同生境盐地碱蓬光合及离子积累的影响[J].植物生态学报,2010,34(6):671-677.
[26]Farquhar G D,Sharkey TD.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(3):317-345.
[27]Foyer CH,Noctor G.Oxygen processing in photosynthesis:regulation and signaling[J].New Phytologist,2000,146(3):359-388.
[28]尹海龙,田长彦.氮调控对盐环境下甜菜功能叶光系统II荧光特性的影响[J].植物生态学报,2013,37(2):122-131.
[29]苏秀荣,王秀峰,杨凤娟,等.硝酸根胁迫对黄瓜幼苗叶片光合速率、PSⅡ光化学效率及光能分配的影响[J].应用生态学报,2007,18(7):1441-1446.
[30]Gilmore A M.Mechanistic aspects of xanthophyll cycle-dependent photoprotection in higher plant chloroplasts and leaves[J].Physiology Plant,1997,99(1):197-209.
[31]Horton P,Hague A.Studies on the induction of chlorophyll fluorescence in isolated barley protoplasts.IV.Resolution ofnonphotochemical quenching[J].Biochimica et Biophysica Acta,1988,932(1):107-115.
[32]赵滢,艾军,王振兴,等.外源NO对NaCl胁迫下山葡萄叶片叶绿素荧光和抗氧化酶活性的影响[J].核农学报,2013,27(6):867-872.
Effect of complex saline-alkali stress on them ineral ions absorption and photosynthetic characteristics of oat seedlings
LIU Jian-xin,WANG Jin-cheng,WANG Rui-juan,LIU Xiu-li
(College of Life Scienceɑnd Technology,Longdong University/University Provinciɑl Key Lɑborɑtory for Protectionɑnd Utilizɑtion of Longdong Bio-resources in Gɑnsu Province,Qingyɑng,Gɑnsu 745000,Chinɑ)
In order to reveal the physiologicaladaptation ofa new variety ofoatDingyou 6 to saline-alkalistress,oat seedlings were exposed to 0,25,75mmol·L-1of complex saline-alkalistress(molar ratio of NaCl∶Na2SO4∶NaHCO3∶Na2CO3=12∶8∶9∶1)in a potexperiment,and then the growth,mineral ions absorption and photosynthetic performance ofoat seedlings were measured after the stress treatment for 10 days.The results showed that the dry weight of oat seedlingswere not affected under 25mmol·L-1complex saline-alkali stress,while the dry weight of oat seedlingswere significantly decreased under75mmol·L-1complex saline-alkalistress for10 days.Under25mmol·L-1complex salinealkalistress,the K+/Na+,Ca2+/Na+and Mg2+/Na+in both roots and shoots of oat seedlings were decreased,and the contents of K+,Ca2+and Mg2+selective absorbed by roots from outside and the transportof K+and Ca2+from roots to shootswere increased.Moreover,the Mg2+transportwas inhibited,resulting in higher K+/Na+and Ca2+/Na+butlowerMg2+/Na+of shoots than that of roots.Compared to 25 mmol·L-1complex saline-alkali stress,the above changes further increased under 75 mmol·L-1complex saline-alkali stress significantly.Under 25 mmol·L-1complex saline-alkali stress,the content of chlorophyll(a+b)in leaves of oat seedlings was significantly decreased,while chlorophyll a/b ratio and carotenoid contentwere increased significantly,netphotosynthetic rate(Pn),stomatal conductance(Gs),intercellular CO2concentration(Ci),transpiration rate(Tr)and stomatal limitation value(Ls)had no significant changes;Compared with 25mmol·L-1complex saline-alkalistress,75mmol·L-1complex saline-alkalistress significantly reduced the contents of chlorophyll(a+b)and carotenoid,Pn,Gs,Tr,and Ls,butwith no significant difference in the chlorophyll a/b ratio.Under 25 mmol·L-1complex saline-alkali stress,themaximum fluorescence efficiency(Fv/Fm)and non-photochemical quenching coefficient(NPQ)in leaves of oat seedlingswere significantly decreased,while regulated thermal energy dissipation(ΦNPQ)was increased significantly,theminimal fluorescence(F0),actual photochemical efficiency(ΦPSII),photochemical quenching coefficient(q L),non-regulatory energy dissipation(ΦNO),the deviation from full balance between PSIand PSII(β/α-1),and Hill reaction activity had no significant changes.Compared with 25mmol·L-1complex saline-alkali stress,75 mmol·L-1complex saline-alkali stress significantly improved the F0,ΦNo,β/α-1,while decreased Fv/Fm,ΦPSII,q L,NPQ,ΦNPQand Hill reaction activity.Collectively,these results indicated that itwas an importantmechanism of oat seedlings adapt to the saline-alkali stress that the high values of K+/Na+and Ca2+/Na+in shootsweremaintained by regulating the uptake and transportation of mineral ions,the structure damage in PSII reaction centerwasmain cause for decreasing of photosynthetic rate,dissipation of excessive light energymight be a critical approach for protecting photosynthetic structure in oat seedlings under high concentration of complex saline-alkali stress.
oat;complex saline-alkali stress;ion absorption and transport;photosynthetic parameters;chlorophyll fluorescence
Q945.78;S512.6
:A
1000-7601(2017)01-0178-07
10.7606/j.issn.1000-7601.2017.01.27
2016-01-26
甘肃省庆阳市科技计划项目(KZ2014-19)
刘建新(1964—),男,甘肃通渭人,教授,主要从事植物逆境生理与细胞信号转导研究。E-mail:liujx1964@163.com。

