通过CRISPR/Cas系统构建miR-17-92基因簇双切载体1)
金姝含 杜丽萍 邹肖肖 于泽 梁洋
(东北林业大学,哈尔滨,150040)
通过CRISPR/Cas系统构建miR-17-92基因簇双切载体1)
金姝含 杜丽萍 邹肖肖 于泽 梁洋
(东北林业大学,哈尔滨,150040)
通过CRISPR/Cas系统来构建miR-17-92基因簇的双切载体,研究结果表明:在miR-17-92基因簇的序列上找到了2个PAM(TGG和GGG)位点,从而得到了2个原间隔序列,设计合成基因簇双链crRNA;合成该片段并将其插入到pX260载体,使得在同一个载体上虽然只有一个g-RNA,但能够同时切割两个不同的靶位点;将该载体转染NIH3T3细胞验证切割效率,PCR结果和测序结果显示,所构建的CRISPR系统可以对基因片段进行有效切割。
CRISPR/Cas系统;miR-17-92基因簇;双切载体;crRNA
We constructed double-cut carrier ofmiR-17-92 gene cluster using CRISPR/Cas9 system. We identified two PAM and two protospacesare, and designed pre-crRNAs. The synthesized pre-crRNAs (that was the designed annealing oligonucleotides based on the sequence specific) were inserted between the pX260 carrier. Therefore,there is only one g-RNA in the same carrier, cutting two different target sites at the same time. NIH3T3 cells were transfected by plasmid of pX260 carrier including pre-crRNAs for the cutting effect. ThemiR-17-92 gene was cut by CRISPR/Cas system.
2013年初,一种全新的CRISPR/Cas9(clustered regularly interspaced short palindromic repeats(CRISPR)/CRISPR-associated(Cas9))基因组定点改造技术出现,即利用靶点特异性的RNA将Cas9核酸酶带到基因组上的具体靶点,从而对特定基因位点进行切割,该技术一经问世,便迅速被应用到各种基因组编辑中,并明显提高了编辑效率和准确度。最近研究表明,利用CRISPR/Cas9技术,也能单酶切miRNA,使得小鼠细胞中miRNA的水平被敲低[1]。
MicroRNA(miRNAs)是内源性非编码小RNA,大小约为20~22个核苷酸,存在于真核基因组中,不编码蛋白,而是通过抑制靶基因mRNA的翻译或将其降解,在转录或翻译水平调节相关基因表达[2]。有研究预测其能够负向调控哺乳动物中一半以上的蛋白质编码基因[3],在生物体的早期发育、细胞增殖、细胞凋亡、脂肪代谢和细胞分化等方面发挥重要的生理作用[4]。近年研究还发现,miRNA能够影响肿瘤的发生、发展[5]。
在脊椎动物中,miR-17-92基因簇序列十分保守,编码miR-17-5p、miR-17-3p、miR-18a、miR-19a、miR-20a、miR-19b-1和miR-92-1等7个miRNAs[6],这些miRNAs在基因组上成簇存在,并以多顺反子形式转录。目前miR-17-92基因簇与哺乳动物器官发育,以及多种肿瘤发生密切相关。在淋巴瘤、肺癌、白血病、宫颈癌、子宫内膜癌和卵巢癌、前列腺癌、结肠癌、胃癌等很多肿瘤细胞中均存在高表达[7]。但同时,也有研究发现,在人类GBM异种移植的小鼠中,miR-17-92的表达提高了CAR-T-细胞抗肿瘤的活性[8]。因此目前认为,miR-17-92基因簇可能具有癌基因和抑癌基因双重功能,但对其具体作用机制的研究尚不清楚。
综上所述,为了探讨miR-17-92基因簇在疾病尤其是癌症发生中的作用机制,本文通过CRISPR/Cas系统构建miR-17-92基因簇的双切载体,使得在同一个载体上能够同时切割两个不同的靶位点,得到了miR-17-92基因簇缺失突变,并降低了脱靶率和移码突变的可能性,为进一步利用miR-17-92基因簇进行疾病和肿瘤发生机制的研究奠定基础。
1 材料与方法
pX260载体和NIH3T3细胞,由本实验室保存。
限制性内切酶Bbs1,T4 DNA连接酶购自TaKaRa公司;DNA凝胶回收试剂盒、快速质粒小量提取试剂盒购自Omega公司;琼脂糖购自Biowest公司;脂质体2000购自Invitrogen公司;DMEM高糖培养基购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;其余试剂为国产分析纯试剂;PCR引物合成以及测序分析由上海英骏生物技术有限公司完成。
1.1 crRNA序列的设计
利用NCBI上的BLAST得到小鼠miR-17-92基因簇序列,通过生物信息学方法,在该序列上找到2个PAM(TGG和GGG)位点,从而得到了2个原间隔序列,分别为:
5’-ATTTAGCAGGAATAAAGTGAACCTCACCTTGGG-3’,
5’-CCAGAAGATGTGAAAATGACAATATTGCTGAAG-3’。
通过primer5设计含有BbS1酶切位点的引物,由生物公司合成crRNA,序列为:5’…CAAACATTTAGCAGGAATAAAGTGAACCTCACCTTGTT…AACGAAGATGTGAAAATGACAATATTGCTGAAGGTTTTAG…-3’。
1.2 质粒载体的构建
用Bbs1酶对pX260载体进行酶切(图1),酶切体系50 μL,37 ℃,60 min。回收线性载体,用小牛碱性磷酸酶CIP去除线性质粒载体5’端磷酸,将退火后的crRNA插入到2个Bbs I酶切位点之间,用T4 DNA连接酶,连接产物转化并提取质粒,最终得到了小鼠miR-17-92基因簇的双切载体,并进行进一步的检测。
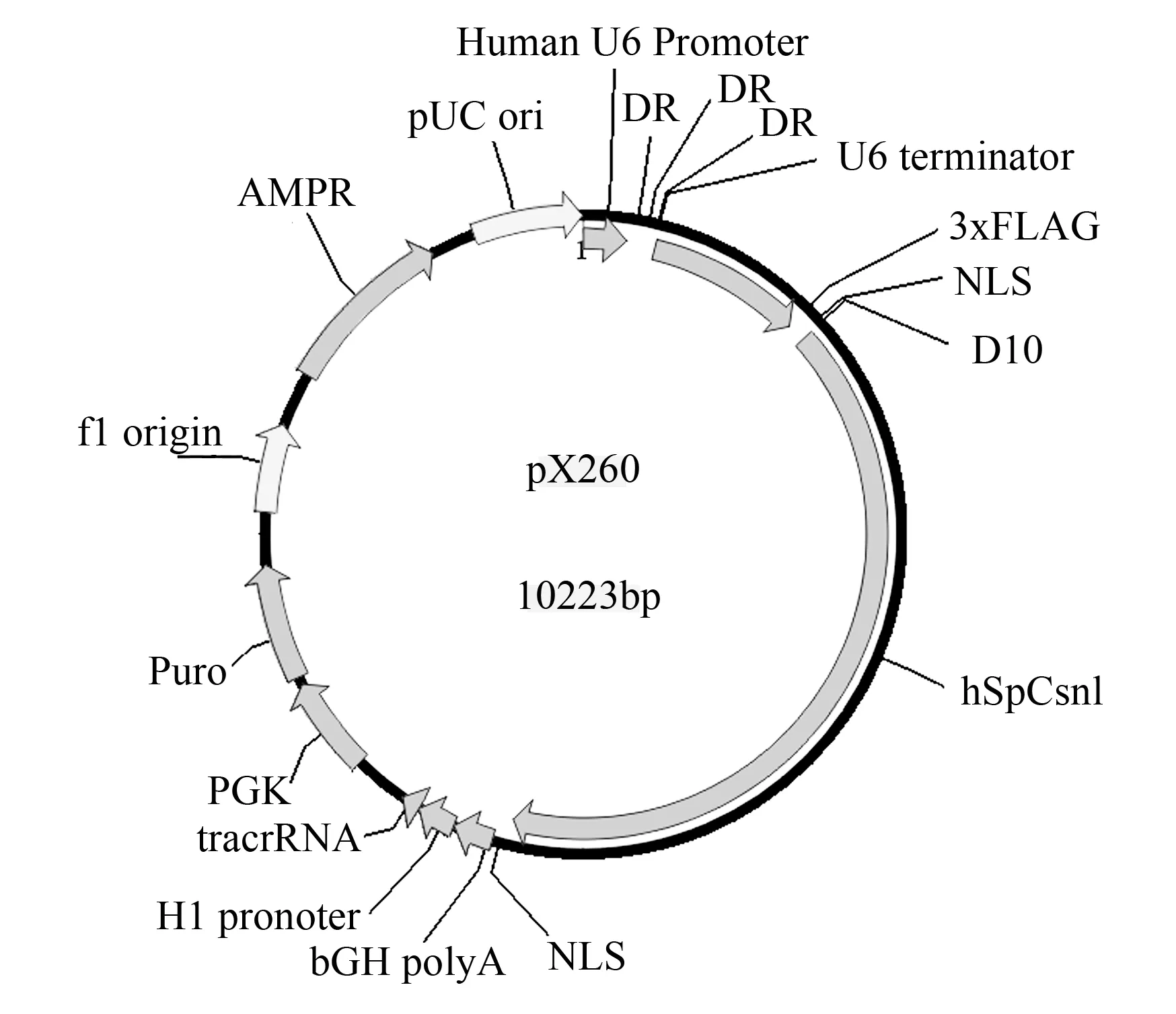
图1 pX260载体图谱
1.3miR-17-92基因簇双切载体切割效率检测
NIH3T3细胞系的培养:NIH3T3细胞复苏后传代培养(DMEM合成培养基:含10%胎牛血清,1%谷氨酰胺,1%双抗),待细胞传2代以后准备转染。
转染:转染前1天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为50%~60%,细胞铺24孔板,添加0.5 mL DMEM合成培养基(不含抗生素);对于每孔细胞,加入miR-17-92基因簇的双切载体质粒0.3 μg,脂质体2 000 1 μL,37 ℃,5%的CO2中培养24 h。
基因组检测:利用试剂盒提取NIH3T3细胞全基因组,以该基因组为模板,在小鼠miR-17-92基因簇序列上利用prime5设计检测引物P1和P2,进行PCR检测和测序分析,扩增长度约为1 548 bp。
检测引物序列为:
P1:5-ACGGATGTGAATCTTGGTGGGTT-3,
P2:5-GAAACCAACTGTGCTGCCCAAATG-3。
PCR条件为:95 ℃ 5 min;95 ℃ 30 s;53 ℃ 30 s;72 ℃ 1 min;72 ℃ 10 min 30个循环,反应体系为20 μL。
并参考左其生[9],俞珺瑶等的方法[10],利用Image J软件分析条带的灰度值,公式为:
相对切割效率=突变产物剪切条带灰度值/(突变产物剪切条带灰度值+未突变条带灰度值)。
2 结果与分析
2.1 crRNA序列的设计
通过NCBI数据库得到小鼠miR-17-92基因簇序列,利用生物信息学方法,在该序列上找到两个PAM(TGG和GGG)位点(下划线标注),从而得到了两段原间隔序列(protospace(1)和(2),图2中两段着重显示部分),三角形标记表示核酸酶spCas9的切点位置,进而设计了小鼠miR-17-92基因簇crRNA序列(5’…CAAACATTTAGCAGGAATAAAGTGAACCTCACCTTGTT…AACGAAGATGTGAAAATGACAATATTGCTGAAGGTTTTAG…-3),由生物公司合成该段序列。
2.2 CRISPR/Cas系统miR-17-92基因簇双切载体的构建
图2显示了通过CRISPR/Cas系统构建的miR-17-92基因簇双切载体结果。通过Bbs1酶对pX260载体进行双酶切,将合成的双链crRNA片段插入到两个Bbs I酶切位点之间(箭头标注),作为引导序列,最终得到了小鼠miR-17-92基因簇的双切载体,用于以下的检测实验。
2.3miR-17-92基因簇双切载体的检测
为了检测所构建载体的切割效率,将该载体转染NIH3T3细胞,并提取细胞全基因组,再通过PCR法、灰度分析法和测序方法分别检测基因组中miR-17-92基因簇的切割情况。
2.3.1 PCR检测
利用引物P1P2进行PCR检测,图3结果显示:1泳道为对照组,即空载体转染NIH3T3细胞,扩增的miR-17-92基因片段,约1 548 bp左右,没有切割现象;2泳道为试验组,即miR-17-92基因簇双切载体质粒转染NIH3T3细胞组,由于很难达到100%切割,因此显示两条带,上端为未被切割的片段,约1 548 bp左右,下端为被切割后修复的片段(条带标记为3),由于中间切割碱基长度约为948 bp左右,因此切割后重组长度约600 bp左右。4号标记为无条带空白位置,用于灰度分析。
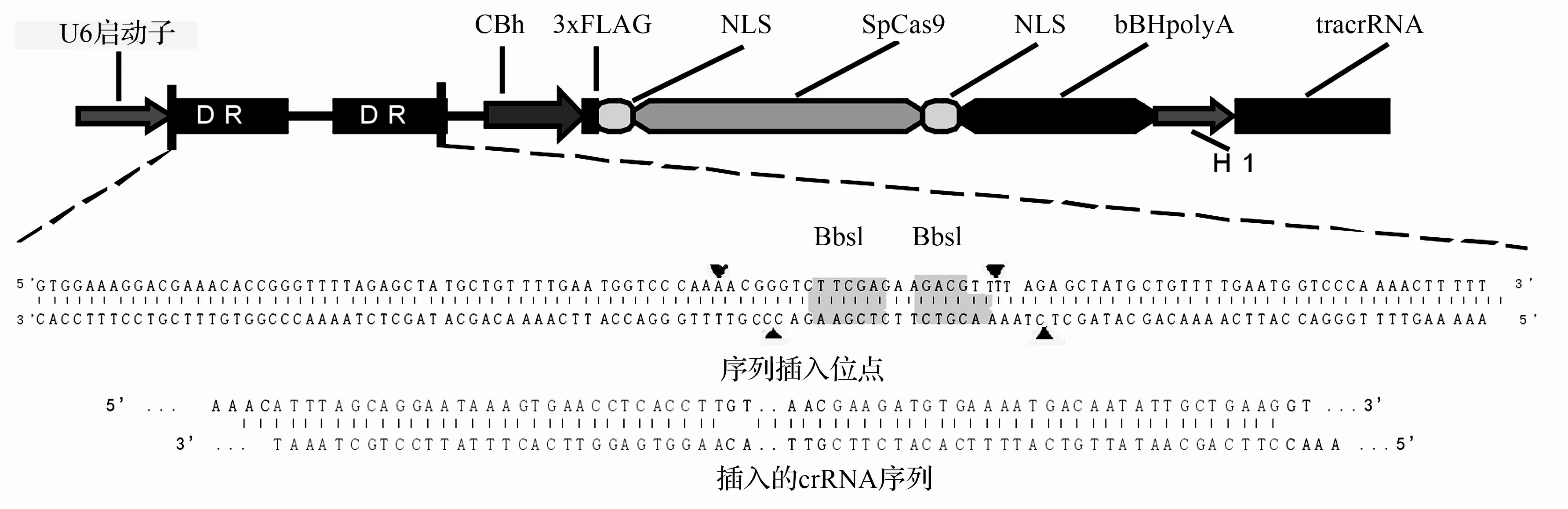
图2 CRISPR/Cas系统miR-17-92基因簇双切载体的构建
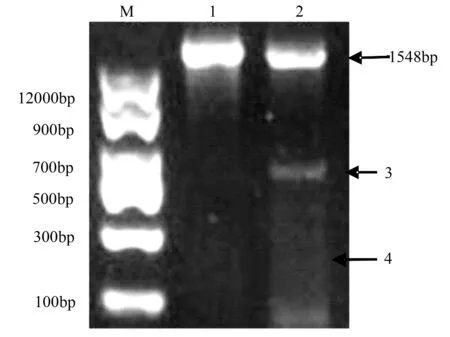
1.对照组;2.试验组;3.切割后修复条带;4.空白;M.star markerⅡ。
2.3.2 灰度分析切割效率
表1显示上述PCR条带灰度分析结果。通过Image J软件进行灰度分析,根据公式,突变产物剪切条带灰度值/(突变产物剪切条带灰度值+未突变条带灰度值),可以初步判断切割效率[9-10]。结果显示:所构建的CRISPR/Cas9系统对miR-17-92基因簇切割效率为7.04%左右(切割效率分析(3-4)/(2+3-4)=(57.358-48.966)/(110.787+57.358-48.966)=7.04%)。
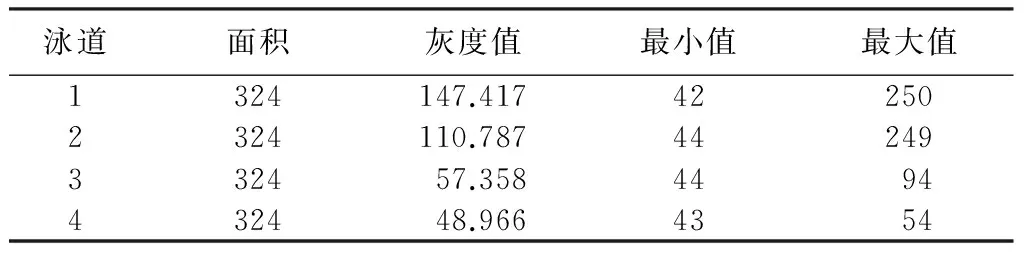
表1 PCR条带灰度分析切割效率
注:1为对照;2为未被切割的片段;3为切割后修复片段;4为空白对照。
2.3.3 测序分析
将上述PCR结果送到生物公司进行测序,分别利用DNAMAN软件和NCBI blast进行分析,结果显示:利用构建的CRISPR/Cas系统miR-17-92基因簇双切载体质粒转染小鼠NIH3T3细胞后,miR-17-92基因的确被有效切割,切割长度约为948 bp左右,与理论值相符(图4和图5)。

图4 DNAMAN分析结果
3 结论与讨论
microRNAs(miRNAs)是高度保守的一种非编码小RNA,通过抑制靶基因mRNA的翻译或将其降解,在转录后水平调控基因的表达。Bartel D P等[4]发现这些miRNAs在基因组上成簇存在,以多顺反子形式转录。参与调控哺乳动物器官发育以及疾病的发生,因此受到了广泛关注。其中miR-17-92基因簇的序列十分保守,位于人类基因组第13号染色体上C13orf25基因初级转录本的第3个内含子区,在小鼠基因组中位于第14号染色体上[11],编码miR-17-5p、miR-17-3p、miR-18a、miR-19a、miR-20a、miR-19b-1和miR-92-1等7个miRNAs。研究显示,miR-17-92基因簇与多种肿瘤的发生密切相关,可能具有癌基因和抑癌基因双重功能,因此通过基因编辑等技术对miR-17-92基因簇作用机制进行深入研究十分必要。

图5 NCBI blast分析结果
(CRISPR)/CRISPR-associated(Cas9)基因组编辑技术,是一种新型打靶技术,基本可以在任意基因位点进行有效断裂,且具有可以同时对多个基因进行打靶的优势。2013年初,有研究首次报道了利用CRISPR/Cas9系统对人293T细胞的EMX1和PVALB基因以及小鼠Nero2A细胞的Th基因实现了定点突变[8]。同一期的Science杂志也发表了另一篇文章,通过利用CRISPR/Cas9在人293T细胞和K652细胞基因的靶位点形成单链或双链的切口,从而能够激活细胞的DNA修复机制,高效地介导外源基因的定点插入[12]。2014年有研究结果显示,在小鼠中,使用特异性的gRNAs,可以单酶切miRNA,使得在小鼠细胞中miRNA的水平被敲低[13]。
以往研究结果显示,所构建的CRISPR/Cas9载体系统只有一个crRNA,Cas9蛋白只对一个位点进行切割,容易造成移码突变,且不能将感兴趣的整个基因座全部切下。如果设计两个CRISPR/Cas9系统时,又会明显降低敲除效率[12],影响试验结果。因此,为了解决上述问题,本试验设计了CRISPR/Cas9双切miR-17-92基因簇载体系统,即在一个载体上虽然只有一个crRNA,但是能识别两个切割位点,实现同时切割两个不同靶位点的功能。
本试验首先通过分析miR-17-92基因簇的序列,找到两个PAM(TGG和GGG)位点,从而得到了两个原间隔序列,将其合并设计合成一段pre-crRNA序列,该序列能识别两个Cas9切割位点,避免了同时设计两段crRNA所造成的切割效率降低问题。随后利用限制性内切酶BbsI,对pX260载体进行酶切,将上述合成的pre-crRNA片段插入到BbsI酶切位点之间,克隆后得到CRISPR/Cas9系统miR-17-92基因簇双切载体质粒。本试验利用的pX260载体与以往实验有所不同,拥有3个表达盒,即crRNA与tracrRNA两个表达盒能分开表达,而常规pX330载体具有两者合并为一个gRNA的表达盒[1]。基因敲除时crRNA与tracrRNA两个表达盒分开表达效率高于单一的gRNA表达盒,因此,实验设计crRNA与tracrRNA分开的两个表达盒,以提高miR-17-92基因簇的切割效率[8]。
最后将该载体质粒转染NIH3T3细胞,分别通过PCR法和测序分析方法鉴定载体构建情况(图4,5,6),测序结果显示:所构建的CRISPR/Cas9双切miR-17-92基因簇载体能够切割基因组长度约900bp左右,与设计结果相符,没有发生移码突变。参考其他文献结果通过Image J软件对PCR条带进行灰度分析,初步检测切割效率约为7.04%,虽然切割效率不是很高,但实现了通过载体上的一个crRNA,Cas9可以识别两个切割位点,从而将感兴趣的基因座上序列全部切割的结果,简化了设计和操作步骤,并降低了点突变所产生的脱靶率和移码突变的可能性。
综上所述,本文利用CRISPR/Cas9系统介导的基因打靶技术,具有同时对多个基因进行打靶的优势,能快速简单的敲除基因簇。而且我们设计的CRISPR/Cas9系统是一个双切载体,在同一个载体上利用一个cr-RNA,实现同时切割两个不同靶位点的效果,提高了突变效率,减少了移码突变。由于miR-17-92基因簇与哺乳动物多个器官发育和肿瘤发生有着密切的关系,如果将该双切载体应用在小鼠,哺乳动物甚至人类上,那么就可以快速了解miR-17-92基因簇功能,为进一步阐明其在器官发育和肿瘤发生发展中的分子机制,以及相关疾病预防,诊断和治疗奠定基础。
[1] CONG L, RAN F A, COX D, et al. Multiplex genome engineering using CRISPR/Cas systems[J]. Methods in Molecular Biology,2015,339:197-217.
[2] SVOBODA P, STEIN P. RNAi experiments in mouse oocytes and early embryos[J]. Cold Spring Harbor Protocols,2009,4(1):1-9.
[3] RAN F A, HSU P D, WRIGHT J, et al. Genome engineering using the CRISPR-Cas9 system[J]. Nat Protoc,2013,8(11):2281-2308.
[4] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell,2004,116(2):281-297.
[5] ASANGANI I A, RASHEED S A, NIKOLOVA D A, et al, MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J]. Oncogene,2008,27(15):2128-2136.
[6] ZHOU M, CAI J, TANG Y, et al, MiR-17-92 cluster is a novel regulatory gene of cardiac ischemic/reperfusion injury[J]. Med Hypotheses,2013,81(1):108-110.
[7] GRILLARI J, HACKL M, GRILLARI-VOGLAUER R. miR-17-92 cluster: ups and downs in cancer and aging[J]. Biogerontology,2010,11(4):501-506.
[8] OHNO M, OHKURI T, KOSAKA A, et al. Expression of miR-17-92 enhances anti-tumor activity of T-cells transduced with the anti-EGFRvIII chimeric antigen receptor in mice bearing human GBM xenografts[J]. J Immunother Cancer,2013,1(1):1-12.
[9] 左其生,王颖洁,赵瑞丰,等.CRISPR/Cas技术可有效介导家鸡基因敲除[J].畜牧兽医学报,2016,47(6):1266-1271.
[10] 俞珺瑶,李晓兰,张健萍,等.Cas9-sgRNA共质粒系统提高在AAVS1位点的打靶效率[J]. 生物技术通讯,2015,26(4):449-453.
[11] HE L, THOMSON J M, HEMANN M T, et al. A microRNA polycistron as a potential human oncogene[J]. Nature,2005,435:828-833.
[12] HAURWITZ R E, JINEK M, WIEDENHEFT B, et al. Sequence-and structure-specific RNA processing by a CRISPR endonuclease[J]. Science,2010,329:1355-1358.
[13] ZHAO Y, DAI Z, LIANG Y, et al. Sequence-specific inhibition of microRNA via CRISPR/CRISPRi system[J]. Sci Rep,2014,4(5):3943-3948.
Double-cut Carrier in ConstructingmiR-17-92 Gene Cluster by CRISPR/Cas9 System//
Jin Shuhan, Du Liping, Zhou Xiaoxiao, Yu Ze, LiangYang(Northeast Forestry University, Harbin 150040, China)//
Journal of Northeast Forestry University,2017,45(2):17-21.
CRISPR/Cas9 system;miR-17-92 gene cluster; Double-cut carrier; crRNA
1)中央高校基本科研业务费项目(2572016EAJ3);淡水鱼育种国家地方联合工程实验室开放课题(KF-2015-003);东北林业大学生命科学学院大学生创新训练项目。
金姝含,女,1994年2月,东北林业大学生命科学学院,本科生。E-mail:jinshuhan123@163.com。
梁洋,东北林业大学生命科学学院,高级工程师。E-mail:liang11yang@126.com。
2016年7月13日。
Q291
责任编辑:潘 华。

