低温贮藏条件下阿勒泰羊尾的脂肪氧化
李钰++刘成江++李应彪

摘 要:以阿勒泰羊尾脂肪为研究对象,研究其在(4±1) ℃条件下贮藏脂肪的动态变化趋势。结果表明:贮藏期0~25 d为阿勒泰羊尾脂肪的氧化初期,在此期间,pH值呈现持续性下降的趋势(P<0.05),过氧化值在阿勒泰羊尾脂肪贮藏第25天出现最大值随后呈现逐渐下降的趋势(P<0.05);硫代巴比妥酸反应物值在贮藏期间,呈现非常显著的递增趋势(P<0.05);饱和脂肪酸含量由43.6%提高至56.3%,单不饱和脂肪酸和多不饱和脂肪酸分别由2.4%和51.2%下降至2.1%和43.7%;此外,功能性脂肪酸除了共轭亚油酸(C18:2n-9)之外,其他均在贮藏期第20天后下降显著(P<0.05)。
关键词:阿勒泰羊尾脂;氧化诱导期;脂肪酸;氧化
Changes in Lipid Oxidation and Fatty Acids in Altay Sheep Tail Fat during Low Temperature Storage
LI Yu1, LIU Chengjiang1,*, LI Yingbiao2,*
(1. Key Laboratory of Agro-Products Processing (Shihezi), Institute of Agro-Products Processing Science and Technology, Xinjiang Academy of Agricultural and Reclamation Science, Shihezi 832000, China; 2.Food College, Shihezi University, Shihezi 832000, China)
Abstract: Changes in lipid profiles of Altay sheep tail fat during 50 days of refrigerated storage at 4 ℃ were investigated. We found that lipid oxidation and lipolysis occurred during the first 25 days of storage. The pH continuously decreased during this period (P < 0.05). Lipid oxidation was determined by peroxide value (POV) and thiobarbituric acid-reactive substances (TBARs). The POV value increased to a peak on the 25th day of storage followed by a gradual decline (P < 0.05). The TBARs value significantly increased throughout the entire storage period (P < 0.05). GC-MS analysis demonstrated that the content of saturated fatty acids increased from 43.6% to 56.3% and polyunsaturated fatty acids and monounsaturated fatty acids decreased form 51.2% to 43.7% and from 2.4% to 2.1%, respectively. The content of the functional fatty acids except (C18:2n-9) started to decrease after 20 days of storage. These changes indicated that lipid oxidation occurred in Altay sheep tail fat during a long period of low temperature storage.
Key words: Altay sheep tail fat; oxidation induction time; fatty acids; oxidation
DOI:10.7506/rlyj1001-8123-201703004
中圖分类号:TS251.9 文献标志码:A 文章编号:1001-8123(2017)03-0018-05
引文格式:
李钰, 刘成江, 李应彪. 低温贮藏条件下的阿勒泰羊尾脂肪氧化研究[J]. 肉类研究, 2017, 31(3): 18-22. DOI:10.7506/rlyj1001-8123-201703004. http://www.rlyj.pub
LI Yu, LIU Chengjiang, LI Yingbiao. Changes in lipid oxidation and fatty acids in altay sheep tail fat during low temperature storage[J]. Meat Research, 2017, 31(3): 18-22. DOI:10.7506/rlyj1001-8123-201703004. http://www.rlyj.pub
阿勒泰羊(Altay sheep),俗称肥尾羊,其以体格健壮、耐寒、肉质好、尾部脂肪而著称[1],成年羊体质量最高可达120 kg,其尾脂、肚脂占胴体质量的20%以上,是新疆地区肉脂兼用的优良地方品种[2-3]。2013年,阿勒泰羊等3 个地方特产正式通过国家审批,成为新疆维吾尔自治区新的地理标志产品。由于贮存加工技术落后,使得羊脂大量积压,许多羊脂在未被利用的情况下就已经氧化变质,这直接导致地方经济和养殖户蒙受了巨大损失。课题组前期研究已经证实[4-6],阿勒泰羊脂肪含有数量可观的不饱和脂肪酸(如亚油酸、亚麻酸等),因此具有较高的营养价值。已有大量研究报道,n-3多不饱和脂肪酸(unsaturated fatty acid,PUFA)(n-3 PUFA)等具有生理活性的功能性脂肪酸,对于稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、抗心血管疾病、促进生长发育等方面具有十分重要的作用[7-11]。
由于这些脂肪酸不饱和程度相对较高,容易氧化变质造成营养损失,甚至转变为对身体有害的物质。脂类的自动氧化是自由基的连锁反应,其酸败过程可以分为诱导期、传播期、终止期和二次产物形成期4 个阶段。其中,氧化诱导期的启动对氧化的程度和速率起着至关重要的作用。基于此,本研究以阿勒泰羊尾脂肪作为研究对象,采用过氧化值(peroxide value,POV)、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)作为氧化指标,通过油脂的自动氧化研究脂肪氧化及脂肪酸在此期间的动态变化,根据自然规律阐述氧化的机理,结论可为阿勒泰羊尾脂肪贮藏和产业开发提供科学依据。
1 材料与方法
1.1 材料与试剂
37 种常规脂肪酸甲酯(fatty acid methyl ester,FAME)标准品(纯度≥99%)、三氟化硼-甲醇 美国Sigma公司。
甲醇、氯仿、三氯乙酸、冰乙酸、正己烷(色谱纯) 天津市福晨化学试剂厂;乙二胺四乙酸、碘化钾、硫代硫酸钠、淀粉、硫代巴比妥酸 天津市巴斯夫化工有限
公司;氢氧化钠(分析纯);有机相过滤膜0.22 μm。
1.2 仪器与设备
Agilent 7890A气相色谱-5975C质谱仪、HP-5毛细管色谱柱(60 m×250 μm,250μm) 美国安捷伦公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 样品的准备及预处理
供试阿勒泰羊尾脂样品随机采于石河子肉羊良种繁育基地20 只健康状况良好,1~5 岁阿勒泰肥尾羊。将所有供试脂肪均匀混合,称取2 500 g脂肪,经冷冻均质搅拌分成薄厚相同的25 份(每份100 g),将每份(含量100 g)置于恒温恒湿箱内(4±1) ℃贮藏50 d。贮藏期间每2 d测定1 次各项指标。每项指标均测定3 次,取平均值。
1.3.2 pH值的测定
取10 g样品,剪碎,分别装入三角瓶中,倒入100 mL蒸馏水,浸泡20 min后过滤,用玻璃棒每隔10 min搅拌,使得脂肪浸泡更加充分均匀。取滤液用酸度计测定pH值。分别平行测定3 次。
1.3.3 硫代巴比妥酸反应物(TBARs)测定
TBARs测定方法参照Racanicci等[12]方法进行测定,称取5 g脂肪,倒入25 mL三氯乙酸溶液,混匀,放入摇床,振摇40 min,取出过滤。取滤液5 mL放入具塞比色皿中,加入5 mL 0.02 mol/L硫代巴比妥酸,混匀,放入90 ℃水浴锅加热40 min后,取出冷却,4 000 r/min离心25 min,加入5 mL氯仿溶液,混匀,静置分层,取上清液待测。
1.3.4 过氧化值(POV)的测定
POV测定方法参照文献[13]进行测定,称取2 g脂肪,加入的氯仿-冰乙酸混合液(2∶3,V/V)30 mL,使油脂全部溶解,加入1 mL的饱和碘化钾溶液,振摇使之混匀,置于暗处5 min后,取出加入30 mL蒸馏水,振摇混匀。(若颜色浅,直接加指示剂)立刻用0.002 mol/L的硫代硫酸钠溶液滴定,滴定至淡黄色加入1 mL淀粉指示剂。滴定终点,蓝色消失。以相同的饱和碘化钾,氯仿-冰乙酸混合液,水做空白实验,记录下体积。按照下式计算POV值。
式中:V1为消耗的硫代硫酸钠体积/mL;V2为空白消耗硫代硫酸钠体积/mL;c为硫代硫酸钠浓度/(mol/L);
m为油脂质量/g。
1.3.5 脂肪酸甲酯化及测定
称取500 mg脂肪,放入三角瓶內,连接冷凝管,加入5 mL 0.5 mol/L氢氧化钠-甲醇溶液,70 ℃条件下回流5 min,进行脂肪的皂化。再加入5 mL的体积分数为12%~15%三氟化硼-甲醇溶液5 mL,70 ℃条件下回流5 min,进行脂肪的甲酯化。加入3 mL正己烷,70 ℃条件下回流5 min后,加入5 mL饱和NaCl溶液,振摇15 s,静置10 min,吸出上清液于小瓶中,-20 ℃待测。
气相色谱(gas chromatography,GC)条件:分流进样;进样量1 μL。进样口温度230 ℃;检测温度270 ℃。程序升温起始温度50 ℃,保持5 min,以10 ℃/min升至170 ℃,保持20 min,再以5 ℃/min升温至270 ℃,保持5 min。总运行时间为47 min;载气为氦气;载气流速1 mL/min。
质谱(mass spectrometry,MS)条件:电子轰击离子源(electron impact ion source,EI);全扫描方式;电子能量70 eV;四极杆扫描范围(m/z):35~780。
1.4 数据处理
油脂的各项指标平均测定3 次。采用Origin 8.0和SPSS 18.0软件包进行数据分析。测定结果以平均值±
标准差表示。实验数据采用方差分析(analysis of variance,AVOVA)进行邓肯氏(Duncans)差异分析,以P<0.05为差异显著。
2 结果与分析
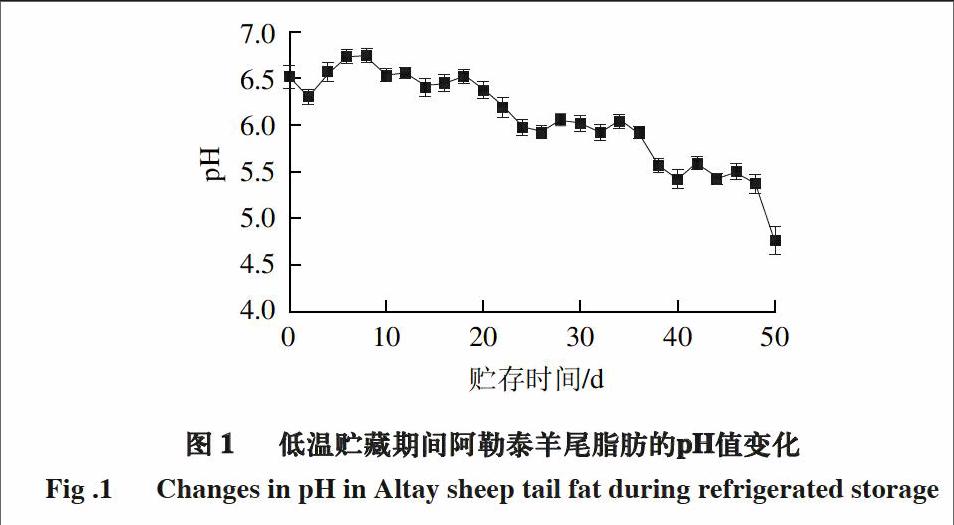
2.1 低温贮藏期间阿勒泰羊尾脂的pH值变化
图 1 低温贮藏期间阿勒泰羊尾脂肪的pH值变化
Fig .1 Changes in pH in Altay sheep tail fat during refrigerated storage
由图1可知,在整个贮藏期间,阿勒泰羊尾脂肪pH值呈现一个持续性下降的趋势。在起初的2 d有明显回落的趋势(P<0.05),随后4~10 d递增(P<0.05)。在贮藏12~20 d,pH值保持平稳的变化(P>0.05)。贮藏第24天直至贮藏结束,pH值持续性下降(P<0.05)。起初小的回落的原因是因为受到应激性和肌肉损伤影响,乳酸和肌肉中的肌糖原被释放到血液中,使得pH值下降[14]。同样,也有报道Sen[15]、Madruga[16]等发现不同部位的脂肪有不同的pH值,并且研究发现,屠宰后不同的年龄阶段对山羊肌肉pH值有着很显著的影响,Lepper-Blilie[17]、Simela[18]等报道发现屠宰后的成熟时间、动物的年龄和性别都对pH值有影响。pH值在稳定一段时间之后,由于微生物的侵染、贮藏时间的延长和其他一些外部贮藏条件的影响,致使脂肪开始脂解,并且引起脂质的氧化变质,直到贮藏期结束时,pH值从6.52下降到4.76。这些变化和Nakyinsige等[19]的报道有相同之处,在低温贮藏期内,pH值随着贮藏时间的增加而逐渐下降。在低温((4±1) ℃)贮藏50 d内pH值的变化表明,阿勒泰羊尾脂肪在贮藏期内稳定性受到破坏,贮藏时间的延长和氧化速率直接导致了pH值的下降,诱导脂肪发生氧化分解等现象,如影响脂肪的嫩度、多汁性、颜色和气味等。
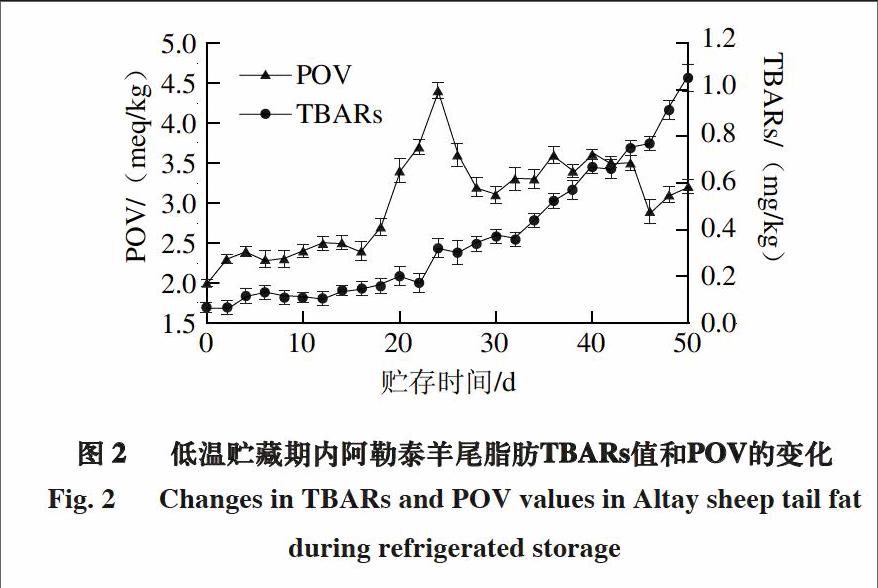
2.2 低温贮藏期间阿勒泰羊尾脂肪POV、TBARs的变化及氧化诱导期的确定
由图2可知,阿勒泰羊尾脂肪POV在(4±1) ℃温度下贮藏0~25 d总体呈上升趋势(P<0.05),在25~30 d有明显回落的趋势(P<0.05),在30~40 d之内过氧化值没有明显变化(P>0.05),直到贮藏40~46 d,POV再次出现明显的下降趋势(P<0.05)。过氧化值在贮藏的25 d之内持续性增加象征着脂肪氧化的初级阶段,相对于2~12 d的平缓变化,14~25 d内POV快速增加,结果表明,在阿勒泰羊尾脂肪在贮藏前25 d呈现出一个相对稳定的趋势。在贮藏期间,POV随着贮藏时间的延长而有缓慢的回落趋势,推测可能是由于氢过氧化物的不稳定性,引起化合物的分解形成脂质的二级次级代谢产物,导致过氧化值的下降[20]。阿勒泰羊尾脂肪在低温贮藏内发生脂质氧化可能是由于脂肪的含量较高以及促氧化剂较丰富,与Shiba[21]、Chaijan[22]等相关研究符合一致,在低温贮藏拉丁鱼的过程中,在贮藏第9天时,POV出现了最大峰,并且随着贮藏时间的增加,POV逐渐递减直至贮藏第15天结束。
图 2 低温贮藏期内阿勒泰羊尾脂肪TBARs值和POV的变化
Fig. 2 Changes in TBARs and POV values in Altay sheep tail fat during refrigerated storage
阿勒泰羊尾脂肪TBARs值在整个贮藏期间一直呈现出递增的趋势(P<0.05),初始测定的TBARs值为0.07 mg/kg,表明脂质氧化在一开始就存在。TBARs值在贮藏0~12 d内,变化幅度轻微,在14~22 d,增加的幅度较平缓(P>0.05),比0~12 d内TBARs的增加相对高一些。随后TBARs值在第24天顯著增加并且持续增大直到贮藏期结束(P<0.05)。脂肪是长时间贮藏过程中自动氧化的主要原因,TBARs值的增加表明脂质氧化的次级代谢产物引起了风味恶化[23]。TBARs值在贮藏24~50 d时显著增加与POV的减少有密切的联系,这可能是由于氢过氧化物分解产生次级代谢产物和一些有毒有害的物质。在最近的研究报道中,Nakyinsige等[19]发现兔子的肌肉在4 ℃条件下贮藏7 d,TBARs值持续增加。同样,Soyer等[24]指出,鸡腿和鸡胸肉在贮藏6 个月,TBARs值随贮藏周期的延长而增加。这些研究结果表明,随着贮藏时间的增加,加速了脂质的氧化。由于阿勒泰羊尾中含有大量的脂肪物质,更容易发生氧化,腐败变质,受到微生物的侵染[25-26]。
图2显示出POV和TBARs值在同一个时期的不同变化,不难发现两者之间的一些相关性。与POV相一致,TBARs值在贮藏0~16 d内,增加幅度轻微,随后TBARs值显著持续增加直到贮藏期结束,这与POV值在贮藏第25天达到最大值有高度相关性。结合两者的变化,可以确定阿勒泰羊尾脂肪在低温贮藏50 d内,前25 d为脂质的氧化初期阶段。POV在第25天之后开始下降,与TBARs值持续性增长具有一致性,这是由于氢过氧化物分解的速率大于生成的速率,并且分解产生大量的次级代谢产物及有毒有害的物质,导致TBARs值持续增加。
2.3 低温贮藏期间阿勒泰羊尾脂肪中脂肪酸的含量变化
由表1可知,阿勒泰羊尾脂肪中含有饱和脂肪酸(SFA)43.64%、单不饱和脂肪酸(MUFA)51.20%、多不饱和脂肪酸(PUFA)2.44%。其中,棕榈酸(C16:0)(18.35%)和硬脂酸(C18:0)(21.11%)为主要的饱和脂肪酸;C18:1(49.08%)为主要的单不饱和脂肪酸;在多不饱和脂肪酸中C18:2含量最高(2.19%),其次是C18:3,含量为0.25%。与Brasil等[27]的报道的相一致,棕榈酸(C16:0)和硬脂酸(C18:0)是羊体里含量最高的饱和脂肪酸;C18:1和C16:1为羊体内主要的单不饱和脂肪酸。Santercole等[28]还发现了山羊肉中同样含有小部分的C18:3。结果表明,阿勒泰羊尾脂肪均含有对应高含量的不饱和脂肪酸和饱和脂肪酸,其中不饱和脂肪酸的含量高达53.64%,在脂肪氧化中扮演了一个非常重要的角色。经过(4±1) ℃贮藏50 d之后,饱和脂肪酸的含量增加了12.67%,单不饱和脂肪酸和多不饱和脂肪酸的含量分别减少了7.48%和0.27%。多不饱和脂肪酸中的C18:3含量显著减少是由于其结构的不稳定性,易受到外界条件的影响,双键及三键容易断裂,极易被氧化;与C18:3相比,C18:2在贮藏期间含量保持相对稳定,几乎没有变化,与Brasil[27]、Zhang[29]等的结论相一致。
2.4 相关性分析
POV与TBARs值是阿勒泰羊尾脂肪在4 ℃贮藏条件下主要测定的氧化指标值。由表2可知,TBARs与C16:1与C18:3的相关系数分别高达-0.971和-0.983;随着氧化指标的升高,单不饱和脂肪酸以及多不饱和脂肪酸的含量逐渐递减,其中C16:1和C18:3的含量变化最为明显。当POV和TBARs值增大时,C16:0、C18:0呈现正相关的趋势,相关系数分别高达0.933和0.970;随着氧化指标的升高,饱和脂肪酸的含量呈递增趋势。C18:2含量变化并没有与氧化指标表现出明显的相关性,但是在整个贮藏期间含量也更易于发生变化。
3 结 论
阿勒泰羊尾脂肪在(4±1) ℃条件下贮藏50 d内,氧化速率和程度逐日增加。结果表明,以POV和TBARs值2 种氧化指标评价阿勒泰羊尾脂肪在贮藏期内的氧化情况,确定了阿勒泰羊尾脂肪的氧化诱导期为(4±1) ℃条件下贮藏前25 d,POV值总体呈现上升趋势,在贮藏第25天达到最大值;TBARs值在0~20 d内保持相对稳定的增长,由此确定了前25 d是羊脂发生氧化的初级阶段。
在羊尾脂肪貯藏的过程中,pH值呈现持续性下降的趋势;POV在贮藏25 d时出现最大值并且直到贮藏期结束呈现逐渐下降的趋势;TBARs值在贮藏期间直至贮藏末期,呈现非常显著的递增趋势。
油酸(C18:1)、亚油酸(C18:3)、亚麻酸(C18:3)、棕榈酸(C16:0)、棕榈油酸(C16:1)、硬脂酸(C18:0)是阿勒泰羊尾脂肪中的主要脂肪酸。在贮藏过程中,饱和脂肪酸的含量显著上升12.67%,同时,单不饱和脂肪酸和多不饱和脂肪酸含量显著下降7.48%和0.27%。
氧化指标与饱和脂肪酸呈正相关,随着POV和TBARs值的变化增加,饱和脂肪酸的含量逐渐递进;氧化指标与不饱和脂肪酸呈负相关,相关系数分别为
-0.971和-0.983,随着氧化指标的升高,单不饱和脂肪酸以及多不饱和脂肪酸的含量逐渐递减,其中C16:1和C18:3的含量变化最为明显。
参考文献:
[1] 马桢, 郝耿, 杨会国, 等. 阿勒泰羊品种资源现状及发展思路[J]. 草食家畜, 2012, 2(1): 10-12.
[2] 陶卫东, 郑文新, 高维明, 等. 阿勒泰羊肥羔生产产业化技术措施及市场前景分析[J]. 新疆畜牧业, 2007, 2(2): 7-8.
[3] 夏江涛, 杨润. 建立阿勒泰羊保种库的初步设想[J]. 养殖技术顾问, 2013, 4(2): 250-251.
[4] 刘成江, 吴宏, 郭安民, 等. 我国羊脂综合利用的研究现状[J]. 肉类工业, 2010, 8(7): 51-52.
[5] 刘成江, 王俊钢, 李宇辉, 等. 阿勒泰脂臀羊脂肪酸组成及其挥发性风味物质构成初探[J]. 肉类工业, 2012, 4(3): 16-18.
[6] 刘成江, 吴洪斌, 王俊钢, 等. 新疆肥尾羊脂肪特性研究[J]. 食品科学, 2012, 33(6): 159-161.
[7] KOVACIC P, POZOS R S, SOMANATHAN R, et al. Mechanism of mitochondrial uncouples inhibitors, and toxins: focus on electron transfer, free radicals, and structure activity relationships[J]. Current Medicinal Chemistry, 2005, 12(5): 2601-2623. DOI:10.2174/092986705774370646.
[8] SCHIRMER M A, PHINNEY S D. Gamma-linolenate reduces weight regain in formerly obese humans[J]. Journal of Nutrition, 2007, 137(6): 1430-1435.
[9] BAKSHI A, MUKHERJEE D, BAKSHI A. Gammalinolenic acid therapy of human gliomas[J]. Nutrition, 2003, 19(4): 305-309. DOI:10.1016/S0899-9007(02)00862-6.
[10] NAKANSHI T, OIKAWA D, KOUTOKU T, et al. γ-linolenic acids prevents conjugated linoleic acid-induced fatty liver in mice[J]. Nutrition, 2004, 20(5): 390-393. DOI:10.1016/j.nut.2003.12.014.
[11] NAWAR W W. Lipids[M]// FENNEMA O R. Food chemistry. New York: Plenum Press, 2006: 275-276.
[12] RACANICCI A M C, DANIELSEN B, SKIBSTED L H. Mate (Ilex paraguariensis) as a source of water extractable antioxidant for use in chicken meat[J]. European Food Research and Technology, 2007, 227(25): 255-260. DOI:10.1007/s00217-007-0718-5.
[13] ?I?EK ?, POLAT N. Investigation of physicochemical and sensorial quality of a type of traditional meat product: Bez sucuk[J]. LWT-Food Science and Technology, 2016, 65(3): 145-151. DOI:10.1016/j.lwt.2015.07.049.
[14] KANNAN B, TERRILL K, GELAYE S. Endocrine, blood metabolite, and meat quality changes in goats as influenced by short-term, preslaughter stress[J]. Journal of Animal Science, 2003, 81(6): 1499-1507.
[15] SEN U, SIRIN E, UILTAS Z, et al. Fattening performance, slaughter, carcass and meat quality traits of Karayaka lambs[J]. Tropical Animal Health and Production, 2011, 43(5): 409-416. DOI:10.1007/s11250-010-9707-y.
[16] MADRUGA S, NASCIMENTO J. Castration and slaughter age effects on nutritive value of the mestico goat meat[J]. Meat Science, 1999, 52(2): 119-125.
[17] LEPPER-BLILIE A, BUCHANAN P, BERG T. Effects of post-mortem aging time and type of aging onpalatability of low marbled beef loins[J]. Meat Science, 2014, 96(1): 473-474. DOI:10.1016/j.meatsci.2015.10.017.
[18] SIMELA L. Effect of sex, age, and pre-slaughter conditioning on pH, temperature, tenderness and colour of indigenous South African goats[J]. South African Journal of Animal Science, 2004, 34(1): 208-211.
[19] NAKYINSIGE K, SAZILI A, AGHWAN Z, et al. Development of microbial spoilage and lipid and protein oxidation in rabbit meat[J]. Meat Science, 2015, 108(7): 125-131. DOI:10.1016/j.meatsci.2015.05.029.
[20] ROBLES M, BURGUENO R. Postmortem biochemical and functional characteristic of monterey sardine muscle stored at 0 ℃[J]. Journal of Food Science, 2000, 65(15): 111-115. DOI:10.1111/j.1365-2621.2000.tb15953.x.
[21] SHIBA N, MATSUZAKI M. Effects of pre-slaughter nutritional condition on intramuscular collagen solubility, pyridinoline cross-links and meat tenderness in aged goats[J]. Animal Science Journal, 2004, 23(12): 78-81.
[22] CHAIJAN M, BENJAKUL S, VISESSANGUAN W, et al. Changes of lipids in sardine (Sardinella gibbosa) muscle during iced storage[J]. Food Chemistry, 2006, 99(12): 83-91. DOI:10.1016/j.foodchem.2005.07.022.
[23] KHAN M, TARIQ M. Meat flavor precursors and factors influencing flavor precursors: a systematic review[J]. Meat Science, 2015, 110(25): 278-284. DOI:10.1016/j.meatsci.2015.08.002.
[24] SOYER A, ?ZALP B, DALMI? ?, et al. Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J]. Food Chemistry, 2010, 120(56): 1025-1030. DOI:10.1016/j.foodchem.2009.11.042.
[25] SOHN J, OHSHIMA T. Control of lipid oxidation and meat color deterioration in skipjack tuna muscle during ice storage[J]. Fisheries Science, 2010, 76(23): 703-710. DOI:10.1007/s12562-010-0248-0.
[26] CASABURI A, PIOMBINO P, NUCHAS G, et al. Bacterial populations and the volatilome associated to meat spoilage[J]. Food Microbiology, 2015, 45(19): 83-102. DOI:10.1016/j.fm.2014.02.002.
[27] BRASIL L, QUEIROZ A, SILVA J, et al. Microbiological and nutritional quality of the goat meat by-product “Sarapatel”[J]. Molecules, 2014, 19(8): 1047-1059. DOI:10.3390/molecules19011047.
[28] SANTERCOLE V, MAZZETTE R, de SANTIS E B, et al. Total lipids of Sarda sheep meat that include the fatty acid and alkenyl composition and the CLA and trans-18:1 isomers[J]. Lipids, 2007, 42(11): 361-382. DOI:10.1007/s11745-006-3003-7.
[29] ZHANG H, WANG Q, FAN E. Stability profile of fatty acids in yak (Bos grunniens) kidney fat during the initial stages of autoxidation[J]. Journal of the American Oil Chemists Society, 2009, 86(17): 1057-1063. DOI:10.1007/s11746-009-1440-1.

