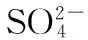高考化学模拟试题(一)
吉林 赵鑫光
(作者单位:吉林长春吉大附中实验学校)
高考化学模拟试题(一)

可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Mn—55 Fe—56 Cu—63.5
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.化学在日常生活中有着广泛的应用,下列实际应用与化学原理对应关系不正确的是

( )
2.用NA表示阿伏加德罗常数的值,下列说法正确的是
( )
B.在含1 mol H2SO4的浓硫酸中加入足量锌粉,充分反应后转移的电子数目介于NA到2NA之间
C.1 mol NaHSO4在熔融状态下的离子总数为3NA
D.电解精炼铜时,当电路中通过NA个电子时,阳极减少的质量和阴极增加的质量相等
3.香花石是我国科学家首次发现的一种由前二十号元素中的六种组成的矿石,A2B3(CDE4)3F2,其中A、B、C为金属元素,C的最外层电子数等于电子总数的二倍,B、C同主族,A、C、E、F位于同周期,E的最外层电子数是次外层电子数的三倍,F的氢化物是一种弱酸,D的质子数是B与E的质子数的代数平均值则下列说法错误的是
( )
A.原子半径:F B.元素的非金属性:F>E>D C.BE2和DE2中E的化合价相同 D.B、C的氧化物对应的水化物的碱性为B>C 4.某有芳香烃中C的质量分数为90.57%,其分子中烷基碳上二氯取代所得同分异构体有三种,则该有机物苯环上的一氯取代物的同分异构体的种数为(不考虑立体异构) ( ) A.1___________B.2___________C.3___________D.4 下列叙述正确的是 ( ) A.若A区是溶液为1 L,当电路中通过0.1 mol电子时,A区溶液的pH为1 B.用这种方法处理废液可得到等浓度的NaOH和H2SO4产品(设A区和C区的体积相同) C.电解完毕后若将ab、cd隔膜去掉,废水中Na2SO4的浓度将增大 D.ab和cd为同种离子选择性透过膜 6.有浓度均为0.1 mol/L的三种溶液各10 mL,下列说法正确的是 ( ) ①CH3COOK溶液;②KOH溶液;③CH3COOH溶液 A.若将①③混合,则c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) B.三种溶液中水电离出的c(OH-)大小顺序为①>②>③ C.若将②③混合,酸碱恰好中和,溶液呈中性 D.若将①②混合,混合液中c(K+)=0.2 mol/L 7.下列有关实验的描述正确的是 ( ) A.向沸水中滴加几滴饱和CuSO4溶液可以制得 Cu(OH)2胶体 B.将无水醋酸钠、乙醇和浓硫酸混合加热可以制得乙酸乙酯 C.使用裂化汽油可以从溴水中萃取得到溴单质 D.将MgCl2溶液在蒸发皿中加热蒸干可以得到无水MgCl2固体 二、必考题:本题共3小题,共43分。 8.(14分)CO2是一种温室气体,如何处理、利用CO2是当前重点研究的课题。 (2)CO2可以用Li4SiO4进行富集,其原理是在500℃下,Li4SiO4与低浓度CO2接触后生成两种常见的锂盐,加热至700℃,反应向相反方向进行,放出高浓度CO2,Li4SiO4再生。后一过程的化学方程式为___________。 ③向密闭容器中通入物质的量浓度均为0.5 mol/L的CO2与CH4,在一定条件下发生反应,测得CO2的平衡转化率与温度及压强的关系如甲图所示,则压强从大到小的顺序为___________ ;压强为p2时,在x点,v正___________ (填“>”“<”或“=”)v逆,y点处反应将向___________ (填“正反应”或“逆反应”)方向进行。 甲 (4)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如乙图所示。 乙 ①根据图示电源的正极是___________ (填“a”或“b”); ②电解时b极上生成丙烯的电极反应式为___________。 9.(15分)塑化剂又称增塑剂,是一类增加材料的柔软性或使材料液化的添加剂,广泛应用于橡胶、塑料和医药工业,在国民经济中占有十分重要的地位。最近一些不法商贩将其添加到食品原料中使其成为“台湾饮料安全事件”和“酒鬼酒风波”的元凶。塑化剂的种类很多,但最常被使用的是邻苯二甲酸二辛酯(DEHP)其化学式为C6H4(CO2C8H17)2。 一些有机物的物理数据如下表所示: 化合物密度(g/cm3)熔点(℃)沸点(℃)水中溶解性DEHP0.9861-55370不溶于水邻苯二甲酸酐1.53131.2295不溶于冷水,溶于热水异辛醇0.835-76185~189不溶于水 某化学兴趣小组同学模拟工业生产的工艺流程,用下图所示装置制取少量DEHP,图中的加热和夹持装置已略去。 主要操作步骤如下: ①在装有电动搅拌器、温度计、分水器和回流冷凝管的三颈烧瓶中依次加入0.05 mol邻苯二甲酸酐、0.15 mol异辛醇和少量浓硫酸; ②接通冷凝水,使用加热套对烧瓶加热,待邻苯二甲酸酐固体消失后,迅速升温,控制反应温度在140~150℃之间,回流分水1.5~2小时; ③反应结束后冷却至室温,将反应混合物倒出,进行洗涤后得到粗产品; ④将粗产品置于蒸馏烧瓶中,用减压蒸馏的方法可得到较为纯净的产物。 请回答下列问题: (1)在步骤①中,加入少量浓硫酸的作用是___________。 (2)进行步骤②的过程中分水器中观察到的现象是________________;分水器的作用是________________;回流冷凝管中冷凝水的流向是___________ (填“A进B出”或“B进A出”)。 (3)进行步骤③前,如何判断该反应已经进行完全? ___________。 步骤③中可用下列试剂中的___________ (填试剂编号)进行洗涤。 a.浓NaOH溶液 b.饱和Na2CO3溶液 c.稀H2SO4 d.饱和NaHCO3溶液 该洗涤操作主要除掉的是___________。 (4)步骤④采用减压蒸馏的目的是___________________________ ;在减压蒸馏过程中最先蒸出的是___________。 10.(14分)在工业生产和日常生活中铁及其化合物都扮演着重要角色,四氧化三铁又称磁性氧化铁,是一种重要的铁的氧化物,现通过下面实验确定四氧化三铁中Fe2+与Fe3+的比例: ①取适量分析纯四氧化三铁固体,加适量稀硫酸溶解,溶解后无固体残留; ②将所得溶液平均分为两份,向第一份溶液中加过量的氢氧化钠,不断搅拌至沉淀完全,过滤,洗涤,干燥,灼烧得到固体M的质量记为ag; ③取另一份溶液加入过量的KI溶液之后用标准Na2S2O3溶液滴定,消耗标准液的体积为VmL; (1)步骤②中不断搅拌的作用是________________;灼烧得到的固体M的化学式为________________;它的一个重要用途是___________。 (2)写出步骤③中过量的KI溶液发生的离子方程式:___________ ___________。 (3)通过上述实验可以确定生成物中Fe2+和Fe3+的比例,在实验操作完全正确的前提下,若该比值偏小则可能的原因是___________。 草酸亚铁是一种重要的亚铁盐,常用作照相显影剂和制药工业,现对某水合草酸亚铁晶体进行组成分析: ①准确称取0.360 g上述水合草酸亚铁晶体溶于30 mL 2 mol/L的H2SO4中; ②用浓度为0.032 00 mol/L的标准高锰酸钾溶液滴定至终点消耗体积V1=37.50 mL; ③溶液中加入2 g锌粉,煮沸20 min,若煮沸过程中失水过多,可添加少量蒸馏水。过滤,滤液放入250 mL锥形瓶中,并用蒸馏水洗涤锌粉。合并滤液和洗涤液于250 mL锥形瓶中,加入15 mL 2 mol/L H2SO4; ④在与前面相同的条件下,用KMnO4标准溶液滴至终点,记下读数V2=12.50 mL。 (4)写出第一步滴定可能发生离子方程式:___________。 (5)试计算上述水合草酸亚铁晶体的化学式:___________。 三、选考题:共15分。请考生从给出的两道化学题中任选一题作答,多答则按所答的第一题计分。 11.【化学—选修:物质结构与性质】(15分) 如下图所示,是一种常见的晶胞结构,白色小球占据立方体的顶点和面心,黑色小球占据由白色小球构成的某些四面体空隙中。 (1)离子晶体ZnS在颜料、涂料、荧光体等方面有广泛用途,立方硫化锌晶体具有如上图所示晶胞结构: ①请写出Zn2+的核外电子排布式:________________。 ②若示意图中白球代表Zn2+,黑球代表S2-,则S2-占据由Zn2+构成的四面体空隙的占有率是___________ 。 ③若晶胞的边长为lpm,则两个Zn2+之间的最近距离是Zn2+和S2-之间最近距离的___________ 倍。 (2)金刚砂(SiC)是一种高硬度的耐磨材料,它也具有上图所示的晶胞结构: ①C和Si是同主族元素但其氧化物CO2与SiO2性质差别巨大的原因是___________。 ②若已知碳原子的直径为p×10-10m,硅原子的直径为q×10-10m,假设硅原子和碳原子以刚性小球在晶体中彼此相切,这碳化硅晶体的密度为___________ g/cm3。(列出计算式,不要求最终结果) ③查表可知碳化硅的实际密度比上述计算值略大些,可能原因是___________。 (3)将上述晶胞中的黑球和白球看作同种原子,则可以得到金属锗的晶胞结构: ①该晶胞与某种常见非金属单质的晶胞类似,该非金属单质是___________ 。 ②试解释金属锗采取这种堆积方式而不是像其他金属一样采取密堆积形式的原因___________。 12.【化学—选修:有机化学基础】(15分) 咖啡酸苯乙酯(CAPE)是蜂胶中的主要组分之一,具有极强的抗炎和抗氧化活性进而可以起到抗肿瘤的作用,在医学上具有广阔的应用前景。CAPE可经由下面的路线合成: 已知: ①A为双官能团化合物,且其核磁共振氢谱中有4种化学环境不同的氢原子。 ②F为芳香烃,其相对分子质量为104。 回答下列问题: (1)化合物E的名称是咖啡酸,其中含有的官能团为________________。 (2)上述流程中①~⑨,属于取代反应的是___________。 (3)由化合物B生成化合物C的方程式为___________。 (4)化合物H的结构简式为___________。 (5)化合物D具有多种同分异构体,其中符合下面条件的同分异构体的数目为___________ 种。 ①能与碳酸氢钠反应放出气体;②能发生银镜反应; 其中核磁共振氢谱中含有6种氢,且个数比为1∶1∶1∶1∶2∶2的结构简式为________; 参考答案及解析 1.D(本题考查化学与生活的相关知识) 2.B(本题考查阿伏加德罗常数及其应用的相关知识) 3.C(本题考查元素周期表和元素周期律的相关知识) 【解析】根据题意可知,C为Be元素,E为O元素,F在第二周期,氢化物为弱酸可知F为F元素,B、C同主族可知,B可能是Mg元素也可能是Ca元素,当B为Mg时,D的质子数为10,可知D为Ne元素不合理,则B为Ca元素时,D的质子数为14,可知D为Si元素,合理,A为第二周期的另一金属只能是Li元素,故A为Li;B为Ca;C为Be;D为Si;E为O;F为F。A选项,同一周期从左到右,原子半径逐渐减小,故A正确;B选项,F、O、Si的非金属性逐渐减小,故B正确;C选项,CaO2中O的化合价为-1,SiO2中O的化合价为-2,故C错误;D选项,Ca(OH)2的碱性强于Be(OH)2,故D正确。 4.C(本题考查有机化合物同分异构体数目的相关知识) 5.C(本题考查电化学中电解池综合应用的相关知识) 6.A(本题考查强弱电解质、溶液中离子浓度的相关知识) 【解析】A选项,①③混合后,溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(K+),根据物料守恒2c(K+)=c(CH3COO-)+c(CH3COOH),两式相加消去c(K+),可得A选项正确;B选项,①为强碱弱酸盐,促进水的电离,②为强碱,③为弱酸,②抑制水的电离程度比③大,故水电离出c(OH-)大小顺序为①>③>②,故B错误;C选项,②③混合,溶液中溶质为CH3COOK,强碱弱酸盐呈碱性,故C错误;D选项,①②混合后溶液中c(K+)仍为0.1 mol/L,故D错误。 7.B(本题考查实验基本操作的相关内容) 8.(本题主要考查化学基本原理综合知识,共14分) (1)1 (1分) (3)①b+2c-2a(2分) ②(mol/L)2(1分) ③p3>p2>p1(2分) = (1分) 逆反应 (2分) 9.(本题主要考查以有机化学为载体的综合实验相关知识,共15分) (1)催化剂 (1分) (2)分水器中的液体逐渐增多,液体分为上下两层,下层液体逐渐增多,上层液体部分回流到圆底烧瓶中 (2分) 分离酯化反应产生的水,使酯化反应向正向移动并判断酯化反应的终点 (2分) A进B出 (1分) (3)分水器中的下层液体为水,当分水器中水不再增加时可以判断反应进行完全 (2分) bd (2分) 浓硫酸和残留的少量邻苯二甲酸酐 (2分) (4)在较低温度下分离邻苯二甲酸二辛酯和异辛醇,防止有机物受热分解 (2分) 异辛醇 (1分) 【解析】(1)略。(2)分水器的作用是分离酯化反应中产生的水,使酯化反应正向进行,另外分水器中的水不再增多时证明反应已经结束,可以用来判断反应终点;回流冷凝管的水流方向是下进上出。(3)略。(4)减压是为了降低有机物的沸点,在较低温度下分离邻苯二甲酸二辛酯和异辛醇,防止有机物受热分解;异辛醇沸点较低应该先被蒸馏出来。 10.(本题主要考查Fe元素及其化合物的综合知识,共14分) (1)加快反应速度,使Fe(OH)2尽量转化为Fe(OH)3(2分) Fe2O3(1分) 作为铁红颜料 (1分) (3)在进行步骤③前,Fe2+被部分氧化成Fe3+(2分) (5)FeC2O4·2H2O (2分) 11.(本题主要考查物质结构基础,ZnS典型晶胞结构的相关知识,共15分) (2)①CO2是分子晶体,SiO2是原子晶体,结构类型不同导致性质产生巨大差异 (2分) ③硅原子和碳原子之间存在共价键,电子云相互重叠,使得它们之间的实际距离比原子半径之和要小,从而导致体积偏小,密度偏大 (2分) (3)①金刚石 (1分) ②在金属锗中,锗原子和锗原子之间是共价键而不是金属键,共价键具有方向性和饱和性,故不能像普通金属那样形成密堆积结构 (2分) 12.(本题主要考查基础有机化学的综合知识,共15分) (1)羟基,羧基,碳碳双键 (2分) (2)①②③⑨ (1分) 【解析】根据题干信息可一一推出CAPE的合成路线如下图所示: (作者单位:吉林长春吉大附中实验学校)