酿酒酵母组蛋白H3K56A突变菌株的构建及其对细胞生长的影响
薛涛涛++边金++伍陆++赵秀娟++崔向军++蔡禄

摘要:组蛋白修饰,例如甲基化、乙酰化等修饰对基因表达和细胞生长至关重要。为揭示组蛋白H3第56位赖氨酸(K)修饰对酵母细胞生长的重要性,构建H3K56定点突变为丙氨酸(A)的组蛋白突变株H3K56A,并对其在高温、高盐等条件下的生长状况进行初步检测。根据酵母同源重组的原理,采用两步替换法构建H3K56A突变菌株,用分光光度法测定突变菌株的生长曲线,并分别在高盐、高温条件下检测突变体的表型。结果表明,酿酒酵母组蛋白H3K56A突变菌株构建成功,其生长曲线与野生型无明显差异;H3K56A突变株对高温、高盐条件均较敏感,且在高盐条件下,菌体生长缓慢、菌落偏小,表明组蛋白H3K56位点的修饰可能与酿酒酵母抗高盐、高温机制有关。
关键词:酿酒酵母;H3K56A突变菌;组蛋白修饰;两步替换法;同源重组;高盐环境;高温环境;抗逆机制
中图分类号: S188文献标志码: A
文章编号:1002-1302(2016)12-0077-05
收稿日期:2015-11-02
基金项目:国家自然科学基金(编号:61361014、31260274);内蒙古自然科学基金(编号:2015MS0334)。
作者简介:薛涛涛(1990—),女,山西临县人,硕士研究生,主要从事表观遗传学研究。E-mail:xuetaotao196485@163.com。
通信作者:赵秀娟,博士,教授,主要从事表观遗传学研究。E-mail:zhaoxiujuan@imust.cn。
核小体是真核生物细胞内染色质的基本组成单位,它由147 bp的DNA缠绕核心组蛋白八聚体形成[1],组蛋白H1与2个核小体之间有40~60 bp的连接DNA以稳定核小体的结构[2]。组蛋白八聚体具有球状的三维结构,而蛋白质氨基端则游离在三维球形的表面,游离氨基端的氨基酸残基可以被共价修饰[3]。在酿酒酵母中,编码核心组蛋白H2A、H2B、H3、H4的基因都有2个拷贝,主要的核心组蛋白基因组成4个基因座,每个基因座包含2个组蛋白基因,这2个基因共用1个中心启动子并以不同的方向进行转录。编码组蛋白H3、H4的2个基因分别为HHTI-HHF1、HHT2-HHF2,分别位于Ⅱ号、XIV号染色体上[4],在基因组中这2个拷贝只要有1个存在,便可维持细胞的正常生存[5]。组蛋白H2A、H2B的2个基因座分别为HTA1-HTBI、HTA2-HTB2,它们编码几乎相同的组蛋白H2A、H2B[6]。与组蛋白H3/H4不同的是基因座HTA1-HTBI对于细胞的生存是必需的,但HTA2-HTB2却不是。组蛋白上能发生共价修饰的氨基酸残基称为修饰位点,组蛋白修饰主要发生在组蛋白的N-末端残基上[7]。常见的修饰种类包括组蛋白乙酰化、甲基化、泛素化、磷酸化,以及研究较少的小泛素相关修饰物(small ubiquitin-related modifier,简称SUMO)化、生物素化等[8]。其中赖氨酸、精氨酸的甲基化,丝氨酸、苏氨酸的磷酸化,赖氨酸的乙酰化、泛素化、SUMO化在酵母核心组蛋白中都被检测出来,而且这些修饰大多数都是可逆的[9]。近年来研究表明,组蛋白修饰在调控基因表达和细胞生长等生命活动中起重要的调控作用。
通过组蛋白翻译后修饰的染色质的表观遗传学变异对于环境因素诱导引起的基因转录的变化是很重要的。然而,在外界环境刺激下组蛋白修饰是如何被调控的目前还知之甚少,但是这种表观遗传调控途径对细胞适应与抵御外界不良环境却极为重要[10]。细胞外、细胞内的环境变化都会引起核染色质的变化,从而调控基因的表达,但是目前对这种调控机制的研究并不是很深[11]。外界环境变化信号如养分的缺失、盐离子胁迫和温度的变化等都会影响基因的表达及细胞的发育[12]。为研究组蛋白乙酰化修饰对细胞生长的影响,并探讨组蛋白修饰在酿酒酵母应对外界环境压力时所起的作用,本研究以酿酒酵母为材料,构建H3K56突变为丙氨酸(A)的组蛋白突变菌株,对其生长曲线进行测定,并在高盐、高温条件下与其他位点修饰突变菌株的生长状况进行比较。
1材料与方法
1.1材料
1.1.1菌株与质粒酿酒酵母(Saccharomyces cerevisiae)BY4741:MATa ura3Δ0 hisΔ0 leu2Δ0 met15Δ0;质粒pAG25由内蒙古科技大学基因工程实验室保存。组蛋白H3基因突变质粒pBB6-Hhf2-hht2K56A由戴俊彪实验室提供。
1.1.2试剂、酶与引物卡那霉素、鲑鱼精DNA,购自北京索来宝科技有限公司;诺尔斯菌素,购自北京启维益成科技有限公司;乙酸锂,购自美国MYM生物科技有限公司;Taq DNA聚合酶,购自TaKaRa;BciⅥ酶,购自NEB BioLabs;引物由苏州金唯智生物科技有限公司合成。
1.2引物设计
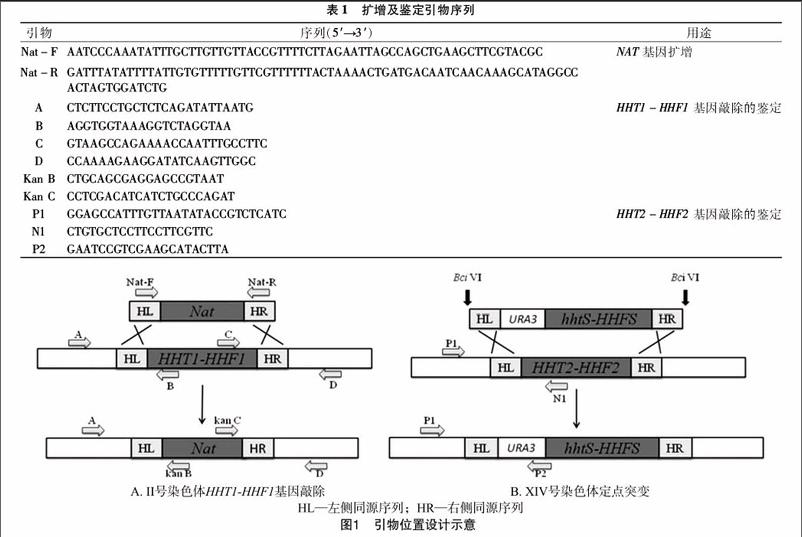
本研究所设计引物见表1,其中引物Nat-F、Nat-R的小写部分分别为HHT1-HHF1基因的左右同源臂序列,引物A、B、C、D、Kan B、Kan C为第1步替换鉴定所用引物,引物P1、N1、P2為第2步替换鉴定所用引物。引物位置见图1。
1.3酿酒酵母Ⅱ号染色体HHT1-HHF1基因敲除
1.3.1NAT基因的扩增参照Dai等的方法[13],以质粒pAG25为模板扩增NAT基因,同时在其上下游引物5′端分别加上Ⅱ号染色体组蛋白H3/H4基因左右同源序列,经PCR扩增后得到左右两侧含有组蛋白H3/H4基因左右同源序列的NAT基因。PCR反应体系:5 μL 10×Ex Buffer(Mg2-),3 μL MgCl2,4 μL dNTPs,1.5 μL正向引物(10 μmol/L),1.5 μL 反向引物(10 μmol/L),1.5 μL模板(pAG25,100 ng/L),0.3 μL Ex Taq DNA聚合酶(5 U/μL);加ddH2O至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。
1.3.2酵母转化采用醋酸锂转化法[14],接种酵母菌BY4741单菌落至YPD液体培养基中进行过夜培养,转接过夜培养的菌液至新的YPD液体培养基中,至D600 nm为0.1,于30 ℃培养至D600 nm为0.6~1.0;收集细胞,用0.1 mol/L LiAc/TE 清洗细胞,重悬细胞于100 μL 0.1 mol/L的LiAc/TE中;取2 μL上述PCR产物进行转化,转化缓冲液体系:312 μL 50% PEG3350、41.4 μL 1 mol/L LiAc、47.9 μL二甲基亚砜(DMSO)、25 μL 10 mg/mL 鲑鱼精DNA(用前用沸水煮 5 min),30 ℃孵育30 min,42 ℃热激15 min;收集细胞,用5 mmol/L CaCl2清洗细胞,加1 mL YPD液体培养基,30 ℃孵育6 h;用ddH2O清洗细胞,在无菌操作台中用含有 100 μg/mL 诺尔斯菌素在YPD固体培养基上涂板。
1.3.3阳性菌落的鉴定挑取平板上的单菌落于YPD液体培养基中,于30 ℃培养,提取基因组,用鉴定引物进行PCR扩增,选取成功替换的阳性克隆。PCR鉴定反应体系:2 μL 10×Buffer(Mg2+),1.5 μL dNTPs,0.1 μL正向引物(10 μmol/L),0.1 μL反向引物(10 μmol/L),1 μL模板(基因组)(700 ng/μL),0.1 μL rTaq DNA聚合酶(5 U/μL);加ddH2O至15 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s,30个循环;72 ℃ 10 min。
1.4酿酒酵母XIV号染色体HHT2-HHF2基因定点突变
1.4.1pBB6-Hhf2-hht2K56A突变质粒的提取与酶切过夜培养含pBB6-Hhf2-hht2K56A突变质粒的大肠杆菌DH5α,用试剂盒法提取质粒,用BciⅥ进行酶切,酶切体系:8 μL 质粒DNA(350 ng/μL),5 μL NEB Buffer4(10×),0.5 μL BciⅥ(10 000 U/mL);加ddH2O至50 μL,37 ℃酶切 2 h。
1.4.2酵母转化接种“1.3.3”节所鉴定的Ⅱ号染色体HHT1-HHF1基因敲除的酵母菌进行培养,取10 μL酶切产物进行转化,转化缓冲液体系及步骤同“1.3.2”节。转化后在尿嘧啶缺陷型酵母培养基(简称SC-Ura)固体培养基上涂板。
1.4.3H3K56A突变菌株的鉴定挑取单菌落于YPD液体培养基上,于30 ℃培养,提取基因组,用鉴定引物进行PCR扩增,选取成功替换的阳性克隆。PCR鉴定反应体系参照“1.3.3”节。PCR反应条件:94 ℃ 5 min;94 ℃ 20 s,55 ℃ 45 s,72 ℃ 45 s,35個循环;72 ℃ 7 min。
1.5生长曲线的测定
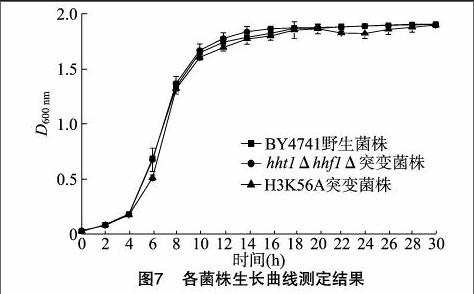
对野生菌株BY4741、Ⅱ号染色体HHT1-HHF1基因敲除菌株、XIV号染色体组蛋白H3K56A定点突变菌株分别进行生长曲线的测定。分别取3个装有250 mL YPD液体培养基的三角甁,加入体积分数1%的已活化18 h的酵母培养液,30 ℃、200 r/min摇床培养。在培养2、4、6、8、10、12、14、16、18、20、22、24、26、28、30 h时取培养液,以未接种的YPD液体培养基作参比,使用分光光度计测定600 nm处的吸光度D600 nm。
1.6H3K56A突变菌株表型及抗高盐、高温能力检测
为了研究H3K56位点进行的修饰对酿酒酵母细胞生长的重要性,分别接种组蛋白H3K14A、H3K14R、H3K56A、H3K79A突变菌株与野生菌株BY4741、Ⅱ号染色体HHT1-HHF1基因敲除菌株于YPD液体培养基中,30 ℃、200 r/min过夜培养,调整过夜培养各样品至同一浓度,每个菌株做5个浓度梯度稀释,每个浓度取5 μL进行接种,使其总接种细胞数分别为10 000、2 000、400、80、16个。试验组接种培养基为普通YPD固体培养基与含1 mol/L NaCl的YPD固体培养基,接种后分别在39、30 ℃条件下进行培养;对照组接种培养基为普通YPD固体培养基,于30 ℃培养。观察菌株生长状况,培养至3 d时拍照。
2结果与分析
2.1HHT1-HHF1基因敲除菌株的构建及鉴定
质粒pAG25大小为3 704 bp,图2为质粒在0.8%琼脂糖凝胶电泳中得到的电泳结果。以质粒pAG25为模板扩增所得NAT基因大小约为1 300 bp,NAT基因1.5%琼脂糖凝胶电泳结果(图3)显示,目的条带与实际大小相符。上述PCR扩增产物经过乙酸锂转化,在含有诺尔斯菌素的YPD固体培养基上成功获得转化子。挑取转化子,提取其基因组进行PCR验证。由图4可见,点样孔1、3没有扩增出产物,而点样孔2、4扩增出约800 bp的片段,表明该菌落Ⅱ号染色体HHT1-HHF1成功被NAT基因替换,已成功鉴定出阳性菌株。
2.2H3K56A突变菌株的构建及鉴定
组蛋白H3修饰突变质粒pBB6-Hhf2-hht2K56A上有BciⅥ酶的4个酶切位点,酶切片段大小分别为4 071、2 575、1 527、613 bp,其中4 071 bp大小的片段上含有组蛋白H3突变基因HHTs-HHFS、URA3基因、组蛋白H3/H4基因HHT2-HHF2左右同源序列。质粒经酶BciⅥ酶切结果见图5,酶切产物经乙酸锂转化后,在SC-Ura平板上得到转化子。以转化子基因组为模板进行扩增,扩增产物用1.5%琼脂糖凝胶电泳进行检测。由图6可见,样孔1以P1+P2为引物PCR扩增出1段约700 bp的片段,而样孔2以P1+N1为引物则没有扩增出片段,表明其XIV号染色体HHT2-HHF2基因已被H3K56A突变基因替换。
2.3生长曲线的测定
由图7可知,酿酒酵母的生长在前4 h处于调整期,4~10 h酵母生长处于对数期,10 h以后处于稳定期。对野生菌株BY4741、Ⅱ号染色体NAT突变菌株、XIV号染色体组蛋白H3K56A突变菌株的生长曲线进行比较可知,其生长期无明显差异,说明组蛋白H3K56A突变对于酵母菌的生长期无明显影响。
2.4菌株表型及抗高盐、高温能力检测
组蛋白K3K56A突变后该位点将不能被乙酰化修饰,而组蛋白H3K56位点的乙酰化修饰对于DNA的复制、转录和DNA损伤修复等生物学过程却是必不可少的。笔者将H3K56A突变菌株与其他位点突变菌株H3K14A、H3K14R、H3K79A和单拷贝组蛋白H3/H4基因Ⅱ号染色体NAT突变菌株、野生BY4741菌株分别在高温、高盐胁迫下的表型进行比较。由图8-A可以看出,在正常培养条件下,失去Ⅱ号染色体1个H3/H4基因拷贝后的hht1Δhhf1Δ菌株生长情况与野生型并无多大区别,说明对于组蛋白H3/H4来说,只须保证它在基因组中有1个拷贝便可满足其正常生长。其他4种组蛋白突变株H3K14A、H3K14R、H3K56A、H3K79A的生长情况正常,说明这4个组蛋白修饰位点的突变并没有对酵母的正常生存造成影响。由图8-B、图8-C可见,在高盐、高温胁迫下,H3K56A突变体生长情况不如其他菌株,说明在对抗高盐、高温不利环境条件方面,H3K56位点的修饰可能更为重要。同时对比图8中A、B、C3种条件下菌落生长情况还可以看出,在高盐胁迫下所有菌株的菌落生长缓慢,表明高盐可能会抑制酵母细胞菌落的生长。
3讨论
组蛋白特定位点的乙酰化、甲基化等修饰与DNA的复制及转录调控等生物学过程密切相关。组蛋白的乙酰化在染色质转录活性的激活过程中起重要作用[15],目前人们对组蛋白K3K56位点的乙酰化修饰研究较为深入。组蛋白H3K56ac在启动子区域通过破坏核小体上DNA进出口处组蛋白H3与DNA的相互作用,从而促进核小体的分解,进而促使转录的起始[16]。在酿酒酵母中,组蛋白H3K56的乙酰化是通过组蛋白分子伴侣Asf1、乙酰转移酶Rtt109来调节的,在表观遗传水平上通过与其他因子的相互作用来调控基因的表达[17]。本研究采用2步替换法来构建H3K56A突变株,首先采用PCR的方法扩增NAT基因,由于其引物5′端添加了40 bp 的H3/H4基因左右同源序列,扩增产物通过乙酸锂转化试验,在基因组复制过程中可以与Ⅱ号染色体上基因H3/H4发生同源重组,从而成功敲除了Ⅱ号染色体上基因H3/H4拷贝1而得到NAT突变菌株,通过检测其生长曲线与生长表型及部分敏感性试验,表明H3/H4基因缺失1个拷贝后并不会对酵母的正常生长造成影响,这既为第2步XIV号染色体组蛋白定点突变试验奠定了基础,又可排除突变后表型的差异是因为缺失了1個拷贝而引起的可能性。第2步替换由于H3/H4定点突变基因较长,因此笔者对含有突变基因的质粒pBB6-Hhf2-hht2K56A进行酶切并获得含有H3/H4左右同源臂的H3/H4基因H3K56A定点突变基因,同样通过乙酸锂转化法得到H3K56A突变株。通过本研究提供的方法进行突变体的构建,转化效率较高,操作简便,可以成功得到组蛋白定点突变菌株,这为研究组蛋白H3K56ac修饰的生物学功能奠定了基础。
通常情况下,微生物都有能力应答外界不良环境的刺激,这些应激几乎是微生物都具有的基本能力,包括营养水平的改变、渗透压失衡、氧化应激和温度变化等不良条件[18]。多细胞生物及可以运动的生物体一般都可以通过能动的位置的或生理机能的调节改变来避免这些不利的生存环境,但是对于单细胞生物如酵母来说,它们受外界环境的支配,要么适应这种环境,要么死亡[19]。酿酒酵母是一种典型的模式生物,其对环境压力应答的研究是真核细胞生物学研究的重要组成部分,而转录激活在这个过程中起重要作用[20]。目前对组蛋白修饰在酵母抗逆过程中所起作用研究甚少,本研究对H3K56A定点突变菌株进行高盐、高温敏感性试验,对组蛋白修饰在外界不良环境胁迫下所起作用进行初步探索,为组蛋白H3K56位点修饰的研究提供了新的参考。
4结论
本研究通过两步替换法成功获得了组蛋白H3K56A突变株,使得组蛋白H3K56位点不能被乙酰化修饰,为构建组蛋白修饰突变体提供了1种简易而高效的方法,并且为研究组蛋白H3K56ac修饰的生物学功能奠定了基础。通过高盐、高温敏感性试验表明,酵母H3K56ac与酵母抗高温、高盐机制有关。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]Jiang C,Pugh B F. Nucleosome positioning and gene regulation:advances through genomics[J]. Nature Reviews Genetics,2009,10(3):161-172.
[2]Thoma F,Koller T,Klug A. Involvement of histone H1 in the organization of the nucleosome and of the salt-dependent superstructures of chromatin[J]. Journal of Cell Biology,1979,83:403-427.
[3]周蔚,王世鑫. 组蛋白修饰与基因调控[J]. 国外医学:分子生物学分册,2003,25(2):71-73.
[4]Smith M M,Murray K. Yeast H3 and H4 histone messenger RNAs are transcribed from two non-allelic gene sets[J]. Journal of Molecular Biology,1983,169(3):641-661.
[5]Smith M M,Stirling V B. Histone H3 and H4 gene deletions in Saccharomyces cerevisiae[J]. Journal of Cell Biology,1988,106(3):557-566.
[6]Hereford L,Fahrner K,Woolford J,et al. Isolation of yeast histone genes H2A and H2B[J]. Cell,1979,18(4):1261-1271.
[7]Ng H H,Feng Q,Wang H B,et al. Lysine methylation within the globular domain of histone H3 by Dot1 is important for telomeric silencing and Sir protein association[J]. Genes & Development,2002,16(12):1518-1527.
[8]蔣智文,刘新光,周中军. 组蛋白修饰调节机制的研究进展[J]. 生物化学与生物物理进展,2009,36(10):1252-1259.
[9]Kouzarides T. Chromatin modifications and their function[J]. Cell,2007,128(4):693-705.
[10][ZK(#]Chen H,Fan M,Pfeffer L M,et al. The histone H3 lysine 56 acetylation pathway is regulated by target of rapamycin (TOR) signaling and functions directly in ribosomal RNA biogenesis[J]. Nucleic Acids Research,2012,40(14):6534-6546.
[11]Faulk C,Dolinoy D C. Timing is everything The when and how of environmentally induced changes in the epigenome of animals[J]. Epigenetics,2011,6(7):791-797.
[12]Vaquero A,Reinberg D. Calorie restriction and the exercise of chromatin[J]. Genes & Development,2009,23(16):1849-1869.
[13]Dai J B,Hyland E M,Yuan D S,et al. Probing nucleosome function:A highly versatile library of synthetic histone H3 and H4 mutants[J]. Cell,2008,134(6):1066-1078.
[14]Gietz R D,Schiestl R H,Willems A R,et al. Studies on the transformation of intact yeast cells by the LiAc/SS-DNA/PEG procedure[J]. Yeast,1995,11(4):355-360.
[15]Sterner D E,Berger S L. Acetylation of histones and transcription-related factors[J]. Microbiology and Molecular Biology Reviews,2000,64(64):435-459.
[16]Williams S K,Truong D,Tyler J K. Acetylation in the globular core of histone H3 on lysine-56 promotes chromatin disassembly during transcriptional activation[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(26):9000-9005.
[17]Recht J,Tsubota T,Tansy J C,et al. Histone chaperone Asf1 is required for histone H3 lysine 56 acetylation,a modification associated with S phase in mitosis and meiosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(18):6988-6993.
[18]Morano K A,Grant C M,Moye-Rowley W S. The response to heat shock and oxidative stress in saccharomyces cerevisiae[J]. Genetics,2012,190(4):1157-1195.
[19]Akerfelt M,Morimoto R I,Sistonen L. Heat shock factors:integrators of cell stress,development and lifespan[J]. Nature Reviews Molecular Cell Biology,2010,11(8):545-555.
[20]Yamamoto N,Maeda Y,Ikeda A,et al. Regulation of thermotolerance by stress-induced transcription factors in Saccharomyces cerevisiae[J]. Eukaryotic Cell,2008,7(5):783-790.

