群体和单细胞微囊藻对短期高光胁迫的生理响应
徐 沙杨燕君许金铸施军琼宋立荣吴忠兴
(1. 西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715; 2. 中国科学院水生生物研究所, 武汉 430072)
群体和单细胞微囊藻对短期高光胁迫的生理响应
徐 沙1杨燕君1许金铸1施军琼1宋立荣2吴忠兴1
(1. 西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715; 2. 中国科学院水生生物研究所, 武汉 430072)
为了探讨不同形态的微囊藻(Microcystis)对光的耐受能力及其应对机制, 研究比较了短期高光强条件下群体微囊藻和单细胞微囊藻的生理响应, 结果表明, 在高光强胁迫下, 群体和单细胞微囊藻的叶绿素含量、最大电子传递速率(ETRmax)均降低, 但与单细胞微囊藻相比, 群体微囊藻的下降幅度较小; 在高光强胁迫下, 群体微囊藻的过氧化氢酶(CAT)与超氧化物歧化酶(SOD)的活性均显著增加, 而单细胞微囊藻只有CAT活性增加; 在短期高光胁迫下, 群体微囊藻的死亡率没有显著变化。这些结果表明群体微囊藻比单细胞微囊藻能耐受更高的光强, 也暗示了群体微囊藻在野外高光强条件下更具竞争优势。
群体和单细胞微囊藻; 光强; 生理响应; 蓝藻水华
近年来随着工农业的发展, 湖泊内氮、磷含量不断增加, 使得水体富营养化趋势日益严重, 蓝藻水华频繁发生, 对环境和人类产生了严重危害[1,2]。在长期的进化过程中, 蓝藻已经发展了一套独特的生理学机制和适应特性, 形成了极强的生态竞争,导致了水华的形成。然而, 蓝藻如何在短时间内形成水华, 其机制一直受到广泛关注。
在蓝藻水华的形成过程中, 光是重要的因素之一。研究表明藻类光合作用和生长速率的调节往往与其对不同光质和光谱的光积累响应有密切关系[3]。但当长期暴露320 μE/(m2·s)光强下, 往往导致藻类大量死亡, 其原因是在高光强下, 光氧化和光呼吸抑制了光合作用效率[4]。然而, 在水华形成的过程中, 蓝藻细胞往往暴露在高光强下, 蓝藻如何适应这种高光强条件则未见探讨。
微囊藻(Microcystis)是一种全世界广泛分布的水华蓝藻, 其水华的发生和产生的微囊藻毒素已经引起了许多的生态环境问题[1,5]。Abeliovich等[6]研究发现微囊藻若长期培养在高光强下, 藻细胞易导致光氧化过程的形成, 降低光合效率。然而, 该研究主要以实验室培养的单细胞微囊藻为材料, 研究已表明群体微囊藻解聚的过程中可能引起其生理生化指标及其抗性的改变[7], 因而不能很好反映自然条件下微囊藻的生理生化特征。在自然环境条件下微囊藻主要是以群体形式存在[8], 因此, 本研究比较了群体微囊藻和单体微囊藻在短期高光强培养下的生理生化响应, 旨在探究群体微囊藻对高光强的耐受规律及其响应机制, 为阐明微囊藻水华的形成及发生机制提供实验依据。
1 材料与方法
1.1 藻株来源和培养
实验选用藻种来源于中国科学院水生生物研究所淡水藻种库(FACHB-collection), 各藻株的相关特征信息如表 1所示。藻株的培养条件为: 光强25 μE/(m2·s),温度(25±1)℃, 光周期12h∶ 12h。当藻株生长到对数期时, 藻液经离心后, 获得对数期藻细胞, 然后加入新鲜的BG11培养液, 接种浓度为A680=0.2, 置光强为25和350 μE/(m2·s)下, 持续光照培养24h, 其中25 μE/(m2·s)为对照组。每个处理实验设3个平行。
1.2 叶绿素含量和可溶性蛋白的测定
叶绿素用80%丙酮于4℃抽提24h, 离心后, 上清液用分光光度计测定663 nm的光吸收值, 通过Wetsttein公式Chl.a (mg/L)=12.72×A663-2.7×A645计算得到叶绿素含量。总的可溶性的蛋白含量采用考马斯亮蓝结合法测定。
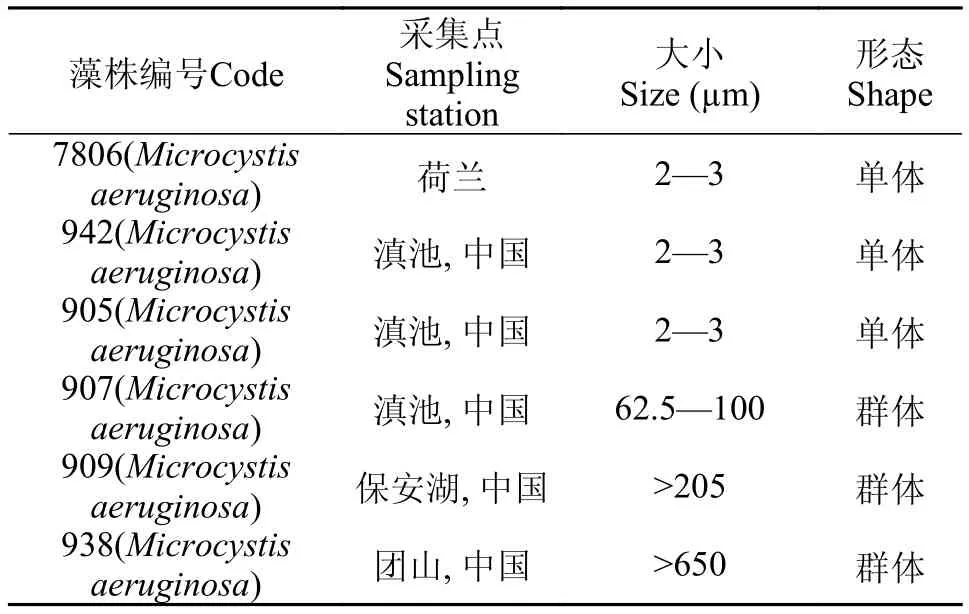
表 1 实验中所用微囊藻藻株信息Tab. 1 The information of Microcystis used in this study
1.3 最大光化学效率(Fv/Fm)和电子传递速率(Electron Transfer Rate, ETR)
用浮游植物荧光分析仪(PHYTO-PAM, Waltz公司, 德国)测定藻细胞的最大光化学效率及电子传递速率, 测定方法参见Maxwell等方法[9]。
1.4 抗氧化物酶活性的测定
过氧化氢酶(Catalase, CAT)的活性根据Aebi[10]所描述的方法测定。计算公式为CAT=(Am-As)/ (0.1×V×1×Cp), Cp指蛋白质浓度mg/mL。
超氧化物歧化酶(Superoxide dismutase, SOD)活性根据Dhindsa等光化还原氧化法[12]进行测定。酶活性采用SOD=[(Amax-A560)/Amax]/0.5公式计算。
1.5 细胞死亡率
所有样品经FDA (Fluorescein diacetate)染色后,用流式细胞仪(Epics Altra Coulter, Beckman, USA)对细胞活性进行检测。群体微囊藻的处理及FCM测定步骤见Wu等方法[7], 其中FCM激发光为488 nm,检测荧光为505—545 nm。
1.6 数据统计
所有实验设置3个平行, one-way ANOVA进行LSD显著性检验(SPSS)。
2 结果
2.1 不同形态微囊藻叶绿素含量比较
在短期高光强处理下, 两种形态微囊藻的叶绿素a的含量均显著下降(P<0.05, 图 1)。24h时, 单体微囊藻7806、942和905的Chl. a含量比初始时分别降低了96.2%、65.6%和87.3%, 群体微囊藻938、907和909的Chl. a含量分别降低了50%、30.4%和 29.5%。而在25 μE/(m2·s)光强下, 培养24h后, Chl. a含量变化不显著(图 1)。
2.2 最大光合效率(Fv/Fm)的变化
高光强培养24h后, 比较了6株微囊藻的最大光合效率(Fv/Fm), 结果表明群体和单细胞微囊藻的最大光合效率均显著性降低(ANOVA, P<0.01, 图 2)。单细胞微囊藻7806、942和905 分别下降了86.1%、100%和90.9%; 群体微囊藻、938、907和909分别下降了29.7%、56%和51.4%。
2.3 群体和单体微囊藻ETRmax的变化
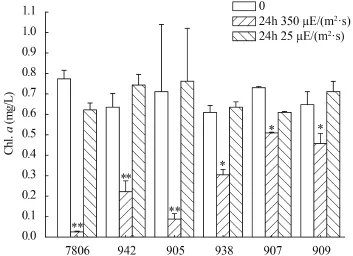
图 1 光强对群体和单体微囊藻叶绿素含量的影响Fig. 1 The effects of light intensity on Chl. a of colonial and single-celled Microcystis strains*表示P<0.05; **表示P<0.01; 下同* means P<0.05 level; ** means P<0.01 level; the same applies below
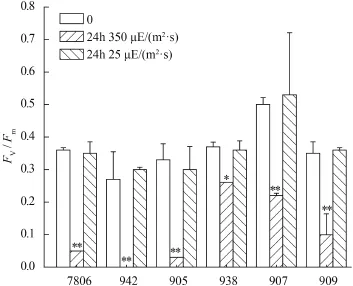
图 2 光强对单体和群体微囊藻最大光合效率(Fv/Fm)的影响Fig. 2 The effects of light intensity on Fv/Fmof colonial and single-celled Microcystis strains
由表 2可知, 单体微囊藻在高光强培养3h后,ETRmax下降了73.4%—92.8%(ANOVA, P<0.01), 而群体微囊藻938、907和909的ETRmax分别由0时的45.2、87.5和63.7 electrons/(m2·s)下降到30.1、70.2和51.6 μmol electrons/(m2·s)。24h, 群体和单体微囊藻的ETRmax比3h时有所增加。

表 2 群体和单体微囊藻的ETRmax比较Tab. 2 The comparison of ETRmaxof colonial and single-celled Microcystis
2.4 群体和单细胞微囊藻的抗氧化酶活性的变化
对群体和单细胞微囊藻的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)分析表明, 群体微囊藻和单细胞微囊藻在应对光胁迫方面有明显的差异(图 3)。24h时, 群体微囊藻的SOD酶活性比初始时增加了1.3—3.4倍(图 3a)。然而, SOD酶活性在单细胞微囊藻中并未表现出明显变化。

图 3 群体和单细胞微囊藻抗氧化酶活性的变化Fig. 3 The effects of light intensity on the enzymes activities of colonial and single-celled Microcystis strains
对群体和单细胞微囊藻的CAT酶活性比较分析表明(图 3b), 无论是群体微囊藻还是单细胞微囊藻, 它们的CAT酶活性均呈现出显著增加态势(ANOVA, P<0.05)。然而, 与群体微囊藻相比, 单细胞微囊藻CAT酶活显著增加(ANOVA, P<0.05)。单细胞微囊藻24h的CAT酶活分别是0的3.5—5.9倍, 而群体微囊藻则为1.4—1.8倍。在正常光照培养下的微囊藻, 其SOD和CAT酶活均未发现明显的变化(图 3)。
2.5 群体和单细胞微囊藻细胞死亡率的变化
如表 3所示, 在高光强处理24h后, 群体与单细胞微囊藻的死亡率均有上升, 但多数细胞仍保持相对较高的活性。在24h的高光强处理后, 单细胞微囊藻死亡率与初始值相比增加了约1.5—7.8倍, 而群体微囊藻死亡率与初始值相比增加了约1.3—1.5倍。

表 3 光强对群体和单细胞微囊藻细胞死亡率的影响Tab. 3 The effects of high light intensity on the mortality rate of colonial and single-celled Microcystis
3 讨论
3.1 光强对不同形态微囊藻叶绿素的影响
光是所有光合自养生物的重要影响因素, 不同生物对光的利用能力直接影响其种群分布及结构[13]。Huisman等[14]认为浮游植物对光强的响应及应答取决于种的差异, 这表明外界光强的变化能影响浮游植物的生长和组成。微囊藻是常见的一种水华蓝藻, 然而, 其不同形态种类对光强的响应及应答机制仍未见报道。为了了解微囊藻应对高光胁迫机制, 研究了两种形态的微囊藻对高光强的生理生化特征, 结果表明在高光强胁迫下群体和单体微囊藻的叶绿素a均降低, 但单体微囊藻叶绿素降低幅度明显大于群体微囊藻(图 1)。这一结果证实了先前对Anacystis nidulans[15]和铜绿微囊藻[16]的研究, 即光强的增加, Chl. a浓度降低。这暗示了群体微囊藻能够耐受更高的光强。
3.2 光强对不同形态微囊藻光合效率的影响
Silva等[17]对Synechocystis sp.研究表明在高光强下培养, 藻类的光合效率会不断散失并伴随着光抑制现象产生。一旦吸收的能量超过消耗的能量,光合系统Ⅱ(PSⅡ)将发生损害[18], 导致PSⅡ反应中心的电子传递失活或钝化, 甚至导致蛋白D1降解[19]。因此, 若受损的光合系统Ⅱ不及时修复, 类囊体膜上将大量积累失活或钝化的PSⅡ, 使得光量子产率下降[17]。本研究结果发现高光强显著降低了单细胞的Fv/Fm、ETRmax值(图 2、表 2)。因此, 推测单细胞微囊藻的PSⅡ反应中心被高光强抑制或损伤。然而, 与单细胞微囊藻相比, 群体微囊藻的Fv/Fm和ETRmax降低幅度较少。这进一步说明了群体微囊藻在高光胁迫下表现出更强的耐性。
3.3 抗氧化酶活性对不同光强的响应
Eloff等[20]研究表明水华表层的微囊藻受到高光作用易发生光氧化作用, 而导致微囊藻细胞死亡。此外, 研究也发现一些蓝藻通过降低自身光合色素的光氧化达到适应水体表面高光强胁迫[21]。而光氧化往往导致了细胞内高水平的自由基(O2-)产生, 因此, 降低细胞体内自由基O2-的伤害则对蓝藻的适应策略具有重要的作用。卿人韦等[22]对极大螺旋藻和Canini等[23]对微囊藻的研究表明高光胁迫下大量的抗氧化酶活性的增加。本研究也发现高光胁迫下群体微囊藻SOD和CAT酶活性和单细胞微囊藻CAT酶活性都显著增加(图 3)。这表明微囊藻细胞在高光胁迫下产生了光氧化现象, 导致了大量的清除自由基酶被激活。然而, 群体微囊藻和单细胞微囊在应对光氧化方面存在着一定的差异,群体微囊藻能够产生SOD和CAT酶来清除光氧化产生的自由基O2-, 而单细胞微囊藻则只通过CAT酶来清除藻细胞内的O2-(图 3), 表明了在清除自由基能力方面, 相对于单体微囊藻来说, 群体微囊藻具有一定的优势。至于为什么单细胞微囊藻的SOD变化不显著, 则还有待进一步的研究。
Silva等[17]研究发现了光限制具有时间效应, 随着光照时间增长, 聚球藻的光合及荧光活性部分被恢复。我们的研究也证实了这一结论, 即随着光照时间的增加, 微囊藻的最大电子传递速率及最大荧光效率有所增加(表 2), 这说明随着微囊藻对光强的适应, 其PSⅡ反应中心已部分被修复, 表明了微囊藻对光照强度具有一定的耐受性。此外, 本研究也对群体和单细胞微囊藻的存活率进行了比较, 发现胁迫处理后, 微囊藻细胞的存活率仍然较高, 说明了在350 μE/(m2·s)光照下微囊藻活力并未被破坏或抑制, 进一步证实了微囊藻能耐受较高的光强。与单细胞相比, 群体微囊藻细胞表现出较低的死亡率, 其原因可能是由于群体微囊藻能产生大量的SOD和CAT来清除光氧化造成的损伤。此外, Tien等[24]对英国5个淡水湖泊进行研究发现, 微囊藻水华发生的季节, 水体中胞外多糖(EPS)含量最高。EPS被认为是蓝藻抵御极端环境条件的重要物质[25]。群体微囊藻胞外存在着大量的EPS, 因而在一定程度上保护了细胞免受高光强的损伤, 从而降低了群体微囊藻的光抑制效应, 保证了群体微囊藻的存活率。
综上所述, 微囊藻能耐受较高的光强, 但与单细胞微囊藻相比, 群体微囊藻叶绿素a和光合受胁迫较小, 表明了群体微囊藻在野外高光强的环境能够比单细胞微囊藻更具优势。
[1]Codd G A. Cyanobacterial toxins, the perception of water quality, and the prioritization of eutrophication control [J]. Ecological Engineering, 2000, 16(1): 51—60
[2]Wang S Y, Zhou Z J, Wang Z C, et al. The distribution of nutrients in the three gorges reservoir and the effects on the growth of algae [J]. Acta Hydrobiologica Sinica, 2015, 39(5): 910—919 [王司阳, 周子俊, 汪志聪, 等. 三峡水库营养元素的分布及其与藻类生长的关系. 水生生物学报, 2015, 39(5): 910—919]
[3]Cullen P. The turbulent boundary between water science and water management [J]. Freshwater Biology, 1990, 24(1): 201—209
[4]Liere L V, Mur L R. Occurrence of Oscillatoria Agardhii and Some Related Species, a Survey [M]. Hypertrophic Ecosystems. Springer Netherlands. 1980, 67—77
[5]Jiang H B, Qiu B S. Photosynthetic adaptation of a bloom-forming cyanobacterium Microcystis aeruginosa (Cyanophyceae) to prolonged UV-B exposure [J]. Journal of Phycology, 2005, 41(5): 983—992
[6]Abeliovich A, Shilo M. Photooxidative death in bluegreen algae [J]. Journal of Bacteriology, 1972, 111(3): 682—689
[7]Wu Z X, Gan N Q, Huang Q, et al. Response of microcystis to copper stress: Do phenotypes of Microcystis make a difference in stress tolerance [J]? Environmental Pollution, 2007, 147(2): 324—330
[8]Xiao Y, Gan N Q, Zheng L L, et al. Studies on morphological responses to light in colonial microcystis and the underlying physiological mechanisms [J]. Acta Hydrobiologica Sinica, 2014, 38(1): 35—42 [肖艳, 甘南琴, 郑凌凌,等. 光强对微囊藻群体形态的影响及其生理机制研究.水生生物学报, 2014, 38(1): 35—42]
[9]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(s1—2): 248—254
[10]Maxwell K, Johnson G N. Chlorophyll fluorescence—a practical guide [J]. Journal of Experimental Botany, 2000, 51(345): 659—668
[11]Aebi H. Catalase in vitro [J]. Methods in Enzymology, 1984, 105(3):121—126
[12]Dhindsa R S, Matowe W. Drought Tolerance in two mosses: correlated with enzymatic defence against lipid peroxidation [J]. Journal of Experimental Botany, 1981, 32(1): 79—91
[13]Flöder S, Urabe J, Kawabata Z I. The influence of fluctua-ting light intensities on species composition and diversity of natural phytoplankton communities [J]. Oecologia, 2002, 133(3): 395—401
[14]Huisman J, Weissing F J. Species dynamics in phytoplankton blooms: incomplete mixing and competition for light [J]. American Naturalist, 1999, 154(1): 46—68
[15]Jones L W, Myers J. Pigment variations in Anacystis nidulans induced by light of selected wavelengths [J]. Journal of Phycology, 1965, 1(1): 7—14
[16]Raps S, Wyman K, Siegelman H W, Falkowski P G. Adaptation of the cyanobacterium Microcystis aeruginosa to light intensity [J]. Plant Physiology, 1983, 72(3): 829—832
[17]Silva L M T, Santos C P D, Chaloub R M. Effect of the respiratory activity on photoinhibition of the cyanobacterium Synechocystis sp. [J]. Photosynthesis Research, 2001, 68(1): 61—69
[18]Asada K .Mechanisms for scavenging reactive molecules generated in chloroplasts under light stress [A]. In: Baker N R, Bowyer J R (Eds.), Photoinhibition of Photosynthesis. Oxford: Biological Scientific Publishers. 1994, 129—142
[19]Aro E M, Virgin I, Andersson B. Photoinhibition of photosystem Ⅱ. Inactivation, protein damage and turnover [J]. Biochimica Et Biophysica Acta, 1993, 1143(2): 113—134
[20]Eloff J N, Steinitz Y, Shilo M. Photooxidation of cyanobacteria in natural conditions [J]. Applied and Environmental Microbiology, 1976, 31(1): 119—126
[21]Paerl H W, Tucker J, Bland P T. Carotenoid enhancement and its role in maintaining blue-green algal (Microcystis aeruginosa) surface blooms [J]. Limnology and Oceanography, 1983, 28(5): 847—857
[22]Qing R W, Ye H X, Li Y, et al. Study of the activity of two antioxidant enzymes of Spirulina maxima under excessive light stress [J]. Journal of Sichuan University (Natural Science Edition), 2003, 40(3): 565—569 [卿人韦, 叶华勋, 李扬, 等. 在高强度光照胁迫下极大螺旋藻两种抗氧化酶活力变化的研究. 四川大学学报(自然科学版), 2003, 40(3): 565—569]
[23]Canini A, Leonardi D, Caiola M G. Superoxide dismutase activity in the cyanobacterium Microcystis aeruginosa after surface bloom formation [J]. New Phytologist, 2001, 152(1): 107—116
[24]Tien C J, Krivtsov V, Levado E, et al. Currence of cellassociated mucilage and soluble extracellular polysaccharides in Rostherne Mere and their possible significance [J]. Hydrobiologia, 2002, 485(1): 245—252
[25]Ge H M, Zhou X P, Xia L, et al. Effects of light and nitrogen source on the secretion of extracellular polysaccharides from Nostoc sp. [J]. Acta Hydrobiologica Sinica, 2014, 38(3): 480—486 [葛红梅, 周旭萍, 夏令, 等. 光强和氮源对念珠藻胞外多糖分泌的影响. 水生生物学报, 2014, 38(3): 480—486]
THE PHYSIOLOGICAL RESPONSE OF COLONIAL AND SINGLE-CELLED FORM OF MICROCYSTIS TO SHORT-TERM HIGH STRESS
XU Sha1, YANG Yan-Jun1, XU Jin-Zhu1, SHI Jun-Qiong1, SONG Li-Rong2and WU Zhong-Xing1
(1. Key Laboratory of Eco-environments in Three Gorges Reservoir Region (Ministry of Education), Chongqing Key Laboratory of Plant Ecology and Resources Research in Three Gorges Reservoir Region, Southwest University, Chongqing 400715, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Light is one of the important factors for algae growth and product by photosynthesis. This study investigated the physiological response of colonial and single-celled form of Microcystis to light intensity. The results showed that the Chl. a and ETRmaxin colonial and single-celled forms of Microcystis were declined by high light intensity with a bigger decrease in single-celled form of Microcystis. The enzyme activities of SOD and CAT in colonial and singlecelled form of Microcystis were increased by high light intensity. The colonial form of Microcystis decreased the photooxidate damage by increasing SOD and CAT activities, while single-celled Microcystis reduced damage through CAT activity only. The mortality rate of colonial form of Microcystis showed no significantly difference by short-term high light intensity. These suggest that colonial form of Microcystis had higher tolerance to high light intensity when compared with single-celled form of Microcystis, explaining that colonial Microcystis are predominate strains in water blooms.
Colonial and single-celled Microcystis; Light intensity; Physiological response; Cyanobacterial bloom
Q945.78
A
1000-3207(2017)02-0443-05
10.7541/2017.55
2016-01-29;
2016-04-25
国家自然科学基金(31170372); 西南大学博士基金(SWU110065)资助 [Supported by the National Natural Science Foundation of China (31170372); Doctoral Found Project of China SWU (SWU110065)]
徐沙(1991—), 女, 陕西咸阳人; 硕士研究生; 主要从事藻类生理学研究。E-mail: 18883341908@163.com
吴忠兴(1975—), 男, 教授; 主要从事藻类生理生态及分子系统性学研究。E-mail: wuzhx@swu.edu.cn

