枣实蝇气味结合蛋白基因的克隆及表达谱分析
李亚伟,张小菊,王科珂,于艳雪,张祥林,张伟,张俊华,杨定,陈乃中
(1.中国检验检疫科学研究院植物检疫研究所,北京 100176;2.新疆出入境检验检疫局,乌鲁木齐 830063;3.中国农业大学,北京 100083)
枣实蝇气味结合蛋白基因的克隆及表达谱分析
李亚伟1,2,3,张小菊2,王科珂2,于艳雪1,张祥林2,张伟2,张俊华1,杨定3,陈乃中1
(1.中国检验检疫科学研究院植物检疫研究所,北京 100176;2.新疆出入境检验检疫局,乌鲁木齐 830063;3.中国农业大学,北京 100083)
【目的】克隆枣实蝇CarpomyavesuvianaCosta气味结合蛋白(odorant binding protein, CvcoOBP)基因,对其表达谱进行分析,为枣实蝇气味结合蛋白的深入研究奠定基础。【方法】对枣实蝇头部RNA进行转录组测序,通过蛋白序列比对以及构建系统进化树分析枣实蝇OBP序列,运用半定量反转录-聚合酶链反应(semi-quantitative reverse transcription and polymerase chain reaction, sqRT-PCR)方法对获得的CvcoOBP序列进行组织表达特异性研究。【结果】转录组测序后共获得7个OBP, 命名为 (GenBank登录号分别为:KU975053、KU975054、KU975055、KX059394、KU975056、KX059395、KX059396)。对CvcoOBP1-7进行蛋白序列比对发现,CvcoOBP1、CvcoOBP3、CvcoOBP4、CvcoOBP6、CvcoOBP7是典型的OBP家族成员,具有6个高度保守的半胱氨酸残基;CvcoOBP2和CvcoOBP5属于“Minus-C”家族成员,具有4个高度保守的半胱氨酸残基。系统进化分析结果显示,CvcoOBP1-7分别与不同的OBP有较近的进化关系。半定量PCR检测结果发现,CvcoOBP1-7在枣实蝇腹部、头部及胸部都有表达,且表达量较高;CvcoOBP1、CvcoOBP2在翅中有表达,但表达量相对较低 ;CvcoOBP1、CvcoOBP5、CvcoOBP6在足中也有表达,但表达量相对较低。【结论】获得并分析了7个CvcoOBP,不同CvcoOBP表达部位和表达量各不相同;CvcoOBP1-6分别属于OBP56g,OBP8a,OBP83a,OBP56h,OBP99c,OBP83ef类型。
枣实蝇 ;气味结合蛋白;组织表达
0 引 言
【研究意义】枣实蝇被列入我国进境植物检疫性有害生物名录。2007 年枣实蝇首次在我国新疆地区被发现,并且对枣果业造成了毁灭性的危害。目前,该虫在新疆仍处于扩展蔓延的态势。研究气味结合蛋白对了解枣实蝇嗅觉用作机制意义深远,并且可以为开发枣实蝇专性引诱剂奠定基础。【前人研究进展】研究人员对昆虫气味结合蛋白做过大量研究,但对枣实蝇的研究还未见报道。气味结合蛋白(odorant binding protein,OBP)是一种存在于昆虫化学感受器官的水溶性蛋白,通常含有135~220个氨基酸序列以及2~3个二硫键[1]。OBP主要存在于昆虫感器淋巴液中,它能够结合疏水性的气味分子,并将它们转运到受体分子,随后嗅觉信号传导通路被激活[2]。OBP家族成员通常含有6个高度保守的半胱氨酸残基,根据半胱氨酸残基数量的变化,OBP被划分为“Classic”, “Minus-C”, “Plus-C”, “Dimer”和 “Atypical” OBP[3,4,5]。近期研究表明,OBP的功能不仅仅是作为一种气味分子的转运载体,更重要的是它能够识别气味分子[6-8]。缺失“LUSH”OBP的果蝇突变体不能够应答气味分子乙醇以及苯甲醛[9,10];此外,该果蝇突变体完全丧失了对其性信息素物质的敏感性[11]。【本研究切入点】有关研究未见文献报道。研究选取枣实蝇成虫头部为研究对象,通过转录组测序,在分子水平探索枣实蝇气味结合蛋白特点,并且通过组织特异性表达,探讨其潜在的功能。【拟解决的关键问题】分析获得枣实蝇气味结合蛋白,对其结构特点以及系统进化关系进行研究,研究气味结合蛋白在不同组织中表达的特异性,为研究枣实蝇嗅觉机制及开发专性引诱剂提供研究基础。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫
新疆吐鲁番地区枣园摘取有枣实蝇幼虫的蛀果,带回实验室等待幼虫化蛹、羽化、收集成虫。饲养条件为27℃,相对湿度60%,光周期12L∶12D。
1.1.2 仪器及设备
恒温振荡金属浴:eppendorf;PCR仪:ABI;凝胶电泳仪:bio-red;移液器:eppendorf;高速离心机:eppendorf。
1.2 方 法
1.2.1 RNA提取及cDNA合成
收集羽化后2~5 d的雄虫和雌虫各50头,在冰上用镊子分别取成虫头部、翅膀、腹部、胸部及足,操作时尽量保证完整性。RNA提取使用RNA trizol提取试剂(TRIzol® LS Reagent,ThermoFisher);cDNA合成使用宝生物试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit,TAKARA);操作步骤参照试剂盒说明书。
1.2.2 转录组测序
提取样品总 RNA 后,用带有 Oligo(dT) 的磁珠富集mRNA。加入 buffer 将 mRNA 打断成短片段,以 mRNA 为模板,合成 cDNA 链,再经过纯化并加入缓冲液洗脱之后做末端修复、加 polyA 并连接测序接头,然后用琼脂糖凝胶电泳进行片段大小选择,最后进行 PCR 扩增,建好的测序文库上机测序。测序结束后,数据经过质控,得到clean reads。将clean reads从头组装成Unigene,然后对每个Unigene进行ORF Finding、SNP分析以及简单序列重复(Simple sequence repeat,SSR)标记分析,然后根据NT(可选),NR,SWISSPROT,KOG/COG数据库对Unigene进行基因信息的注释,然后对注释上的gene进行GO富集分析和KEGG pathway分析。
1.2.3 蛋白序列比对及系统进化分析
将枣实蝇7个OBP进行系列比对,使用MEGA V6.0软件。系统进化分析包括11个桔小实蝇(BactroceradorsalisHendel) OBP、5个地中海实蝇(CeratitiscapitataWiedemann) OBP、黑腹果蝇(Drosophilamelanogaster)以及研究中的7个枣实蝇OBP。氨基酸序列分析前,先将每一蛋白序列的信号肽序列去除,然后对序列进行比对,使用MAFFT v6.864(E-INS-i strategy, BLOSUM62 matrix, 1 000 maxiterate and offset 0);进化分析使用邻位相连法(Neighbor-joining, 1 000 bootstrap replications),使用MEGA V6.0软件。
1.2.4 半定量PCR
以枣实蝇头部、翅、腹部、胸部及足的cDNA为模板,β-actin为内参照基因,分别扩增枣实蝇OBPs。PCR反应体系为:94℃ 3 min;94℃ 30 s,72℃ 30 s,55℃ 40 s;72℃ 7 min;36个循环。反应体系(20 μL)为:cDNA 2 μL,2×PCR Mix 10 μL,正向引物0.5 μL(10 μmol/L),反向引物0.5 μL(10 μmol/L),ddH2O 7 μL。列出引物序列。表1
表1 研究所用枣实蝇OBP基因引物
Table 1 Oligo nucleotide primers for amplifying the OBP genes fromCarpomyavesuvianaCosta
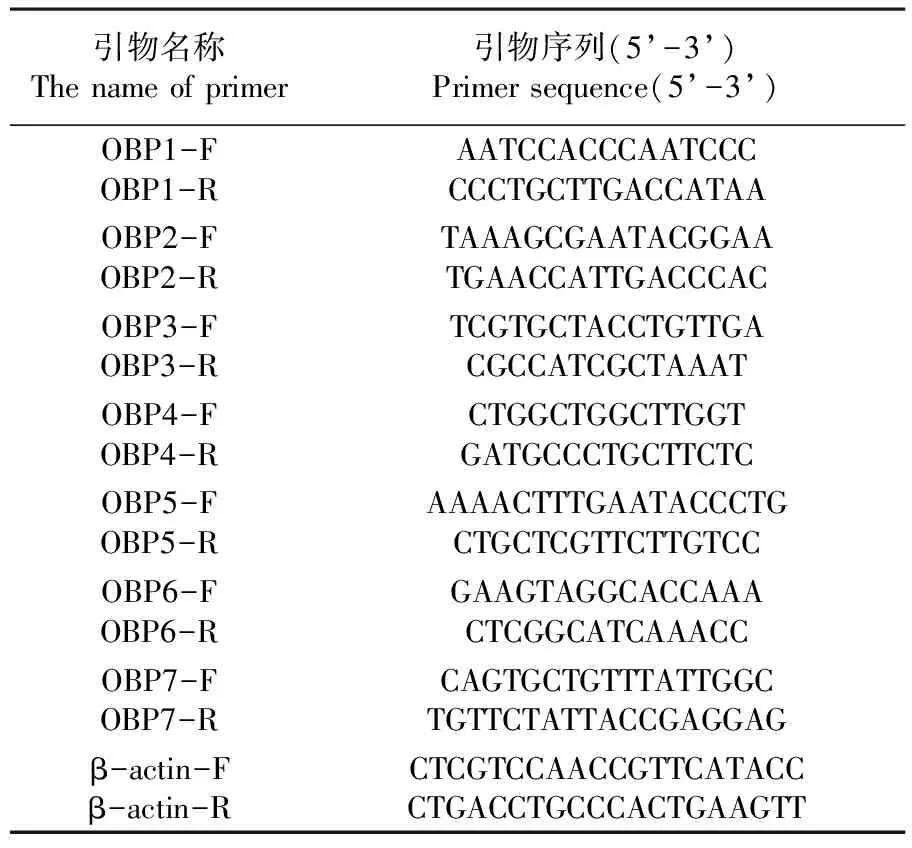
引物名称Thenameofprimer引物序列(5’-3’)Primersequence(5’-3’)OBP1-FOBP1-RAATCCACCCAATCCCCCCTGCTTGACCATAAOBP2-FOBP2-RTAAAGCGAATACGGAATGAACCATTGACCCACOBP3-FOBP3-RTCGTGCTACCTGTTGACGCCATCGCTAAATOBP4-FOBP4-RCTGGCTGGCTTGGTGATGCCCTGCTTCTCOBP5-FOBP5-RAAAACTTTGAATACCCTGCTGCTCGTTCTTGTCCOBP6-FOBP6-RGAAGTAGGCACCAAACTCGGCATCAAACCOBP7-FOBP7-RCAGTGCTGTTTATTGGCTGTTCTATTACCGAGGAGβ-actin-Fβ-actin-RCTCGTCCAACCGTTCATACCCTGACCTGCCCACTGAAGTT
2 结果与分析
2.1 枣实蝇OBP序列获得
转录组测序结果分析后共获得7个枣实蝇OBP序列,分别命名为CvcoOBP1、CvcoOBP2、CvcoOBP3、CvcoOBP4、CvcoOBP5、CvcoOBP6、CvcoOBP7。通过蛋白结构分析发现,7个枣实蝇OBP都具有PBP-GOBP结构域,这是昆虫典型OBP蛋白的重要特征。将7个枣实蝇OBP序列在NCBI数据库中进行蛋白序列比对,除了CvcoOBP6与地中海实蝇OBP序列匹配度最佳外,其他枣实蝇OBP与双翅目实蝇科昆虫苹果实蝇的OBP序列匹配度更好,此外,对每种枣实蝇CvcoOBP1-7的开放读码框、编码氨基酸数量、分子量、等电点、是否存在信号肽进行了统计,结果为开放读书码框长度在于372~510 bp,编码氨基酸数量为了124~170aa,等电点区间为5.6~6.9,分子量大小为13.48~19.53 kDa,除CvcoOBP7没有信号肽序列外。CvcoOBP1-6都存在一段信号肽序列。表2,表3
表2 枣实蝇OBP与最佳匹配序列
Table 2 CvcoOBP with best-hit match sequences

枣实蝇OBP种类CvcoOBPtype比对序列来源(登录号)SourcebySequencealignment(NCBInumber)覆盖率Coverage(%)E值E-value识别率Identity(%)CvcoOBP1苹果实蝇GOBP56h-like(XP_017485615)1002e-7181CvcoOBP2苹果实蝇GOBP99a-like(XP_017472959)1005e-10492CvcoOBP3苹果实蝇PBP-relatedprotein6-like(XP_017493809)1009e-9891CvcoOBP4苹果实蝇GOBP56h-like(XP_017486157)1002e-6267CvcoOBP5苹果实蝇GOBP99a(XP_017464529)1004e-9893CvcoOBP6地中海实蝇GOBP99a(XP_004523508)999e-8884CvcoOBP7苹果实蝇GOBP69a(XP_017477316)821e-8888
表3 CvcoOBP1-7 转录组测序结果
Table 3 Transcriptome analysys of CvcoOBP1-7
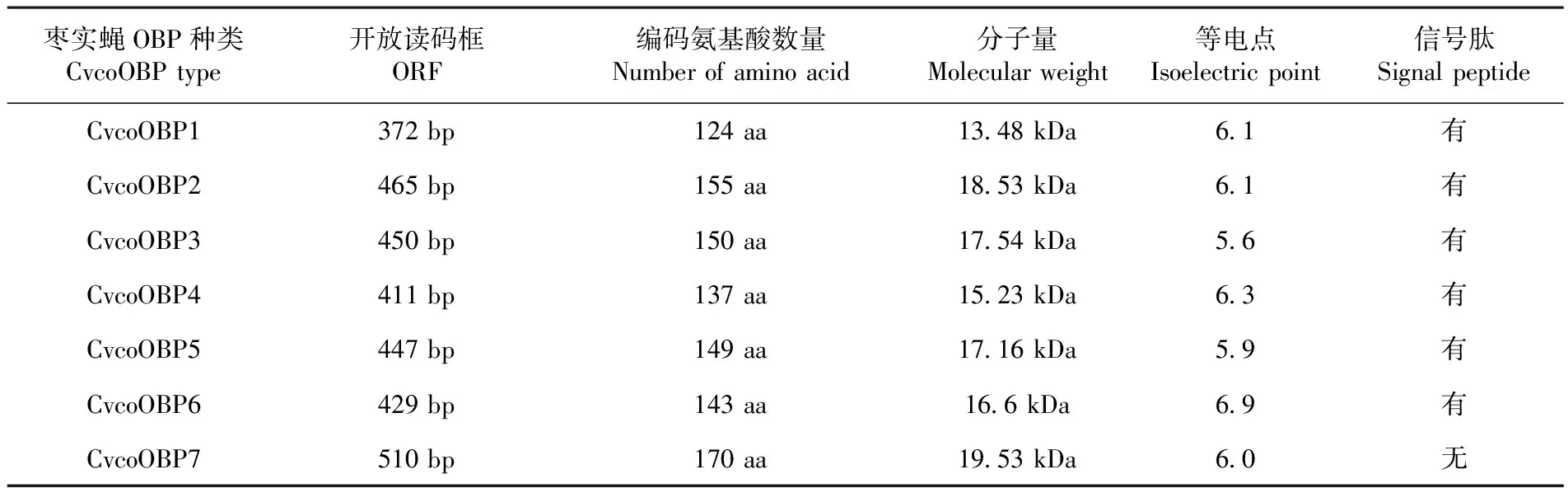
枣实蝇OBP种类CvcoOBPtype开放读码框ORF编码氨基酸数量Numberofaminoacid分子量Molecularweight等电点Isoelectricpoint信号肽SignalpeptideCvcoOBP1372bp124aa1348kDa61有CvcoOBP2465bp155aa1853kDa61有CvcoOBP3450bp150aa1754kDa56有CvcoOBP4411bp137aa1523kDa63有CvcoOBP5447bp149aa1716kDa59有CvcoOBP6429bp143aa166kDa69有CvcoOBP7510bp170aa1953kDa60无
2.2 氨基酸序列比对及系统进化
为了明确枣实蝇OBP是否为昆虫典型OBP以及判断7种枣实蝇OBP所属的亚家族,将7个OBP进行多序列比对,CvcoOBP1、CvcoOBP3、CvcoOBP4、CvcoOBP6、CvcoOBP7具有6个高度保守的半胱氨酸残基,属于“Classic”家族;CvcoOBP2和CvcoOBP5具有4个高度保守的半胱氨酸残基,属于“Minus-C”家族成员(图1)。通过构建系统进化树,分析了7个枣实蝇OBP与双翅目果蝇、桔小实蝇及地中海实蝇的系统进化关系,结果表明:CvcoOBP1 和CvcoOBP2分别与桔小实蝇OBP5(OBP56g)和 OBP1(OBP8a)聚类在一起;CvcoOBP3与桔小实蝇OBP(OBP83a)、地中海实蝇OBP83a-2、黑腹果蝇OBP83a、黑果腹蝇OBP83b聚类在一起;CvcoOBP4与桔小实蝇OBP6(OBP56h)及地中海实蝇OBP56h聚类在一支;CvcoOBP5与桔小实蝇OBP10(OBP99c)、黑腹果蝇OBP99c聚类在一支;CvcoOBP6与桔小实蝇OBP8(OBP83ef)、黑腹果蝇OBP83ef聚类在一支;CvcoOBP7为单独一个进化分支(图2)。图1,图2

保守半胱氨酸残基以星形标出,信号肽以下划线表示
Conserved cysteines are characterised by star, and signal peptide are underlined
图1 枣实蝇OBP多序列比对
Fig.1 Amino acid alignment of OBP inCarpomyavesuvianaCosta
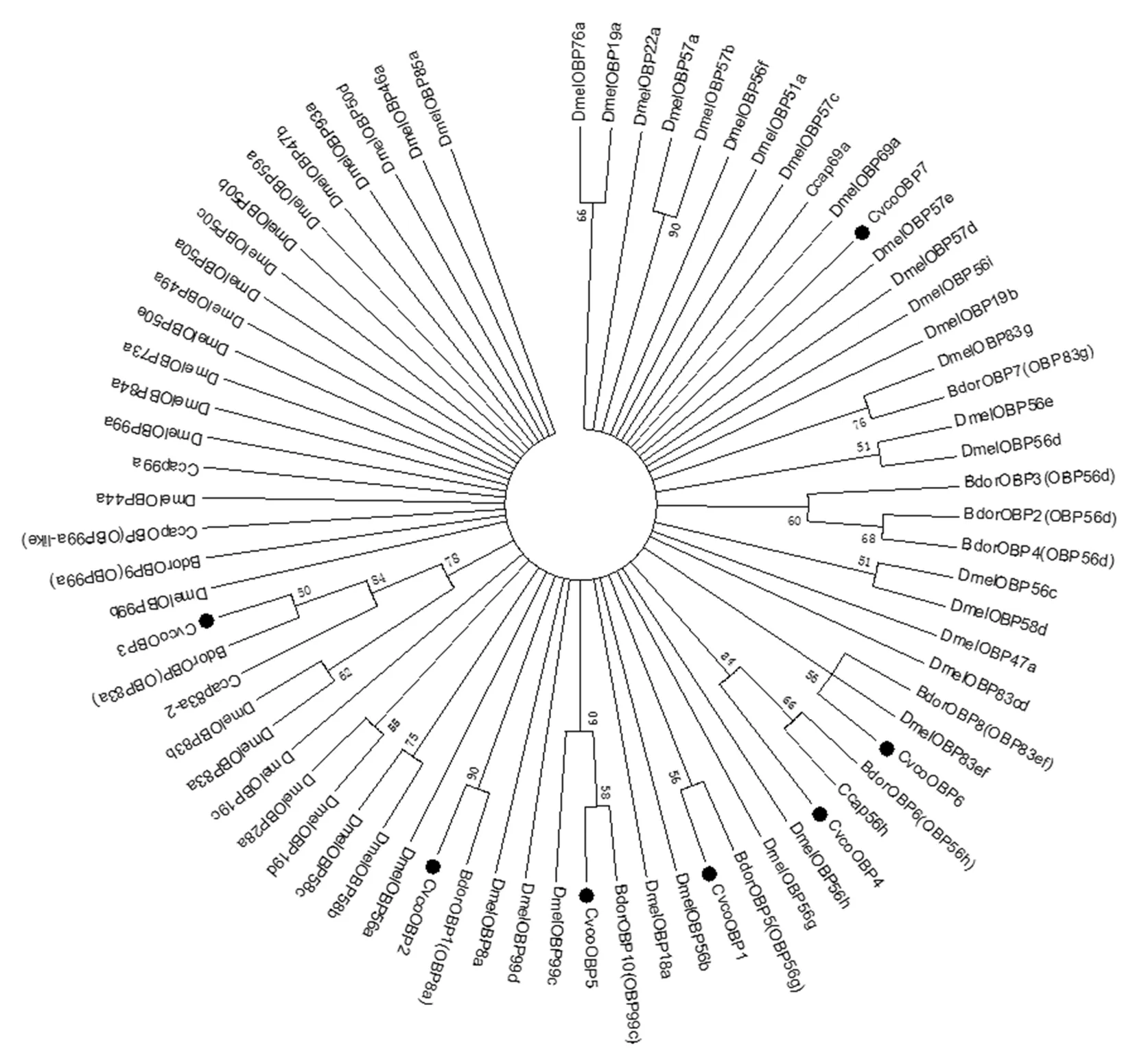
枣实蝇OBP:CvcoOBP,桔小实蝇OBP(BdorOBP),地中海实蝇OBP(CcapOBP),黑腹果蝇OBP(DmelOBP)
BactroceradorsalisHendel OBP(BdorOBP),CeratitiscapitataWiedemann OBP(CcapOBP),DrosophilamelanogasterOBP(DmelOBP)
图2 枣实蝇OBP系统进化
Fig.2 Phylogenetic analysis of OBP inCarpomyavesuvianaCosta
2.3 枣实蝇OBP组织表达特异性
以枣实蝇翅、腹、足、头及胸部的cDNA为模板,β-actin为内参基因,半定量PCR扩增枣实蝇OBP基因。结果表明,CvcoOBP1-CvcoOBP7在枣实蝇腹部、头部及胸部都有表达,且相对表达量较高;CvcoOBP1、CvcoOBP2在翅中有表达,但表达量相对较低;CvcoOBP1、CvcoOBP5、CvcoOBP6在足中也有表达,但表达量相对较低。图3
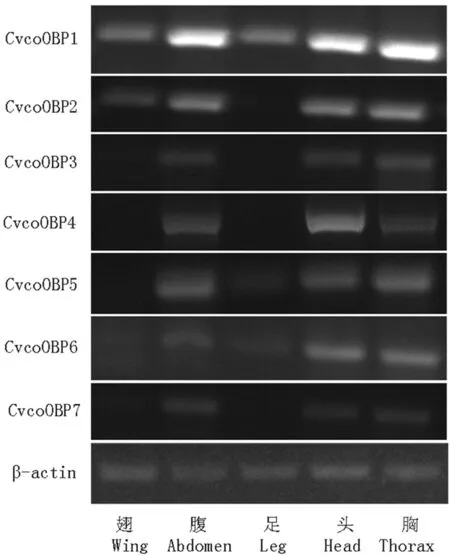
图3 枣实蝇OBP在不同组织中表达量
Fig.3 Expression profiling of OBP in different tissues ofCarpomyavesuvianaCosta
3 讨 论
昆虫嗅觉蛋白在嗅觉系统中发挥重要作用,它能够识别和结合环境中有生理活性的气味分子。在昆虫嗅觉机制研究中,嗅觉蛋白的筛选及克隆和表达是研究基础。因此,研究人员首选通过转录组测序、蛋白序列特征分析以及系统进化分析筛选并获得研究对象的嗅觉蛋白;其中以气味结合蛋白和化学感受蛋白为首要研究对象,还包括三种不同基因家族编码的受体分子:气味受体、味觉受体和促离子型受体。研究首次发现了7个枣实蝇OBP,对其序列进行了生化分析,并且确定了7个OBP类型。CvcoOBP1-6均为典型OBP家族蛋白,OBP7未发现信号肽并且在系统进化分析中单独存在,这可能与测序结果不完整有关。枣实蝇OBP1、OBP2仅与双翅目实蝇科橘小实蝇聚类在一起,说明这两种OBP进化上相对保守;而CvcoOBP3-6同时和实蝇科两种昆虫以及果蝇不同OBP能够聚类在一支,这可能说明它们进化相对较快。承担的生理功能更具有普遍性。尤其是CvcoOBP3分别与桔小实蝇OBP(OBP83a)、地中海实蝇OBP83a-2、黑腹果蝇OBP83a、黑腹果蝇OBP83b聚类在一起,有研究报道地中海实蝇OBP83a-2能够识别信息素成分并且可与其相互作用引起触角电位反应[12]。因此,假设CvcoOBP3也应该与其信息素物质有较高的结合能力,其功能可能涉及识别信息素物质并且将其转运至神经元细胞膜上的受体。CvcoOBP2与OBP8a聚类在一起,在黑腹果蝇研究中发现,OBP8a在幼虫时期表达,其功能涉及到营养物质的感知[13]。根据这一研究报道,推断CvcoOBP2功能参与枣实蝇幼虫在寄主中取食。针对其他类型的OBP,目前在双翅目昆虫中还没未其功能研究的报道。研究中缺乏对枣实蝇OBP功能方面的探索。其主要原因是目前仍然没有报道枣实蝇的信息素物质。因此,在枣实蝇OBP功能研究方面,下一步首选需要筛选出枣实蝇信息素物质以及其寄主挥发性物质,在此基础上,通过竞争结合实验以及蛋白表达沉默探索枣实蝇OBP潜在功能,同时为开发高效引诱剂奠定基础。在组织特异性研究中,枣实蝇OBP基因在翅、腹、足、头、胸中均有不同程度的表达,不同CvcoOBP基因表达部位和表达量各不相同。这与黄蜂Polistesdominulus[14]、瓜实蝇Bactroceracucurbitae[15]等一些OBP表达方式十分相似,进一步确定了OBP不仅在嗅觉机制充当重要角色,它还具有其它生理功能,例如组织再生等。针对OBP基因表达研究,下一步工作应该涉及发育时期表达研究、以及不同性别表达研究,进一步挖掘OBP在昆虫中发挥的生理功能。
4 结 论
研究通过转录组测序发现了7个枣实蝇气味结合蛋白,蛋白序列分析与比对结果显示,CvcoOBP1、CvcoOBP3、CvcoOBP4、CvcoOBP6、CvcoOBP7具有6个高度保守的半胱氨酸残基;CvcoOBP2和CvcoOBP5具有4个高度保守的半胱氨酸残基;除了CvcoOBP6与地中海实蝇OBP序列匹配度最佳外,其他枣实蝇OBP与双翅目实蝇科昆虫苹果实蝇的OBP序列匹配度更好。CvcoOBP1-6都有信号肽,但是CvcoOBP7没有发现信号肽;此外,蛋白序列进化分析结果表明,CvcoOBP1-2仅与桔小实蝇OBP聚类在一起,CvcoOBP3-6同时与实蝇科昆虫及果蝇不同类型的OBP聚类在一支。CvcoOBP1-6分别属于OBP56g,OBP8a,OBP83a,OBP56h,OBP99c,OBP83ef类型。在组织特异性研究中,枣实蝇OBP基因在翅、腹、足、头、胸中均有不同程度的表达,不同的CvcoOBP基因表达部位和表达量各不相同。
References)
[1] Abuin, L., Bargeton, B., Ulbrich, M. H., Isacoff, E. Y., Kellenberger, S., & Benton, R. (2011). Functional architecture of olfactory ionotropic glutamate receptors.Neuron, 69(1):44-60.
[2] Zheng, W., Peng, W., Zhu, C., Zhang, Q., Saccone, G., & Zhang, H. (2013). Identification and expression profile analysis of odorant binding proteins in the oriental fruit fly bactrocera dorsalis.InternationalJournalofMolecularSciences, 14(7):14,936-14,949.
[3] Zhou, J. J., Huang, W., Zhang, G. A., Pickett, J. A., & Field, L. M. (2004). "plus-c" odorant-binding protein genes in two drosophila species and the malaria mosquito anopheles gambiae.Gene, 327(1):117-129.
[4] Hekmatscafe, D. S., Scafe, C. R., Mckinney, A. J., & Tanouye, M. A. (2002). Genome-wide analysis of the odorant-binding protein gene family in drosophila melanogaster.GenomeResearch, 12(9):1,357-1,369.
[5] Xu, P. X., Zwiebel, L. J., & Smith, D. P. (2003). Identification of a distinct family of genes encoding atypical odorant-binding proteins in the malaria vector mosquito, anopheles gambiae.InsectMolecularBiology, 12(6):549-560.
[6] Erika, P. (2000). Discrimination of pheromone enantiomers by two pheromone binding proteins from the gypsy moth lymantria dispar.Biochemistry, 39(30):8,953-8,962.
[7] Pelletier, J., Guidolin, A., Syed, Z., Cornel, A. J., & Leal, W. S. (2010). Knockdown of a mosquito odorant-binding protein involved in the sensitive detection of oviposition attractants.JournalofChemicalEcology, 36(3):245-248.
[8] Zhong, T., Yin, J., Deng, S., Li, K., & Cao, Y. (2012). Fluorescence competition assay for the assessment of green leaf volatiles and trans-β-farnesene bound to three odorant-binding proteins in the wheat aphid sitobion avenae (fabricius).JournalofInsectPhysiology,58(6):771-781.
[9] Wang, Y., Wright, N. J., Guo, H., Xie, Z., Svoboda, K., & Malinow, R., et al. (2001). Genetic manipulation of the odor-evoked distributed neural activity in the drosophila mushroom body.Neuron, 29(1):267-276.
[10] Kim, M. S., Repp, A., & Smith, D. P. (1998). Lush odorant-binding protein mediates chemosensory responses to alcohols in drosophila melanogaster.Genetics, 150(2):711-721.
[11] Xu, P., Atkinson, R., Jones, D. N., & Smith, D. P. (2005). Drosophila obp lush is required for activity of pheromone-sensitive neurons.Neuron, 45(2):193-200.
[12] Siciliano, P., He, X. L., Woodcock, C., Pickett, J. A., Field, L. M., & Birkett, M. A., et al. (2014). Identification of pheromone components and their binding affinity to the odorant binding protein ccapobp83a-2 of the mediterranean fruit fly, ceratitis capitata.InsectBiochemistry&MolecularBiology, 48(100):51-62.
[13] Siciliano, P., Scolari, F., Gomulski, L. M., Falchetto, M., Manni, M., & Gabrieli, P., et al. (2014). Sniffing out chemosensory genes from the mediterranean fruit fly, ceratitis capitata.PlosOne, 9(1):e85523.
[14] Calvello, M., Brandazza, A., Navarrini, A., Dani, F. R., Turillazzi, S., & Felicioli, A., et al. (2005). Expression of odorant-binding proteins and chemosensory proteins in some hymenoptera.InsectBiochemistry&MolecularBiology, 35(4):297-307.
[15] 申建梅,胡黎明,宾淑英,等. 瓜实蝇嗅觉受体基因的克隆及表达谱分析[J]. 昆虫学报,2011,54(3):265-271.
SHEN Jian-mei, HU Li-ming, BIN Shu-ying, et al. (2011). Cloning and expression profiling of an olfactory receptor gene in Bactrocera cucurbitae (Coquillett) (Diptera: Tephritidae) [J].ActaEntomologicaSinica, 54(3):265-271. (in Chinese)
Supportedby:ResearchprojectsoftheStateAdministrationofqualitysupervisionandinspection"MonitoringattractantsforimportantquarantinepestofCarpomya vesuvianaCosta"(2015IK321);NationalScienceandtechnologysupportprogramin12thFive-Year"Studyontheriskandmonitoringtechnologyfortheintroductionofinvasivepests"(2015BAD08B01);AQSIQNon-ProfitIndustryResearchProjects“Researchonthecolonizationfactorsandriskfactorsofalienorganismsandtheircontroltechniques”(201410014).
Cloning and Expression Profiling of Odorant Binding Protein Gene inCarpomyavesuviana(Costa) (Diptera: Tephritidae)
LI Ya-wei1,2,3, ZHANG Xiao-ju2, WANG Ke-ke2, YU Yan-xue1,ZHANG Xiang-lin2, ZHANG Wei2, ZHANG Jun-hua1, YANG Ding3, CHEN Nai-zhong1
(1.ResearchInstituteofPlantQuarantine,ChineseAcademyofInspectionandQuarantine,Beijing100176,China; 2.XinjiangEntryExitInspectionandQuarantinePortal,Urumqi830063,China;3.ChinaAgriculturalUniversity,Beijing100083,China)
【Objective】 This study aims to cloneCarpomyavesuvianaCosta odorant binding protein (CvcoOBP) and analyze expression profile of CvcoOBP in order to lay the foundation of researching CvcoOBP inCarpomyavesuvianaCosta.【Method】Based on transcriptome sequencing of cephalic RNA, the study has analyzed CvcoOBP according to alignment and phylogenetic analysis. The research was also conducted into the tissue specific expression of CvcoOBP by semi-quantitative reverse transcription and polymerase chain reaction (sqRT-PCR).【Result】The study has obtained seven CvcoOBP that had been named respectively as CvcoOBP1-7(GenBank accession number: KU975053, KU975054, KU975055, KX059394, KU975056, KX059395 and KX059396). According to amino acid alignment, CvcoOBP1, CvcoOBP3, CvcoOBP4, CvcoOBP6 and CvcoOBP7 had been proved to be a family of classic OBP, which contained six highly conversed cysteine residues. CvcoOBP2 and CvcoOBP5 belonged to a family of "Minus-C", which had only four highly conversed cysteine residues. Phylogenetic analysis showed that CvcoOBP1-7 had close relationships with different OBPs. Finally, sqRT-PCR revealed that CvcoOBP1-7 could be highly expressed in abdomen, head and thorax. CvcoOBP1 and CvcoOBP2couldbealsoexpressedinwingswithrelativelylowexpression.CvcoOBP1,CvcoOBP5andCvcoOBP6werealsofoundinlegs.【Conclusion】Forthefirsttime,thestudyobtainedandanalyzedsevenCvcoOBP.DifferentCvcoOBParevariousintermsofexpressionsitesandexpressionquantity.TheCvcoOBP1-6separatelybelongstoOBP56g,OBP8a,OBP83a,OBP56h,OBP99candOBP83eftype.
Carpomya vesuvianaCosta;odorantbindingprotein;expressionprofiling
10.6048/j.issn.1001-4330.2017.02.014
2016-11-04
国家质检总局科研项目“重要检疫性入侵害虫枣实蝇监测诱集物质”(2015IK321);国家“十二五”科技支撑计划“重要外来有害生物传入风险及监测技术”(2015BAD08B01);质检公益性行业科研专项“外来生物定殖因子及危害因子研究及防控技术”(201410014)
李亚伟(1987-),男,新疆人,农艺师,博士研究生,研究方向为昆虫化学生态学,(E-mail)110983128@qq.com
陈乃中(1964-),男,湖南人,研究员,博士生导师,研究方向为昆虫化学生态学,(E-mail)chennz@263.net.cn
S436.65;S188
A
1001-4330(2017)02-0313-07

